溶菌酶与ε-聚赖氨酸盐酸盐复合涂膜的制备及性能分析
2019-10-30李秋莹张东栋王司雯钟克利徐永霞李颖畅励建荣
李秋莹,张东栋,王司雯,钟克利,2,徐永霞,李颖畅,孙 彤,*,励建荣,*
(1.渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013;2.渤海大学化学化工学院,辽宁 锦州 121013)
随着消费者对食品包装材料和添加剂安全性的要求越来越高,在食品保鲜过程中,应用安全、无毒的天然化合物已成为趋势。基于天然大分子物质制备的可食性涂膜因其安全、高效、易降解等优点被广泛用于改善各类食品的贮藏,成为食品保鲜方法中的研究热点[1]。壳聚糖作为具有良好生物相容性、抑菌性等优良特性的天然多糖,常用于制备可食性涂膜[2]。普鲁兰多糖作为一种水溶性的微生物多糖,可食无毒、易降解、成膜性佳,也被广泛应用于水果、蔬菜涂膜保鲜[3]。但是,单一壳聚糖涂膜存在透湿性大、膜机械性能差等不足[4];单一普鲁兰多糖涂膜虽有良好的阻气性,但柔软性差,涂膜既脆又硬,且成本较高[3]。研究表明通过几种多糖共混制备复合涂膜能有效弥补单一多糖涂膜存在的不足。吴佳[3]的研究发现,将普鲁兰多糖和壳聚糖共混制备的复合涂膜有效改善了普鲁兰多糖的机械性能及阻氧性,其拉伸强度比普鲁兰多糖膜提高了29.2%。
可食性涂膜可整合不同的活性物质,如天然抗氧化剂和抗菌剂等,提高涂膜的功能特性[1]。王思梦等[5]研究壳聚糖涂膜、壳聚糖和茶多酚复合涂膜对葡萄的保鲜效果,发现复合涂膜保鲜效果显著优于壳聚糖涂膜。溶菌酶是一种天然抗菌蛋白,常用于食品防腐,其可攻击细菌细胞壁中肽聚糖层N-乙酰基己糖胺基团之间的β-1,4-糖苷键,从而导致细胞裂解死亡,对革兰氏阳性菌抑菌效果较好[6]。ε-聚赖氨酸盐酸盐是一种营养型抑菌剂,其安全性高,对革兰氏阴性菌抑制效果较好[7]。溶菌酶和ε-聚赖氨酸盐酸盐均为在我国被批准使用的食品添加剂。目前,在涂膜中整合这两种天然抑菌剂而提高复合涂膜理化性能和抑菌性能的研究较少。
本研究制备壳聚糖和普鲁兰多糖复合涂膜,并添加溶菌酶和ε-聚赖氨酸盐酸盐两种天然抗菌剂,以改善复合涂膜的理化特性和抑菌特性。比较分析不同添加量的溶菌酶和ε-聚赖氨酸盐酸盐对涂膜性能的影响,确定溶菌酶和ε-聚赖氨酸盐酸盐最佳添加量。分析复合涂膜的透光性(透光度)、透水性(水蒸气透过率)、透气性(氧气透过率、二氧化碳透过率)及力学性能(拉伸强度、断裂伸长率)等指标。以水产优势腐败菌荧光假单胞菌为对象,结合细菌微观形态研究复合涂膜的抑菌作用及机理,为其进一步应用提供理论依据。
1 材料与方法
1.1 材料与试剂
荧光假单胞菌为实验室分离的菌株,于-80 ℃保藏。壳聚糖(脱乙酰度大于95%)、普鲁兰多糖上海阿拉丁生化科技股份有限公司;溶菌酶 美国Sigma Aldrich公司;ε-聚赖氨酸盐酸盐 浙江新银象生物工程有限公司;LB营养肉汤、LB营养琼脂培养基青岛高科园海博生物技术有限公司;碱性磷酸酶(alkaline phosphatase,AKP)测定试剂盒 南京建成生物工程研究所;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)相关试剂 北京索莱宝科技有限公司;冰乙酸、丙三醇、磷酸二氢钾、磷酸氢二钠等均为国产分析纯。
1.2 仪器与设备
MLS-3030CH立式高压蒸汽灭菌锅 日本三洋有限公司;LRH-150生化培养箱 上海恒科技有限公司;THZ-D台式恒温振荡箱 太仓市实验设备厂;ZD-9556脱色摇床 常州市凯航仪器有限公司;CS 150 GX3超速离心机、S-4800型场发射扫描电子显微镜(scanning electron microscope,SEM) 日本日立公司;Victor X3酶标仪 新加坡珀金埃尔默仪器有限公司;GS-800拍照系统 美国Bio-Rad公司;FA2104C电子天平 上海越平科学仪器有限公司;SCIENTA-IID超声波细胞粉碎器宁波新芝生物科技股份有限公司;TA.XT Plus型质构仪英国Stable Micro Systems公司。
1.3 方法
1.3.1 涂膜的制备
将一定量的壳聚糖溶解于体积分数1%冰醋酸,使其终质量浓度达到15 g/L,55 ℃下置于磁力搅拌器中,待壳聚糖充分溶解后,向溶液中加入普鲁兰多糖,使其终质量浓度为20 g/L,充分溶解,得到壳聚糖-普鲁兰多糖(CS-PUL)涂膜溶液。在CS-PUL溶液中添加0.6 mg/mL ε-聚赖氨酸盐酸盐和不同量溶菌酶(约70 000 U/mg)(0、1、3、5、7、9 mg/mL),以及在CS-PUL溶液中添加3 mg/mL溶菌酶和不同量ε-聚赖氨酸盐酸盐(0、0.6、1.2、1.8、2.4、3.0 mg/mL),得到不同的含抑菌剂的CS-PUL复合涂膜液(CS-PUL-A)。在涂膜液中添加体积分数0.3%甘油以提高成膜性。搅拌均匀后将上述溶液于224 W超声脱气15 min,静置备用。
分别取40 mL涂膜液在20 cm×20 cm亚克力板上流延成膜,放置于30 ℃鼓风干燥箱干燥12 h,揭膜得到CS-PUL膜和一系列CS-PUL-A膜。
1.3.2 涂膜理化性能测定
1.3.2.1 水蒸气透过率
参考郝晗[8]的方法,测定涂膜的水蒸气透过率。
1.3.2.2 力学性能的测定
参考郝晗[8]的方法,选用TA.XT Plus型质构仪进行涂膜的拉伸强度和断裂伸长率的测定。
1.3.2.3 透光性的测定
参考郝晗[8]的方法,将涂膜均修剪为比色皿大小,贴于比色皿器壁上,在450 nm波长处测定涂膜的透光率,并记录数据。透光性为透光率和膜厚度的乘积。
1.3.2.4 透气性测定
参考郝晗[8]的方法,进行涂膜氧气透过率和二氧化碳透过率的测定。
1.3.3 涂膜抑菌性能研究
1.3.3.1 涂膜抑菌活性测定
参考Son[9]和Huang Weijuan[10]等的方法,采用摇瓶法测定复合膜对荧光假单胞菌的抑制活性。将膜随机切割成直径为6 mm的圆片,并在紫外线照射下灭菌30 min。将已培养的荧光假单胞菌的菌悬液经LB肉汤培养基稀释至约106~107CFU/mL。随后,随机选取一圆片浸入2 mL菌悬液中,然后置于28 ℃振荡培养(161 r/min)。另外,未加膜片的空白组2 mL菌悬液在相同的条件下培养。在培养至0、12、24、36 h和48 h分别取样进行活菌菌落计数。菌落计数通过平板计数法[11]测定。
1.3.3.2 细胞膜完整性测定
取一定量已培养的荧光假单胞菌的菌悬液,3 000 r/min离心10 min,弃上清液。用0.1 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.4)清洗菌体2 次,再用PBS稀释,使菌悬液OD260nm为0.5。向10 mL稀释后的菌悬液中加入5 片切割好的1.3.3.1节膜圆片,置于28 ℃振荡培养(161 r/min)。未加膜的空白组菌悬液在相同条件下培养。每30 min取一定量的菌悬液,经0.22 μm滤膜过滤后,应用酶标仪测定滤液在260 nm波长处OD值,至出现平衡值为止。
1.3.3.3 菌悬液电导率测定
样品的处理同1.3.3.2节。各组样品相同条件下培养后,每间隔10 min采用电导率仪测定电导率,直至达到平衡值。
1.3.3.4 细菌AKP活力测定
样品的处理同1.3.3.1节。在28 ℃振荡培养12 h后,于3 000 r/min下离心10 min,用无菌生理盐水冲洗菌体两次,后用无菌生理盐水调节菌悬液浓度为106~107CFU/mL。然后将菌悬液置于超声粉碎器中在200 W条件下进行超声处理,每次5 s,处理2 min,备用。用考马斯亮蓝显色试剂盒测定菌悬液的蛋白质量浓度。AKP活力测定按AKP测定试剂盒说明书进行。
1.3.3.5 SDS-PAGE分析
细菌蛋白质的SDS-PAGE按照Li Yingqiu等[12]的方法进行,并稍作修改。样品的处理同1.3.3.1节。在28 ℃下振荡培养24 h后,在4 ℃下5 000 r/min离心10 min,用0.1 mol/L PBS(pH 7.4)清洗菌体2 次,收集菌体重悬于PBS(pH 7.4)中,将细菌悬液与样品稀释缓冲液按体积比1∶1混合,沸水煮5~10 min,冷却至室温,离心数秒后,混匀,再离心30 s,取上清液上样,用质量分数5%浓缩胶和质量分数12%分离胶进行SDS-PAGE。凝胶用考马斯亮蓝染色液染色5 h,脱色2 h。采用凝胶成像系统成像。
1.3.3.6 细菌微观形态观察
参考Kockro[13]和Bajpai[14]等的方法进行SEM观察。样品的处理同1.3.3.2节,28 ℃振荡培养杀菌12 h。3 000 r/min离心10 min,去上清液,加入无菌水离心清洗2 次。取10 mL戊二醛(体积分数2.5%),与菌体混匀,固定处理2 h。用无菌水离心清洗2 次后,然后使细胞在梯度乙醇溶液(体积分数分别为50%、70%、80%、90%、100%)中脱水。取适量菌悬液于盖玻片,37 ℃干燥72 h。将菌体喷金处理,采用S-4800型场发射SEM对菌体微观形貌进行观察。
1.4 数据统计与分析
实验所有数据均为重复3 次独立实验所得数值的平均值。用SPSS 19.0软件进行统计学分析。计算平均值和标准偏差,并应用Duncan’s多范围测试。使用Origin 8.5软件作图,并使用回归分析确定5%置信区间的显著差异(P<0.05)。
2 结果与分析
2.1 溶菌酶和ε-聚赖氨酸盐酸盐添加量对复合涂膜理化性能的影响
涂膜中添加一定量的抑菌剂能有效提高抑菌性能,但也会影响涂膜的理化性能。由表1可知,随着溶菌酶添加量的增多,复合涂膜的透光性、透气性及断裂伸长率均降低,拉伸强度增加。溶菌酶结构中的胺基[15]可能与壳聚糖、普鲁兰多糖分子中的羟基分子间存在氢键相互作用形成网状结构,使膜内分子结合更加紧密,增强复合涂膜机械性能和阻气性能;透光性是两种物质相容性优劣的体现[16],可能随着溶菌酶含量的增加,溶菌酶分子不能充分地与多糖基质之间形成分子间作用力,分子相容性变差,造成复合涂膜透光性降低。阻隔性(阻气性和阻水性)是指能够延缓食品与外界环境的气体交换和水分转移的能力,涂膜拥有较强的阻隔性,可以有效防止食品氧化及腐败变质[17]。溶菌酶添加量为3 mg/mL时涂膜透水性最小,同时具有相对较低的氧气和二氧化碳透过性,说明添加3 mg/mL溶菌酶可有效提高复合涂膜的阻隔性。拉伸强度是反映膜强度的指标,断裂伸长率是反映膜韧性的指标[18]。溶菌酶添加量为0~3 mg/mL时,随着添加量的增加,涂膜拉伸强度呈显著上升趋势;而断裂伸长率呈下降趋势,且各溶菌酶添加量差异不显著。添加量增加到3~9 mg/mL时,溶菌酶的增加对涂膜拉伸强度和断裂伸长率的影响无明显差异。因此,当溶菌酶添加量为3 mg/mL时,涂膜有较好的机械性能。

表1 溶菌酶添加量对复合涂膜理化性能的影响Table 1 Effect of lysozyme addition on physicochemical properties of composite coatings
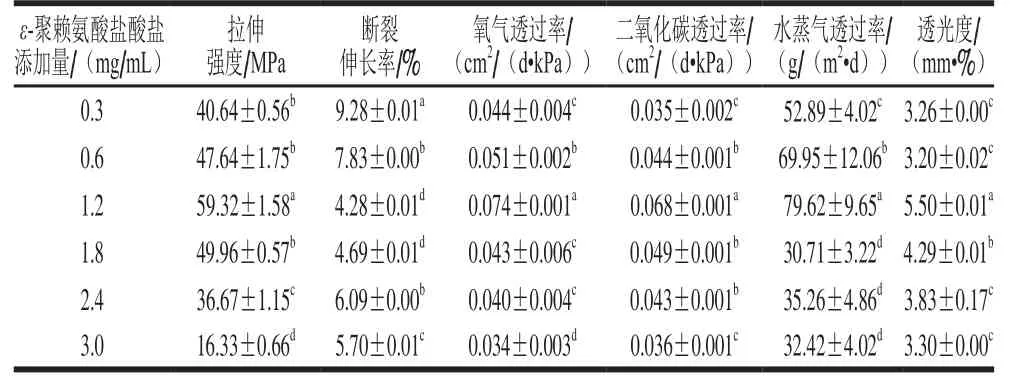
表2 ε-聚赖氨酸盐酸盐添加量对复合涂膜理化性能的影响Table 2 Effect of ε-polylysine hydrochloride addition on physicochemical properties of composite coatings
由表2可知,随着ε-聚赖氨酸盐酸盐添加量的增加,以添加量1.2 mg/mL为转折点,复合涂膜的透水性、透气性、透光性和拉伸强度均为先上升后下降的趋势,而断裂伸长率呈相反趋势。ε-聚赖氨酸盐酸盐添加量为1.2 mg/mL时,复合涂膜拉伸强度最大,但其具有最大透气性、透水性和透光性,涂膜性能较差。添加量达到1.8 mg/mL时,涂膜透水性最低,透气性较低,阻隔性较好,且具有相对较高的拉伸强度,各项性能都比较优良。因此,综合分析各项性能指标,在复合涂膜中溶菌酶、ε-聚赖氨酸盐酸盐的添加量分别以3 mg/mL和1.8 mg/mL为宜。
2.2 复合涂膜理化性能比较
表3比较了CS-PUL涂膜与CS-PUL-A涂膜(溶菌酶添加量3 mg/mL、ε-聚赖氨酸盐酸盐添加量1.8 mg/mL)的理化性能。CS-PUL涂膜与添加了抑菌剂的CS-PUL-A涂膜拉伸强度无显著性差异,而CS-PUL-A涂膜断裂伸长率几乎为CS-PUL涂膜的2 倍,表明添加抑菌剂增加了复合涂膜的韧性。可能是因为溶菌酶和ε-聚赖氨酸盐酸盐溶液中的胺基与多糖分子之间存在相互作用形成网状结构,使膜内分子结合更加紧密。CS-PUL-A涂膜氧气透过率显著低于CS-PUL涂膜(P<0.05),而二氧化碳透过率差异不显著,表明添加抑菌剂后涂膜的阻气性能有所提高,这可能是因为分子之间的相互作用使得复合膜的结构比较紧密,从而降低了氧气的透过率。水蒸气透过率是反映透湿性能的指标,水蒸气透过率越小则阻水性越强[18]。CS-PUL-A涂膜的水蒸气透过率显著低于CS-PUL涂膜,拥有更强的阻水能力。两种涂膜的透光率无显著性差异。综合各指标来看,加入3 mg/mL溶菌酶和1.8 mg/mL ε-聚赖氨酸盐酸盐能有效地改善壳聚糖和普鲁兰多糖复合涂膜的理化性能。Li Xiang等[19]通过将溶菌酶-累托石加入壳聚糖膜中,分析溶菌酶对壳聚糖涂膜的理化性能的影响,结果表明溶菌酶的加入可有效改善壳聚糖涂膜的理化性能。汤秋冶等[20]将ε-聚赖氨酸加入海藻酸钠涂膜中,发现复合膜分子之间形成了强烈的相互作用,其力学性能得到明显改善。

表3 复合涂膜的理化性能Table 3 Physicochemical properties of composite coatings
2.3 复合涂膜抑菌性能分析结果
2.3.1 复合涂膜对荧光假单胞菌的抑制作用
为研究复合涂膜对荧光假单胞菌的抑制作用,比较了空白组、CS-PUL和CS-PUL-A处理组荧光假单胞菌随时间变化生长情况。由图1可以看出,整个培养期,空白组和CS-PUL处理组的荧光假单胞菌数呈逐渐增长趋势,但CS-PUL处理组细菌数量增长更缓慢并且显著低于空白组。可能是壳聚糖的正电荷与细胞表面大分子带负电荷的残基反应,改变了细胞膜的渗透性,导致细菌细胞死亡所致[21]。CS-PUL-A处理组细菌数量呈先降低后增长的趋势。在12 h,仅有CS-PUL-A处理组比0 h初始细菌数量低,表明在此阶段CS-PUL-A涂膜的处理导致荧光假单胞菌死亡。在12 h之后,虽然CS-PUL-A处理组细菌数量逐渐增加,但一直显著低于空白组和CS-PUL处理组,表现出较强的抑制荧光假单胞菌生长的能力。研究结果表明ε-聚赖氨酸盐酸盐和溶菌酶的加入显著增强了涂膜抑菌性能。ε-聚赖氨酸盐酸盐是阳离子表面活性物质,分子中的氨基在溶液中带正电[20],ε-聚赖氨酸盐酸盐的加入可能与壳聚糖产生协同抑菌作用,增加了涂膜的抑菌性。Park等[22]的研究表明在壳聚糖膜基质中加入溶菌酶可以提高壳聚糖的抑菌活性。当细菌的外膜被壳聚糖破坏时,溶菌酶可有效对抗革兰氏阴性细菌。
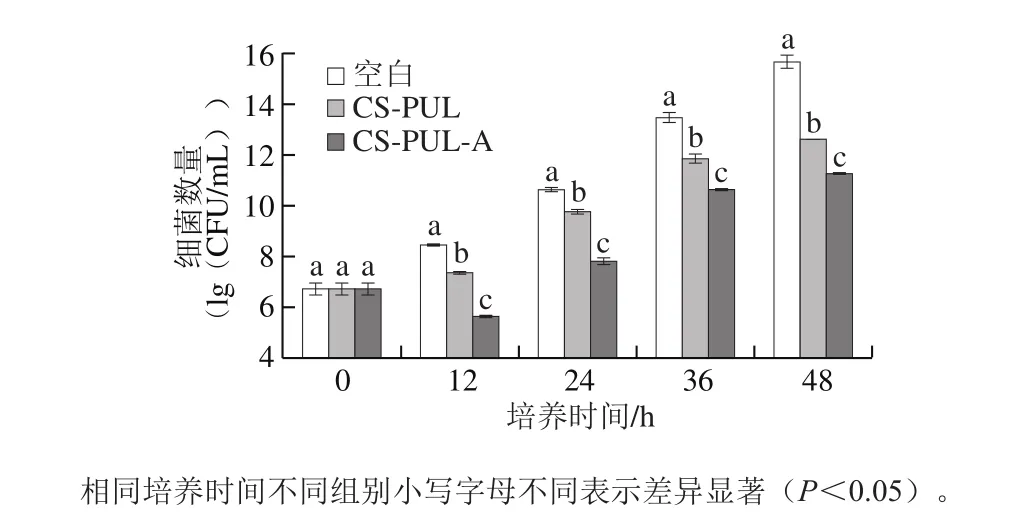
图1 复合涂膜处理对荧光假单胞菌生长的影响Fig. 1 Effect of composite coatings on growth of Pseudomonas fluorescens
2.3.2 涂膜处理对荧光假单胞菌细胞膜完整性的影响

图2 复合涂膜处理的荧光假单胞菌的核酸释放Fig. 2 Release of nucleic acids from Pseudomonas fluorescens treated with composite coatings
细胞膜的完整性是细菌生长繁殖的关键因素之一,若细胞膜完整性被破坏,胞内核酸等大分子物质会发生流失。检测菌悬液在260 nm的OD值变化可反映从细胞质中释放出来的核苷酸量,进而评价细胞膜的完整性[23-24]。图2显示了不同处理组菌悬液在260 nm波长处的OD值随时间的变化情况。随着时间的延长,各组的OD260nm逐渐增加。其中,涂膜处理组OD260nm明显大于空白组,表明涂膜处理使荧光假单胞菌的核酸泄漏到胞外环境中,推测涂膜处理可能破坏了荧光假单胞菌细胞膜的完整性。并且,CS-PUL-A处理组的OD260nm一直大于CS-PUL处理组,表明添加抑菌剂增加了涂膜对细胞膜完整性的破坏。这与蓝蔚青等[25]的研究结果比较一致,其基于壳聚糖、溶菌酶和茶多酚制备复合保鲜剂,观察到复合保鲜剂处理组OD260nm明显大于空白组。
2.3.3 涂膜处理对荧光假单胞菌细胞膜通透性的影响
细菌细胞质膜是K+、Ca2+、Na+等小分子离子的渗透屏障,这是由膜的结构和化学组成来维持和控制的[26]。维持离子稳态对于维持细胞的能量状态非常重要,因此,即使细胞膜的结构有相对较小的变化也会影响细胞代谢并导致细菌死亡[27]。通过测定荧光假单胞菌的电导率可分析涂膜处理对细菌细胞膜通透性的影响。图3显示了不同处理组荧光假单胞菌电导率随其培养时间的变化情况。在0~90 min期间,CS-PUL-A、CS-PUL处理组荧光假单胞菌菌悬液电导率从21.5 mS/cm分别迅速增至24.0、23.7 mS/cm,而空白组电导率增加较少,维持在22.4~22.7 mS/cm,90 min后,各组样品导电率趋于稳定。涂膜组电导率增加意味着涂膜处理影响了细菌细胞膜渗透屏障作用,使细胞内电解质泄漏,而过多电解质的流失最终会导致细菌的死亡。溶菌酶、ε-聚赖氨酸盐酸盐添加至涂膜后电导率增加更为显著,表明抑菌物质的添加加速了胞内电解质的流失[26],而这可能是由于抑菌剂增强对细菌细胞内外膜的破坏造成的。
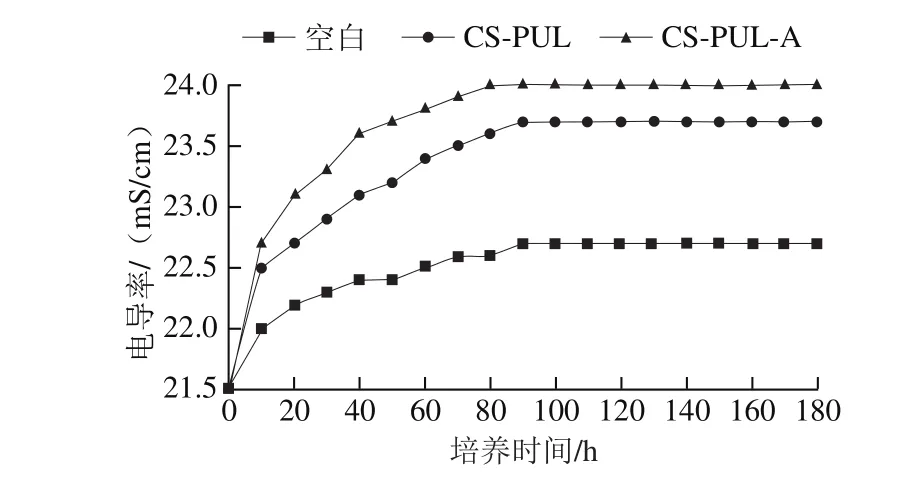
图3 复合涂膜处理的荧光假单胞菌悬液的电导率Fig. 3 Electric conductivity of Pseudomonas fluorescens suspension treated with composite coatings
2.3.4 涂膜处理对荧光假单胞菌AKP活性的影响
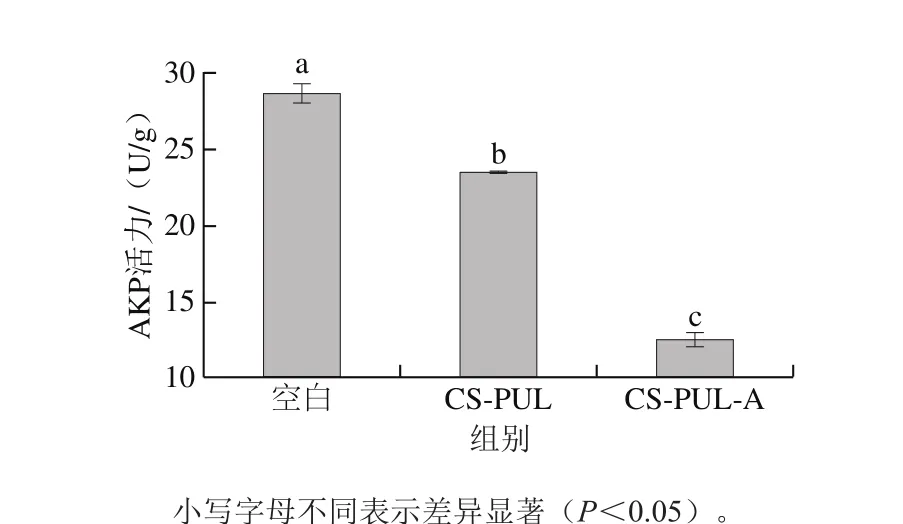
图4 复合涂膜处理的荧光假单胞菌的AKP活力Fig. 4 Alkaline phosphatase activity of Pseudomonas fluorescens suspension treated with composite coatings
AKP通过对底物的去磷酸化作用广泛参与细胞的代谢,是细菌生长繁殖的关键因素之一[28-29]。图4比较了不同处理组荧光假单胞菌培养12 h后AKP活力,涂膜处理12 h时,荧光假单胞菌的AKP活力显著低于空白组,表明涂膜处理可能抑制了AKP的活性。而添加抑菌剂的CS-PUL-A组AKP活力最低,表明抑菌剂增加了涂膜对AKP的活性抑制作用。可能是因为溶菌酶和ε-聚赖氨酸盐酸盐增大对细菌细胞壁和细胞膜的破坏后,影响了位于细胞壁和细胞膜上的AKP活性。这与仪淑敏[30]的研究结果比较一致,其发现茶多酚可以使铜绿假单胞菌细胞膜通透性增加、AKP活性降低。
2.3.5 涂膜处理对荧光假单胞菌蛋白表达模式的影响
图5为涂膜处理组和空白组的荧光假单胞菌培养24 h后的蛋白质SDS-PAGE谱图,泳道1~4分别为蛋白Marker、空白组、CS-PUL组、CS-PUL-A组。涂膜处理组,特别是CS-PUL-A组与空白组的蛋白谱图存在明显差异。空白组蛋白条带更加清晰,泳道中有15 条条带,其中9 条较清晰(R1、R3、R4、R5、R6、R7、R8、R9、R15)。CS-PUL处理组在31.0~15.0 kDa处条带消失。CS-PUL-A处理组的条带中仅有R1、R3、R7(分别约为99.0、70.0、42.0 kDa)3 条较清晰的条带。研究结果表明涂膜对荧光假单胞菌蛋白质有显著的影响,特别是分子质量小于42.0 kDa的蛋白质,而抑菌剂添加后也影响了大分子质量蛋白。在Ye Ruosong等[31]的研究中发现,ε-聚赖氨酸可与DNA结合,进而会影响细菌蛋白质的合成。类似的,Li Yingqiu等[12]发现经ε-聚赖氨酸处理的金黄色葡萄球菌蛋白谱图在约10.5、14.4 kDa处条带消失。蛋白质条带消失的原因可能是细菌蛋白质受到破坏或其合成受到干扰。
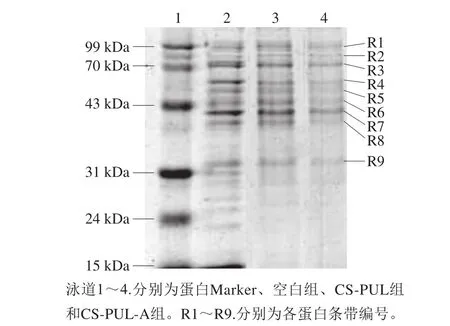
图5 复合涂膜处理的荧光假单胞菌蛋白SDS-PAGE图谱Fig. 5 SDS-PAGE of proteins from Pseudomonas fluorescens treated with composite coatings
2.3.6 涂膜处理对荧光假单胞菌细胞微观形貌的影响
如图6所示,未经处理的荧光假单胞菌细胞显示典型的杆状形态,菌体饱满、完整,形状规则,鞭毛清晰可见;CS-PUL处理后,细菌细胞表现出不规则的变形、皱缩,菌体表面变得粗糙,部分细胞破裂;CS-PUL-A涂膜处理的细菌显示出更严重的变形及细胞破裂,这可能会导致细胞内物质的泄漏,造成菌体死亡。抑菌剂的添加能明显增强复合涂膜对荧光假单胞菌细胞的破坏。通过SEM观察所得结果与上述复合涂膜对荧光假单胞菌的抑制作用及对细菌细胞膜完整性影响的结果一致。蓝蔚青等[21]用复合生物保鲜剂处理荧光假单胞菌,得到与本研究类似的结果。
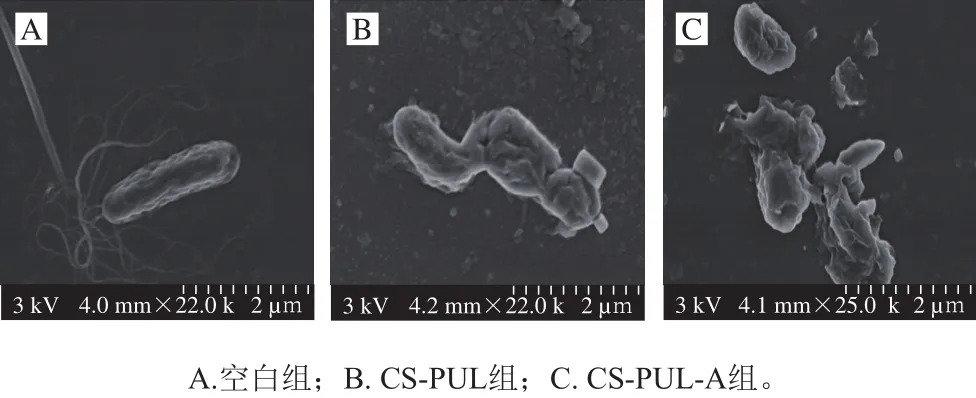
图6 复合涂膜处理的荧光假单胞菌细胞微观形貌的变化Fig. 6 Changes in micromorphology of Pseudomonas fluorescens treated with composite coatings
3 结 论
溶菌酶与ε-聚赖氨酸盐酸盐的添加影响了壳聚糖-普鲁兰多糖复合涂膜的理化性质。根据各项性能指标综合分析,复合涂膜中溶菌酶、ε-聚赖氨酸盐酸盐的添加量分别为3 mg/mL和1.8 mg/mL时得到的复合涂膜较未添加抑菌剂的涂膜具有更优的理化性能,以及更强的抑菌性能。溶菌酶与ε-聚赖氨酸盐酸盐的添加提高了壳聚糖-普鲁兰多糖涂膜对荧光假单胞菌的抑制,并且通过增强对荧光假单胞菌细胞膜完整性的破坏,使细胞膜的通透性增加,细胞内核酸、离子等成分泄漏,增强对细胞蛋白质及蛋白质合成的破坏或抑制作用,最终抑制荧光假单胞菌的生长。
