体外消化模型中酸乳β-酪啡肽-7和β-酪啡肽-5的释放及阿片活性
2019-10-30宁亚茹刘晓宇智童心刘晓涵桑亚新
宁亚茹,李 琪,刘晓宇,智童心,刘晓涵,桑亚新*
(河北农业大学食品科技学院,河北 保定 071000)
食源性活性肽具有广泛的药理和生物活性,开发其在食品中的营养潜力对于人类健康十分必要[1-2]。近些年乳制品在我国食品行业较为火热,尤其是酸乳制品,所以酸乳制品中的生物活性肽是目前研究的热点。酸乳是食源性生物活性肽的重要来源[3],通常由乳酸菌发酵乳品而得,常用发酵菌种为保加利亚乳杆菌(Lactobacillus)和嗜热链球菌(Streptococcus thermophilus)[4]。β-酪蛋白约占牛乳中总蛋白的40%,除了营养价值外,它还能在发酵过程中通过乳酸菌从乳蛋白中释放出生物活性肽[5-7],其中β-酪啡肽(beta-casomorphins,β-CM)是衍生自β-酪蛋白的阿片样肽,在乳蛋白序列内无活性,最初从酶解酪蛋白中分离出来[8]。对β-CM研究最多的是β-CM-7和β-CM-5,它们在β-酪蛋白中的氨基酸位置分别为f60-66和f60-64[9],β-CM-7的摩尔质量为789.93 g/mol,β-CM-5的摩尔质量为579.65 g/mol,均含有常见的N-末端氨基酸Tyr-Pro-Phe-Pro,并具有优先的µ-受体激动剂活性[10]。β-CM可以与中枢神经系统和肠肌丛中的阿片受体结合,抑制其兴奋,并减少肾上腺皮质激素释放,具有促进胃肠运动、镇静镇痛、诱导睡眠、抗焦虑、舒缓神经等多种作用[11]。
已有研究表明,酸乳在消化过程中会释放β-CM,但对其活性作用还缺乏进一步验证。目前国外部分研究对乳制品中β-CM进行了定量分析,但对阿片活性研究数据不足[12-17]。Nguyen等[9]利用液相色谱-串联质谱法鉴定和定量酸乳中的β-CM-5和β-CM-7,认为其无阿片活性;Kunda等[18]通过微量液相色谱与飞行时间质谱相结合在酸乳中检测出50 种生物活性肽,但无活性数据;Cattaneo等[19]研究了体外消化模型中婴儿配方奶粉蛋白质的分解和消化液中β-CM的释放,但没有对其生物活性进行研究。国内的研究主要集中在干酪素来源的β-CM,对酸乳中的β-CM研究较少。张源淑等用胃蛋白酶水解干酪素得到β-CM-7,发现其具有阿片活性,并建立了检测β-CM含量的高效液相色谱(high performance liquid chromatography,HPLC)法[20],能够准确鉴定和定量β-CM[20];张建辉[21]也利用相同的方法得到来自于β-酪蛋白变体的新型β-CM,发现其具有属于阿片活性的镇痛作用;钟海涛等[22]建立了检测β-CM含量的酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法,该方法具有灵敏度高、专一性强的优点,但因β-CM类分子质量较小,制备其多克隆抗体有一定困难,因此不利于生产上推广应用。本实验以普通市售酸乳为研究对象,通过改进以往所建立的HPLC法,对酸乳酪蛋白酶解释放的β-CM进行定性和定量分析,从细胞生物学、小鼠行为学方面对酶解液的阿片活性进行测定,以期为酸乳中β-CM的释放规律及其生理功能的研究提供有效的方法和手段,进一步挖掘酸乳中生物活性肽的营养与功能,并为具有镇痛镇静活性的功能食品开发提供数据。
1 材料与方法
1.1 动物、材料与试剂
凝固型酸乳由保加利亚乳杆菌和嗜热链球菌发酵而成,蛋白含量3.2 g/100 g,乳品酸度为(80±4)°T;菌种由河北新希望天香乳业有限公司提供,接种量5%(质量分数,下同),42 ℃厌氧发酵5 h,凝固后4 ℃过夜进行后熟。
NG108-15神经杂交瘤细胞(即大鼠的神经母细胞×小鼠的神经胶质细胞) 国家实验细胞资源共享平台;KM小鼠(生产许可证号:SCXK(京)2014-0004)北京华阜康生物科技有限公司。
β-CM-7标准品、β-CM-5标准品 武汉百意欣生物技术有限公司;胃蛋白酶(酶活力3 000~3 500 U/mg)、胰蛋白酶(酶活力250 U/mg)、葡聚糖凝胶(Sephadex)G15 北京索莱宝科技有限公司;蛋白质分子质量标准品(1.7~40.0 kDa) 上海威奥生物技术有限公司;乙腈、三氟乙酸(色谱纯)、蛋白定量检测试剂盒、CytokineTMcAMP ELISA Kit 北京百智生物科技有限公司;铅皮 保定万科试剂有限公司。
1.2 仪器与设备
BG-Power 600电泳仪 北京百晶有限公司;Mini Pellicon切向流超滤系统 密理博中国有限公司;RE-52A旋转蒸发仪 上海亚荣生化仪器厂;FD5-2.5冷冻干燥机 美国SIM公司;1260液相色谱仪 美国Agilent公司;1500-823酶标仪 美国Thermo Scientific公司;HH-2数显水浴锅 国华电器有限公司;小鼠游泳缸保定万科试剂有限公司。
1.3 方法
1.3.1 体外消化模型构建
采用体外模拟消化,先获得酸乳胃消化液(VSYSD),再将VSYSD进行肠道消化,获得不同阶段的酸乳胰消化液(VSYPD)。称取300 g酸乳2 份,分别与等体积的35 mmol/L氯化钠混合,用盐酸将混合物调节至pH 2.0,加入胃蛋白酶(酶/底物质量比为1∶100),37 ℃孵育2 h。反应结束后,用1 mol/L NaOH溶液将水解产物调节至pH 7.0使胃蛋白酶失活,获得VSYSD,取一份4 ℃保存;另一份VSYSD加入胰蛋白酶(酶/底物质量比为1∶100),并在37 ℃孵育2 h,通过加入1 mol/L NaOH溶液将pH值调节至11.0,获得VSYPD[23]。取酸乳、VSYSD、VSYPD,10 000 r/min 4 ℃离心20 min取上清液,将获得的粗样品保存用于下一步实验。
1.3.2 酸乳消化程度验证
以酪蛋白为对照,对1.3.1节中得到的样品及酪蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,对比电泳图中的酪蛋白电泳条带,验证酸乳在模拟胃肠道中的消化情况。据文献[23]可知,样品的蛋白质量浓度需要稀释到0.65 mg/mL才能得到清晰美观的电泳条带。因此,测定获得粗样品的蛋白质量浓度,选择合适的稀释度。电泳条件为:质量分数20%分离胶,电压120 V;质量分数5%浓缩胶,电压100 V;上样量10 μL。观察电泳条带,确定酸乳在胃肠道中的消化情况以及短小生物活性肽的生成情况。
1.3.3 β-CM分离纯化
将所得VSYSD和VSYPD用质量分数75%硫酸铵进行沉淀除杂,再将其经4 500 r/min离心,上清液过0.45 μm滤膜后,用1 000 Da滤膜超滤,取分子质量小于1 000 Da部分旋转蒸发、透析、冷冻干燥。采用葡聚糖凝胶G15层析柱对1.3.1节获得的酸乳消化液粗品进行分离纯化。用pH 7.0双蒸水洗脱,样品质量浓度为40 mg/mL,上样量为l mL,流速为1 mL/min,检测波长为215 nm。
1.3.4 β-CM质量浓度测定
HPLC条件:流速1.0 mL/min,柱温30 ℃,波长215 nm,进样量10 μL,流动相溶剂A:0.1%(体积分数,下同)三氟乙酸;溶剂B:100%乙腈+0.1%三氟乙酸,流动相均经真空泵过滤除杂和超声清洗机脱气,梯度洗脱程序为:0~20 min,5%~60%流动相A;20~40 min,60%~5%流动相A;洗脱流速为1 mL/min。
以β-CM-7、β-CM-5标准品制作标准曲线,对消化液及其葡聚糖凝胶G15层析分离各组分进行HPLC分析,利用峰面积通过标准曲线回归方程对β-CM进行定量分析。
1.3.5 β-CM阿片活性的测定
1.3.5.1 NG108-15细胞体外活性测定
NG108-15细胞培养:按张源淑等[24]的方法,用PRIM-1640完全培养液,半悬浮传代培养。
细胞匀浆腺苷酸环化酶(cyclic adenosine monophosphate,cAMP)实验:参照张雨梅等[25]的方法并加以改进。细胞在RPMI-1640完全培养液中37 ℃、5% CO2条件下培养,待细胞贴壁后,弃去上清液,用细胞培养液清洗一次,吹打细胞,调整细胞浓度,镜检计数使每毫升培养液中含NG108-15细胞数基本一致,将细胞均匀分装于50 mL一次性细胞培养皿中,加RPMI-1640完全培养液10 mL,37 ℃、5% CO2条件下预培养约12 h,待细胞贴壁后弃去培养液。
不同处理组的样品(表1)与NG108-15细胞共同培养15 min,加入15%三氯醋酸2.0 mL终止反应。原瓶吹打细胞,3 000 r/min离心10 min,弃上清液;加入50 mmol/L醋酸缓冲液2.0 mL悬浮沉淀,尽量全部移入小瓶,-30 ℃过夜,反复冻融5 次,超声波破碎细胞(300 Hz、3 min);17 000×g离心30 min,取上清液于小瓶中沉淀;加入2.0 mL无水乙醇混匀,离心。合并上清液于小瓶中,测定制备液中蛋白质量浓度,60 ℃烘干,4 ℃保存待测。
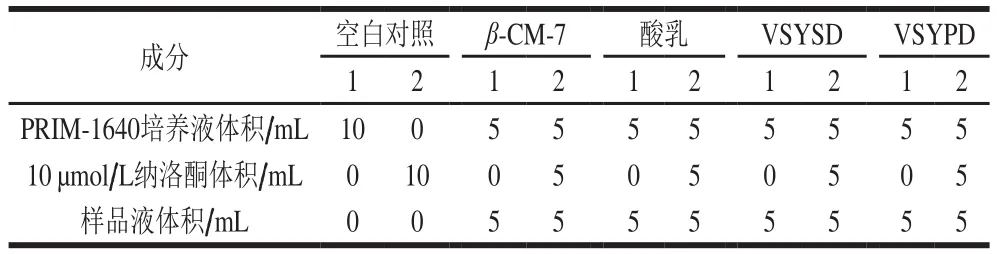
表1 细胞培养液添加量Table 1 Medium formulations
采用CytokineTMcAMP ELISA Kit测定NG108-15细胞cAMP活力,分析步骤和试剂配制均按使用说明书进行。取0.1 mL溶液加入分析试管做双管测定。以每毫克蛋白生成cAMP的物质的量计算。
1.3.5.2 β-CM镇痛实验
β-CM能够通过血脑屏障,可以由血液进入脑组织,最终使小鼠丧失痛觉[26-27],因此通过小鼠的舔足实验来验证β-CM的阿片活性。取雌性小鼠数只,依次放入烧杯内,立即用秒表记录时间。自放入烧杯至出现舔后足所需的时间作为该小鼠的痛阈。凡在30 s内不舔足或者逃避者弃置不用。筛选出合格的雌性小鼠,随机分组,每组8 只,各小鼠编号后重复测其正常痛阈一次,以确保小鼠正常痛阈的准确性。
待测样品腹腔注射:按0.1 mL/10 g给药,第1组给予生理盐水作为阴性对照,第2组给予粗VSYSD,第3组给予粗VSYPD,第4组给予粗VSYSD+纳洛酮(VSYSD+N),第5组给予粗VSYPD+纳洛酮(VSYPD+N)。因为纳洛酮是阿片类物质的特异性拮抗剂,只要纳洛酮能够拮抗样品的镇痛作用,就说明样品中含有阿片肽类物质。分别在给药后0、10、20、30、45、60、90 min后各测小鼠痛阈1 次。若放入烧杯内60 s仍无反应,应将小鼠取出,痛阈按照60 s计[21]。镇痛效果用痛阈提高率表示,计算公式如下。

1.3.5.3 β-CM抗疲劳实验
40 只小鼠随机分为5 组,每组8 只,雌雄各半,第1组注射生理盐水作为对照组,第2组注射粗VSYSD(50 mg/mL),第3组注射粗VSYSD(50 mg/mL)+纳洛酮,第4、5组分别为VSYSD纯化样品高剂量(20 mg/mL)组和低剂量(5 mg/mL)组,腹腔注射给药。给药后30 min进行负重游泳实验,将小鼠置于玻璃游泳缸中游泳,水深80 cm,水温保持在(30.0±0.5)℃,小鼠尾根部负荷5%体质量的铅皮。小鼠自游泳开始至死亡的时间为小鼠的游泳时间。
1.4 数据统计与分析
实验数据处理表示为平均值±标准差,采用SPSS软件t检验法分析差异显著性,P<0.05认为结果差异显著。
2 结果与分析
2.1 酸乳消化程度分析
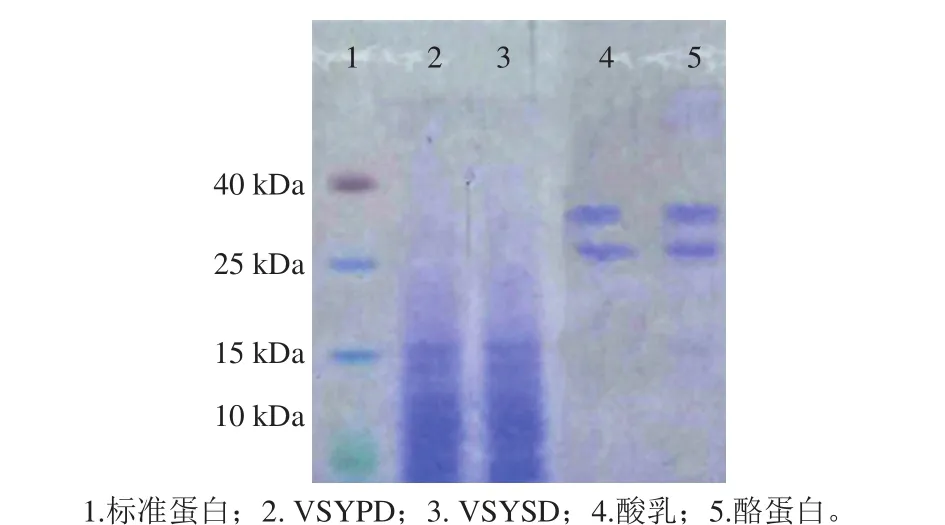
图1 酸乳及消化液的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳图Fig. 1 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis patterns of yogurt and its digests
如图1所示,在泳道2、3上酪蛋白位置均没有条带,但在较小的分子质量处出现条带;酸乳所在的泳道4只有单一的酪蛋白条带,这个现象表明酪蛋白并没有被酸乳发酵过程中的乳酸菌水解。在人工模拟胃肠道消化液中,酸乳中的酪蛋白被胃蛋白酶、胰蛋白酶完全水解并且产生了小分子质量活性多肽。
2.2 酸乳消化液的分离纯化结果

图2 VSYPD的葡聚糖凝胶G15层析结果Fig. 2 Sephadex G15 gel chromatogram of VSYPD
如图2所示,采用葡聚糖凝胶G15层析柱对酸乳消化液粗品进行分离纯化,得到单一峰且峰形良好,响应值较高,收集各组分的洗脱液,待进一步分析。
2.3 酸乳及其消化液β-CM的定量分析
由图3、4可以得出,在酸乳的人工模拟胃肠道消化过程中,β-CM-7在胰腺中的释放量高于在胃中,在酸乳胰腺粗消化液中质量浓度达到0.407 mg/mL,可能是其他β-CM经过胰蛋白酶分解成β-CM-7,从而使β-CM-7在胰腺中的质量浓度升高;而β-CM-5在胃中的释放量高于胰腺中,在VSYSD粗品中达到0.830 mg/mL,其原因可能是胰蛋白酶对β-CM-5进一步分解,使其在胰腺中的质量浓度降低。在未纯化的酸乳粗样品中存在微量的β-CM-7(0.022 mg/mL)和β-CM-5(0.021 mg/mL),但是经过复杂的纯化步骤后,酸乳中的β-CM质量浓度利用HPLC法已经不能检出,此实验结果与Nguyen等[9]发现实验室制备的酸乳中存在微量β-CM-7、β-CM-5的结论相同。综上可知,酸乳在经过胃肠消化后β-CM释放量在胃中达到最高,但相比血管紧张素转化酶抑制肽等生物活性肽其释放量较小[23]。
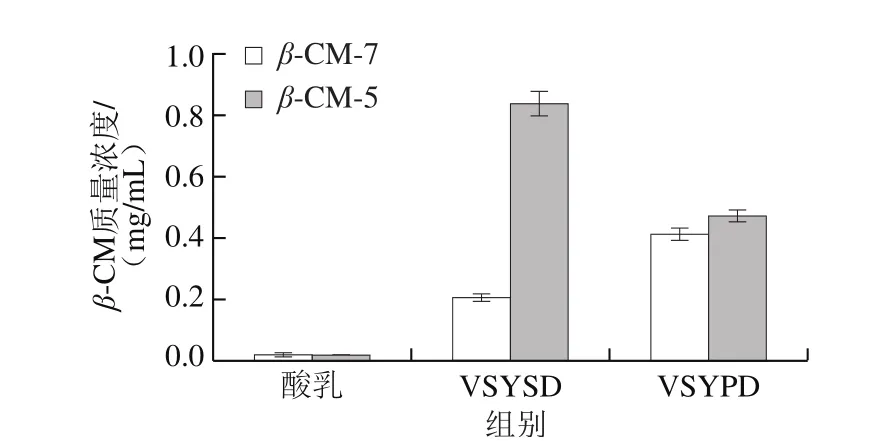
图3 酸乳粗消化液中β-CM质量浓度Fig. 3 β-Casophanin concentrations in crude yogurt digests

图4 纯化后酸乳消化液中β-CM质量浓度Fig. 4 β-Casomorphin concentrations in purified yogurt digests
2.4 酸乳及其消化液β-CM阿片活性分析
2.4.1 NG180-5细胞的cAMP活力
NG108-15细胞是研究阿片类物质活性常用细胞模型,其富含δ-阿片受体,阿片类物质可以与其上受体结合,影响cAMP活力,阿片特异性拮抗剂纳洛酮能拮抗这种作用。
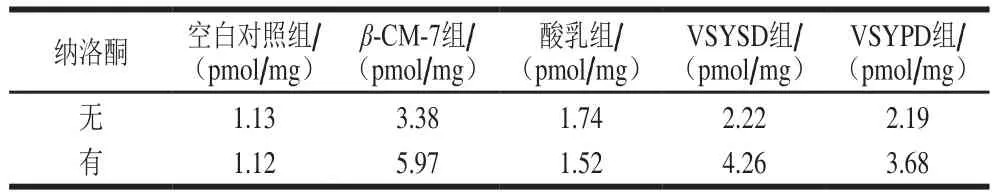
表2 酸乳及其消化液的cAMP活力Table 2 cAMP activity of yogurt and its digests
由表2可以看出,β-CM-7标准品以及酸乳的胃消化液、胰消化液均可刺激NG108-15 cAMP活力,并且它们的刺激作用均可以被纳洛酮拮抗;酸乳样品也可以影响NG108-15 cAMP活力,但是影响较小且不能被纳洛酮拮抗,由此说明酸乳本身不具有阿片活性,经过人体胃肠消化后均可以产生具有阿片活性的β-CM。这与张源淑等[24]的实验结果相一致,证明经过胃肠道消化后,酸乳在胃中产生的物质阿片活性高于肠道中,这与2.3节利用HPLC法检测的β-CM-7、β-CM-5质量浓度的结果相一致。酸乳可以在胃肠消化后释放具有阿片活性的β-CM,这对于食源性生物活性肽以及功能性食品的研究具有重要意义。
2.4.2 小鼠镇痛实验结果
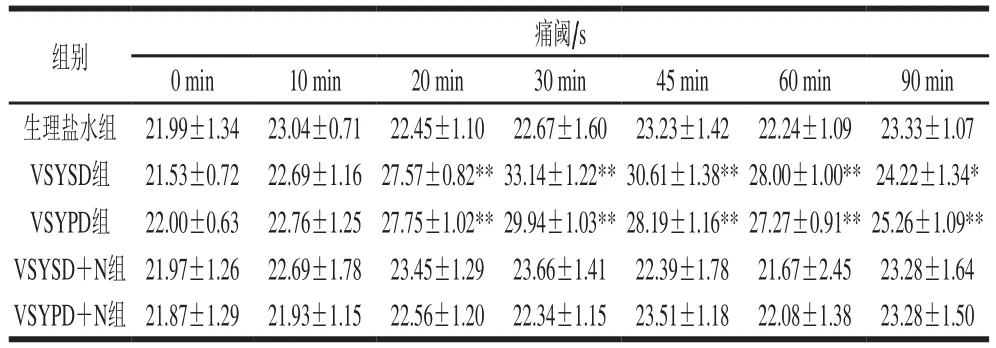
表3 VSYSD和VSYPD的镇痛活性Table 3 Analgesic activity of VSYSD and VSYPD
阿片活性包括镇痛镇静、抗疲劳、促进胃肠道蠕动、促进脂肪代谢、调节内分泌等作用[28]。本研究主要关注β-CM阿片活性中的镇痛以及抗疲劳作用。从表3可以看出,与生理盐水组相比较,VSYSD和VSYPD镇痛活性均从20 min开始有显著性差异,并且在30 min时达到最好效果,从30 min后均有镇痛效果,但呈下降趋势。VSYSD和VSYPD的镇痛作用都能被纳洛酮拮抗,并且VSYSD中纳洛酮的拮抗作用比VSYPD强。纳洛酮是阿片肽的特异性拮抗剂,所以能够确定VSYSD和VSYPD中均含有阿片活性物质,且镇痛作用为阿片肽的活性。
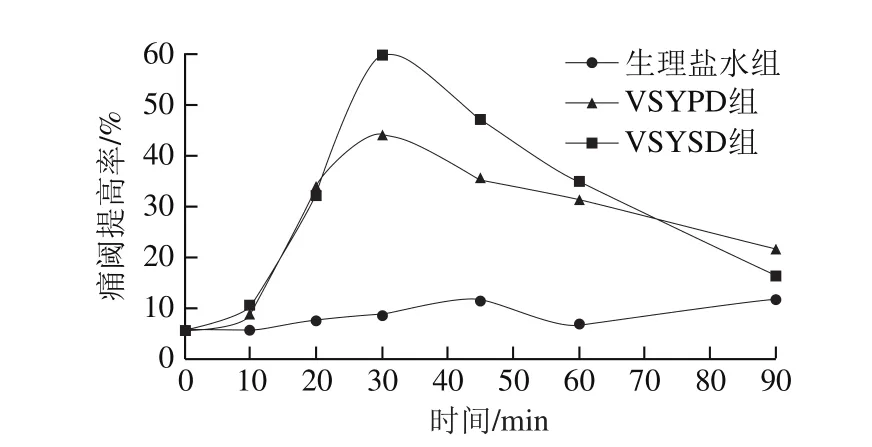
图5 酸乳不同酶解液的痛阈提高率Fig. 5 Effect of enzymatic digests of yoghurt on increasing pain threshold
从图5中可以看出,给药30 min后,酸乳消化液作用于小鼠,使其痛阈提高率达到最高,注射VSYSD的小鼠痛阈提高率达到59.80%;注射VSYPD的小鼠痛阈提高率达到44.37%,VSYSD的镇痛效果要高于VSYPD,这与
2.4.1 节中结果相一致。
2.4.3 小鼠抗疲劳实验结果
疲劳是人体一个极其复杂的生理状态,一般指由于身体状态与精神状态的下降而导致工作能力及工作效率的衰退[29]。本实验通过给药后小鼠负重游泳实验来测定酸乳酶解液中β-CM的抗疲劳作用。
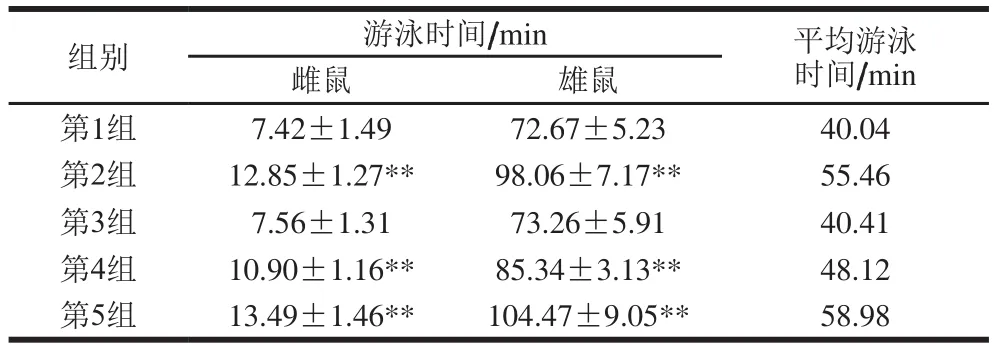
表4 VSYSD对小鼠负重游泳时间的影响Table 4 Effect of VSYSD on swimming time in weight-loading mice
表4结果表明,不同酸乳消化液注射组与生理盐水组相比,均能够延长小鼠的负重游泳时间,注射高剂量纯化后的VSYSD使小鼠的平均游泳时间延长了18.94 min。粗VSYSD、纯化后VSYSD低剂量组和纯化后VSYSD高剂量组与生理盐水组相比均有显著差异,此外注射粗VSYSD+纳洛酮并没有延长小鼠的负重游泳时间,说明纳洛酮拮抗了VSYSD的作用。结果表明,VSYSD具有抗疲劳的作用,且此作用可以被阿片拮抗剂纳洛酮拮抗,因此本研究中酸乳消化液的抗疲劳作用为阿片活性作用。本实验中注射酸乳消化液的小鼠平均游泳时间均长于张建辉[21]、陈亮[30]等的研究结果,说明本实验得到的β-CM具有更强的抗疲劳活性。酸乳β-CM作为食源性生物活性肽安全性高,是极具发展前景的功能因子,在营养健康领域具有很大的研究前景。
3 结 论
本实验优化的分离纯化方法为酸乳中生物活性肽的分离提取提供了有效的手段。酸乳中存在微量β-CM-7和β-CM-5,经过体外模拟消化后β-CM-7、β-CM-5质量浓度显著上升,说明酸乳经过消化液作用后释放出了β-CM-7、β-CM-5。此外,酸乳本身不具有阿片活性,而酸乳胃、胰消化液具有良好的阿片活性,说明人类在饮用酸乳后体内产生了β-CM,且酸乳β-CM具有阿片活性,能够对人体起到镇静舒缓、抗疲劳等功效;动物实验表明VSYSD可使小鼠痛阈提高59.80%,且酸乳消化液在小鼠的体内展现了良好的活性功能。本实验为酸乳中β-CM的释放规律及其生理功能的研究提供了有效的方法和手段,并为具有镇痛、镇静活性功能食品的开发提供数据。
