食品中多环芳烃的安全性研究进展
2019-10-30刘宜奇胡长鹰
刘宜奇,胡长鹰*
(暨南大学食品科学与工程系,广东 广州 510632)
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是一大类具有毒性的环境污染物和食品加工污染物,含有两个或多个稠合芳环[1]。根据稠合芳环的数量,它们可分为轻质PAHs(2~4 个环)和重质PAHs(5 个环或者以上)。长期以来,人们都知道许多PAHs具有致癌性、诱变性和致畸性。PAHs也被证明会诱发人类癌症,如乳腺癌、胰腺癌、肺癌和结肠癌[2-4]。由此,对食品中PAHs的安全性评价具有重要的意义。
近年来,国外逐步完善对各类食品中PAHs含量的检测以及健康风险评估,为更严谨的法律法规提供大量的实验数据。目前,国内正优化食品中PAHs的检测方法,但对PAHs的风险评估研究不多。本文通过对比国内外食品中PAHs的研究,发现国内对奶粉和婴儿食品中PAHs研究不足,相关法规尚未对奶粉和婴儿食品中PAHs含量作出明确限制。本文重点对不同食品中PAHs的健康风险评估和加工方式对PAHs形成的影响进行综述,并对研究现状进行简要总结,为国内健全各类食品中PAHs限量的法律法规提供参考,并为减少食品加工中PAHs的形成提供新思路。
1 PAHs的信息和毒性
美国环境保护署(Environmental Protection Agency,EPA)在1976年根据环境中存在PAHs的种类和致癌性选择了16 个优先监测的PAHs,简称EPA16,即NaP、Anl、Ane、Flu、Phen、Ant、Flt、Pyr、BaA、Chr、BbF、BkF、BaP、InP、DahA和BghiP,具体信息见表1[5],但对食品中PAHs限量尚未规定。在2002年,欧盟食品安全局(European Food Safety Authority,EFSA)把苯并(a)芘(benzo(a)pyrene,BaP)作为食品中致癌物质PAHs发生的标识物[6]。随后,在2008年EFSA声明BaP不是一个可以恰当代表食品中PAHs出现的标识物,为了更加精确地标识PAHs,引入了PAH2(BaP、Chr)、PAH4(PAH2、BaA、BbF)、PAH8(PAH4、BkF、BghiP、DahA和InP)这3 种新标识物[7]。同时,由于EPA提出的16 种优先监测PAHs不能很好地代表食品中PAHs污染情况,EFSA依据相关文献研究总结出了食品中优先监测的16 种PAHs,简称EFSA16(BaA、Chr、BbF、BkF、BaP、InP、DahA、BghiP、BjK、CPP、DBaeP、DBahP、DBaiP、DBalP、5-MeCh和BcF),具体信息见表1[8]。2011年,EFSA对不同食品中的BaP和PAH4作出最大限值规定[9]。而国内GB 2762—2017《食品安全国家标准 食品中污染物限量》[10]对不同种类食品的BaP限制和食品的种类还是沿用GB 2762—2012《食品安全国家标准 食品中污染物限量》,尚未进一步修订。由于食品基质的多样性和复杂性,部分PAHs检测的准确性和灵敏度不足;同时相关毒理学尚未研究清楚,给食品中PAHs的权威标准的建立带来一定的障碍。目前,针对食品中哪些PAHs可作为16 种优先监测的物质,各权威机构尚未达成共识,所以EFSA16和EPA16被不同学者视为食品优先监测的PAHs。对于食品中BaP和PAH4的最大限值,我国和欧盟的限量值见表2。而我国对PAHs的危害性评价,仅依据单一的BaP,与欧盟标准中食品分类的全面性和细致性存在不小差距,这需要加快对PAHs的毒理学研究和建立国内不同地区和不同群体的膳食暴露风险评价体系。
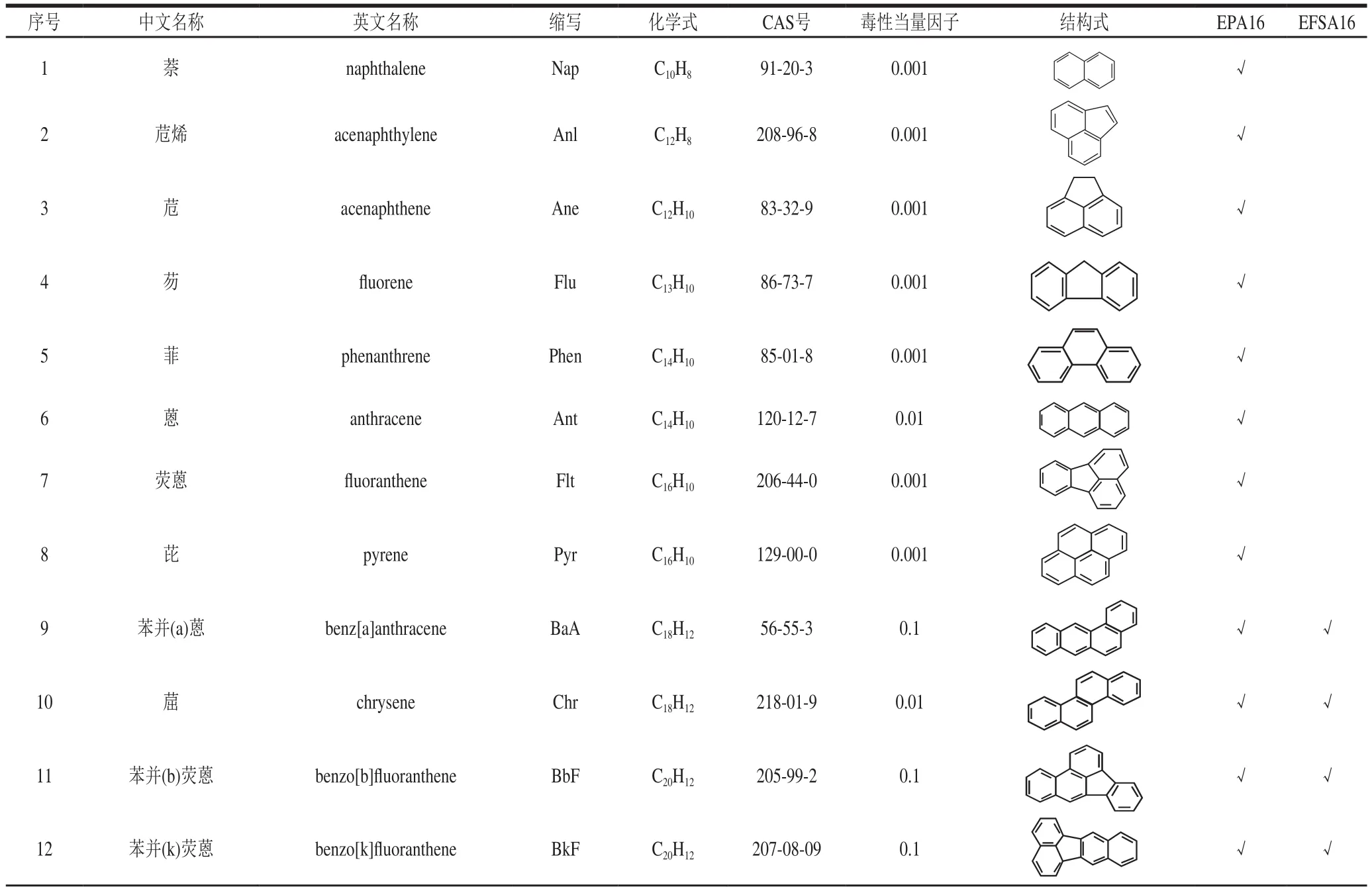
表1 EPA16和EFSA16的信息及毒性当量因子[6,8]Table 1 Chemical information and toxic equivalent factors of EPA16 and EFSA16[6,8]
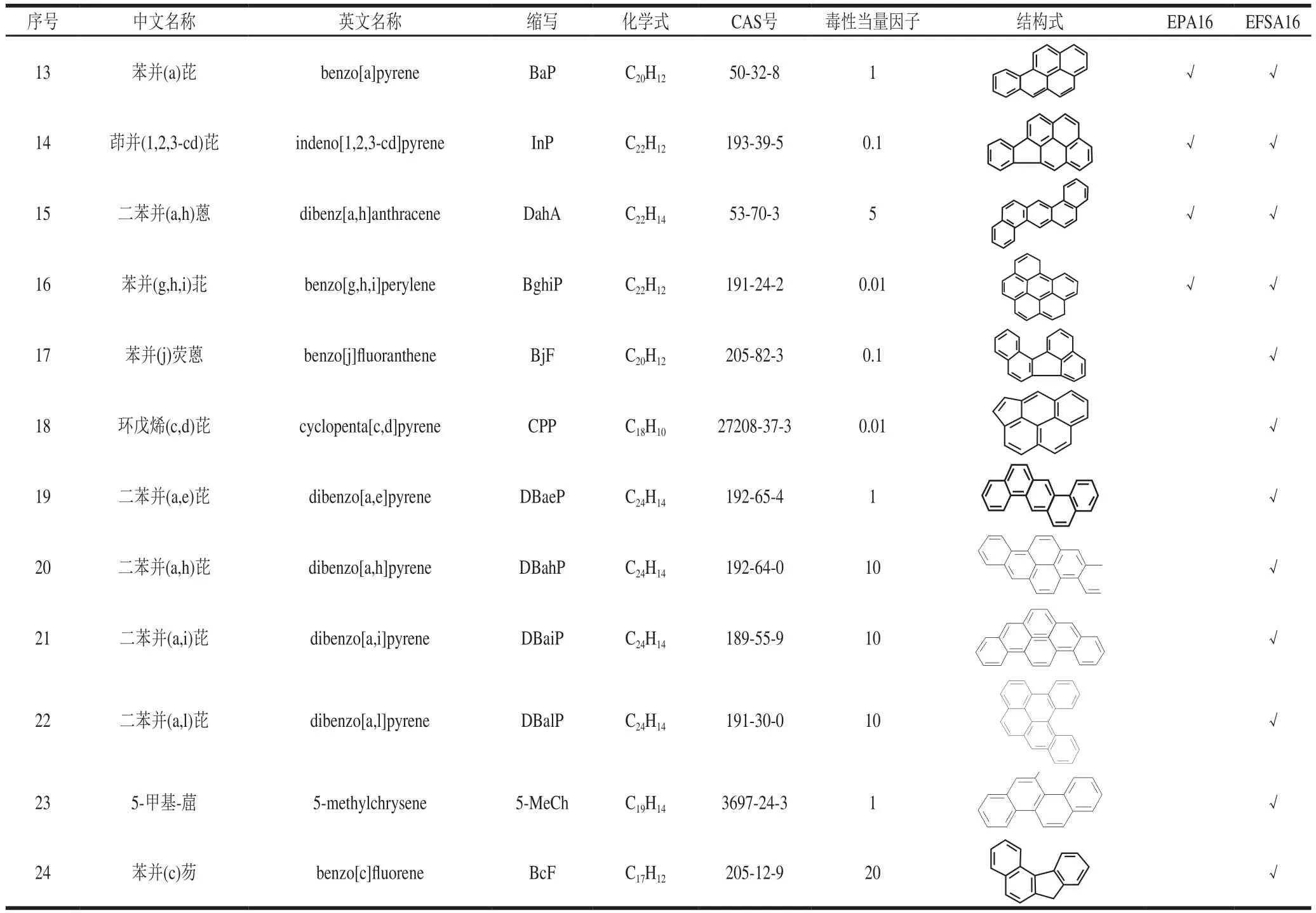
续表1
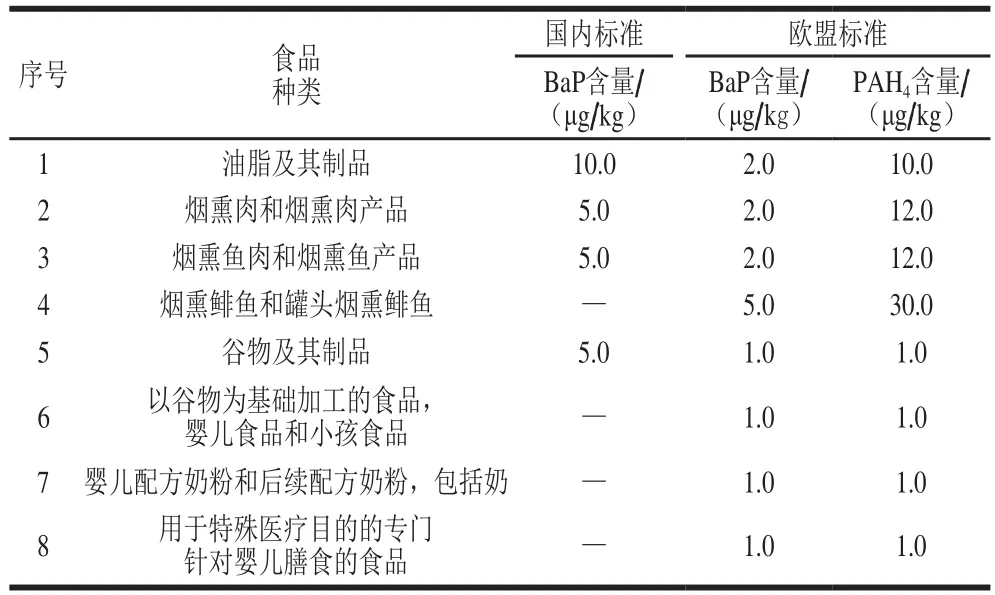
表2 国内外对食品中BaP和PAH的最大限值[9-10]4Table 2 Maximum allowable limits of BaP and PAH4 in foods worldwide[9-10]
PAHs不仅会引发多种癌症,还可能引发非基因毒性疾病(如糖尿病和心血管疾病)[11-12]。PAHs在食物链中的持续生物累积,增加了人体对PAHs摄入的可能性,从而导致生命体的代谢缺陷。PAHs的存在阻碍了葡萄糖稳态和β-细胞功能的代谢活动,具有引发2型糖尿病的潜在可能性[13-15]。连续的环境和饮食(烧焦和烧烤肉)暴露已成为癌症和非基因毒性疾病发生的重要偶然因素之一[11]。Rozentale等[16]通过人肝癌细胞和小鼠胚胎成纤维细胞系进行体外毒性实验,发现经臭氧降解处理后,BaP溶液中的细胞毒性显著增加,表明其对食品安全有明显的负面影响。Chanyshev等[17]也通过诱导雌鼠肝脏中的一些遗传性变化,包括改变miRNA的合成和前列腺癌细胞中目标基因表达的变化,间接说明了外源物BaP的毒性。
Hummel等[18]采用加速器质谱来确定[14C]-BaP在人体给药后(46 ng,比人类膳食每日暴露低一个数量级,比动物致癌模型低数百万倍)的人体药代动力学,为了评估食物与复杂PAHs混合物共同给药的影响,分别给予志愿者吃含有46 ng [14C]-BaP的药、罐头烟熏鲑鱼(含有46 ng BaP)和烟熏鲑鱼(含有460 ng BaP),发现膳食烟熏鲑鱼(含有460 ng BaP)后,人体能减少和延迟对BaP吸收,这可能是富含脂质的鲑鱼以某种方式隔离[14C]-BaP或改变吸收途径,表明了食物基质效应是影响[14C]-BaP药代动力学的因素。
目前,关于PAHs生殖毒性的证据有限,但可证实BaP会对小鼠生殖能力造成损伤。PAHs对人类的影响以及PAHs的生物标记物暴露状况主要是参考职业工作和环境暴露量,这些数据为PAHs的风险评估提供数据基础。据此,联合国粮食及农业组织认为每天摄入10 ng/(kg·d) BaP会对人体健康造成危害[19]。
由大量的动物实验和细胞实验可以确定PAHs的致癌性和致畸性,但PAHs的不同暴露量对人体造成健康危害的程度和机理尚未明确,所以对PAHs的安全性评价具有十分重要意义,以保证人类避免暴露在此危险中,特别是膳食暴露危险。
2 PAHs的安全评价方法
食品安全风险评估指对食品和食品添加剂中生物性、化学性和物理性危害对人体健康可能造成的不良影响所进行的科学评估,包括危害识别、危害特征描述、暴露评估、风险特征描述等。目前,国内外主要通过暴露限值和终生致癌风险值来评价PAHs对不同人群造成健康风险的可能性。在1992年,Nisbet等[20]提出了PAHs的毒性当量因子(toxic equivalent factor value,TEF),假定BaP的TEF为1,通过其他PAHs对人体的危害性与BaP比较来确定TEF,接着把各PAHs的浓度和其TEF相乘,再累乘,得到的数值为毒性等效剂量(toxic equivalent quantity,TEQ),具体计算见公式(1)[21]。此毒性当量因子一直沿用至今[6,8]。

式中:Ci表示第i个PAHs的含量/(ng/g);TEFi表示第i个PAHs的毒性当量因子。
此外,可采用暴露限制(margins of exposure,MOE)法评估PAHs在膳食中的暴露量对人体健康产生危害的风险大小,认为MOE值越大,暴露风险越小,危害人体健康风险越小(MOE≤10 000为可能存在对人体健康危害的风险,MOE>10 000则表示存在对人体健康危害的可能性很小)[22]。将MOE法应用于遗传毒性致癌物风险描述上,即用实验动物致癌剂(或人群致癌剂量)和人群摄入量的比值来描述风险。MOE值越大,则遗传致癌物暴露风险就越小。MOE用公式(2)计算,式中的CDI计算见式(3)[23-25]。
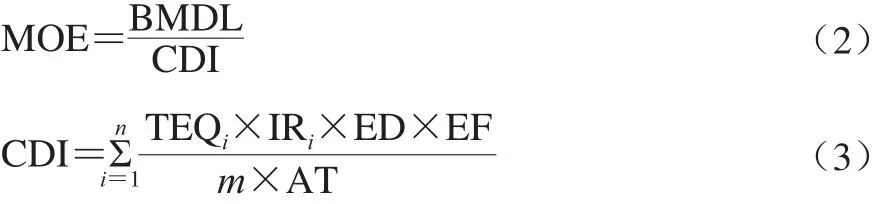
式中:BMDL(基准剂量下限值,benchmark dose lower confidence limit)等效于与每天摄入与PAHs毒性相当的BaP含量(0.007 mg/(kg·d))[26];CDI是长期每天等效BaP的PAHs的摄入量/(mg/kg mb);TEQi是食物中第i个PAHs的BaP等效含量/(ng/g);IRi表示每天膳食量/(g/d);ED为暴露时间(70 年)[27];EF为每年暴露的时间(365 d);m表示人体质量/kg;AT表示人寿命(70 年)。
PAHs的健康风险评价主要评价其对人产生的终生致癌风险(incremental lifetime cancer risk,ILCR),即在一定时间内(终生)暴露于一定剂量的致癌污染物而产生的超过正常水平的癌症发病率。ILCR值小于10-6认为是可接受的风险水平,ILCR值大于10-4表示存在严重危险,10-6<ILCR<10-4认为是存在潜在致癌危险的[2,28-29]。饮食中PAHs的ILCR评价用公式(4)表示[30]。

式中:SF为BaP致癌斜率系数,基于美国环保局的综合风险信息系统[31],认为其是一个几何平均值,即7.3 mg/(kg·d);CF为转换因子(10-6mg/ng)。
目前风险评估技术还处于发展阶段,评估过程中的很多不确定性对定量评估也有一定的约束。而我国对PAHs的安全性评估多数参照国外的方法,常用的MOE和ILRC评价方法的优缺点见表3。
3 食品中PAHs的含量及其安全性分析
PAHs通过不同途径污染食品[33],具体如图1所示。人类社会在工业发展过程中会导致环境中PAHs浓度的增加,环境中PAHs则通过空气、水和土壤等途径而在植物和动物中积累,最终成为人类的食物。在各种途径中,食物是人类接触PAHs的主要途径,特别是在不吸烟的人群中。生水果,生蔬菜和生鱼类中的PAHs与土壤、空气和水中存在PAHs有关,这也是EPA16既作为环境中优先监测污染物又作为食品中优先监测污染物的主要原因。PAHs的摄入主要通过食用加工(烧烤、烘烤、油炸、烟熏、腌制和干燥)后的食品,而食品中PAHs的产生与食品加工的热源、加热距离、食品装置的设计、燃料的种类等多种因素有关。因此,烹饪过程中会不可避免地产生PAHs。

表3 MOE和ILRC评价方法的优缺点Table 3 Advantages and disadvantages of MOE and ILRC evaluation methods
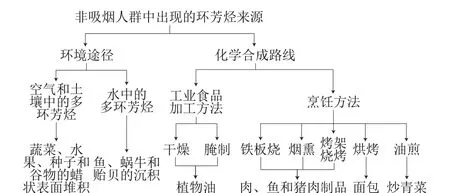
图1 食品中PAHs的污染途径[32]Fig. 1 Contamination routes of PAHs in foods[32]
食品中存在多种PAH,而每种PAH的毒性不一样,且其与人类毒性作用的机理和途径也不尽相同,目前对食品中PAHs的安全性评价主要通过PAHs毒性等效于BaP来评估其安全性。Zhu Yuanyuan等[34]对中国西南高致癌发生地区进行膳食调查与研究,发现此地区平均每日摄入PAHs的毒性等效于平均每日摄入BaP 6.07×10-6mg/(kg·d),城市居民的ILRC值为3.7×10-5,农村居民的ILRC值为6.1×10-5,与中国其他地区的ILRC风险性相当,但有10.7%城市居民和2.1%农村居民的ILRC值超过严重危险水平(10-4),表明了膳食暴露的PAHs是该地区高癌症的潜在暴露源,需要制定进一步的癌症风险控制策略。
3.1 婴儿配方奶粉和母乳
EFSA在(EU)No 835/2011中确定了婴儿配方奶粉和后续配方奶粉,以及婴儿食品中的BaP和PAH4的容许限量均为1 μg/kg[9]。EFSA在2007年9月27日报告了欧盟16 个成员国食品中多环芳烃的情况,特别关注了婴儿和幼儿食品中BaP含量的情况,没有发现任何样品超出BaP的容许极限值1 μg/kg[35]。Ciecierska等[36]发现波兰的婴儿配方奶粉和后续配方奶粉中19 种PAHs(Phen、Ant、Pyr、Flu、BaA、Chr、5-MChr、BbF、BkF、BaP、DahA、DalP、BghiP、DaeP、BjF、IcdP、CcdP、DaiP和DahP)的平均含量分别为1.76 μg/kg和4.58 μg/kg,日均暴露量分别为39.3 ng/(kg·d)和100.8 ng/(kg·d);而BaP的日均暴露量为3.04 ng/(kg·d),其MOE值为32 900,是成人暴露限值的2 倍,所以对于波兰婴儿配方奶粉、后续配方奶粉和婴儿食品中PAHs的危害风险比较低。
Iwegbue等[37]探究了尼日利亚婴儿不同阶段所使用的婴儿配方奶粉中PAHs的含量及其安全性评价,通过气相色谱-质谱联用仪(gas chromatography-mass spectrometry,GC-MS)检测出0~6、6~12 个月和1~3 年、0~12 个月阶段的婴儿奶粉中EPA16的含量范围分别为0.102~1.980、0.054~1.980、0.081~2.540 μg/kg和0.51~0.70 μg/kg;所有婴儿奶粉中的BaP含量均低于欧盟委员会允许限制1 μg/kg;根据EFSA指南,估算出BaP的日均暴露量为nd(未检出,下同)~2.67 ng/(kg·d),PAH4的日均暴露量为nd~11.20 ng/(kg·d),PAH8的日均暴露量为nd~34.96 ng/(kg·d);同时,BaP、PAH4和PAH8的MOE值均大于10 000。表明这些产品对婴儿没有健康风险。
Santonicola等[38]对意大利婴儿食品市场中牛奶、鱼和肉进行抽样检测,发现牛奶中14 种PAHs(Ant、Flu、Phen、Ane、Flt、Pyr、BaA、Chr、BbF、BkF、BaP、DahA、BghiP和IcdP)平均含量为52.25 μg/kg,鱼和肉中PAHs平均含量为11.82 μg/kg,其中18.2%的牛奶和5.6%的肉和鱼中BaP含量超过了欧盟限制值(1 μg/kg);在PAHs摄入最大值和极端摄入量(2 倍PAHs摄入平均值)时,酸奶中BaP和PAH4的MOE值均低于10 000,这表明婴儿的奶制品比肉和鱼制品有更高的PAHs含量(具有显著性差异),应更关注儿童弱势群体的安全健康。Kim等[39]对美国非抽烟哺乳期女性的母乳进行PAHs检测,发现乳脂中Phen、Flu、Flt和Pyr的平均含量分别为11.8、3.0、1.6 ng/g和1.1 ng/g,而其他9 种PAHs(包括BaP)未检出;Phen的日均暴露量为110.3 ng/(kg·d),低于引起健康危害剂量的3 个数量级;同时,认为婴儿所摄入的47.9%~81.4% PAHs是由母乳摄食产生的。
Luzardo等[40]发现西班牙的人初乳和成熟乳中均含有Nap、Flu、Phen、Flt、Pyr、BaA和Chr,其中16.67%的人初乳样品中出现了BaP。Pulkrabova等[41]以母乳中PAHs含量作为评估大气对捷克女性的PAHs暴露量影响的指标,发现母乳中出现24 种PAHs(5-MeCh、Ane、Anl、Ant、BaA、BaP、BbF、BcF、BghiP、BjF、BkF、Chr、CPP、DBahA、DBaeP、DBahP、DBaiP、DBalP、Flu、Flt、InP、Nap、Phen和Pry),在同一个母乳样品中至少可检测到17 种PAHs。同时在工业化程度高的地区和冬季,母乳中的PAHs含量更高,当地婴儿中的30%~95% PAHs暴露量来自于摄入的母乳;不抽烟女人的母乳脂质中PAHs含量范围为0.71~389.00 ng/g,平均含量为31.8 ng/g。
Yu Yanxin等[42]用GC-MS对40 名中国北京非吸烟妇女的母乳、胎盘和脐带血中的PAHs含量进行测定,发现母乳、胎盘和脐带血的脂质中PAH15(Ane、Anl、Flu、Phen、Ant、Flt、Pyr、BaA、Chr、BbF、BkF、BaP、IcdP、DahA和BghiP)的中值分别为278、819、1 370 ng/g,其中毒性等效BaP的中值分别为11.2、16.2、13.1 ng/g,并计算出北京婴儿通过母乳摄食PAHs量为3.0~102 ng/(kg·d),其摄入量比引起健康危害剂量低3~4 个数量级,认为不太可能存在安全隐患。
国内对婴儿奶粉和婴儿食品中所含的PAHs逐渐重视起来,但对于这方面的研究尚处在初步阶段,目前主要是研究奶粉中PAHs的检测方法[43-44],对于市场中多种多样奶粉中的PAHs数据库尚未建立,有待进一步的完善。
3.2 食用油
欧盟委员会确定了油(除可可油和椰子油)和脂肪BaP限值为2 μg/kg,PAH4限值为10 μg/kg;而椰子油BaP限值为2 μg/kg,PAH4限值为20 μg/kg[9]。
Pandey等[45]对印度296 种椰子油、花生油、氢化植物油、亚麻籽油、橄榄油、棕榈油、精炼植物油、稻糠油、红花油、芝麻油、大豆油和葵花籽油中的PAHs进行检测,88.5%的油样中检测出PAHs,原生橄榄油中PAHs含量最高,为624 μg/kg,精炼植物油中PAHs含量最低,为40.2 μg/kg;25.5%的油样中检测出BaP;62%的油样中轻质PAHs含量超出德国肥胖科学学会的限定值25 μg/kg;37%油样中重质PAHs含量超出德国肥胖科学学会的限定值5 μg/kg;橄榄油中PAHs的日均暴露量最高,为20.8 μg/d,精炼植物油中PAHs的每天摄入量最低,为1.3 μg/d。
Roszko等[46]检测出冷压榨月见草油的PAH4和BaP含量分别为3.40 μg/kg和0.58 μg/kg。Ciecierska等[47]发现南瓜籽油中的BaP含量是欧盟最大限值(2 μg/kg)的8 倍,PAH4含量(35.03 μg/kg)也超出欧盟标准(10 μg/kg)。Zachara等[48]通过高效液相色谱-荧光检测器检测精制菜籽油、向日葵油、橄榄果渣油和未精制大豆、椰子油中PAHs含量,发现未精制的椰子油和大豆油中的PAHs含量最高,但所有油样中的PAH4和BaP含量均未超出欧盟限定值。
da Silva等[49]发现椰子油、红花油、月见草油和亚麻籽油中PAH4的含量范围为0~47.27 μg/kg,其中94%的油样中检测出BaA和Chr,85%油样中检测出BaP(0~10.69 μg/kg),81%油样中检测出BbF;12%的油样BaP含量超过欧盟的限定值2 μg/kg。Yousefi等[25]对伊朗40 种不同类型的食用油进行分析得出,BaP、PAH4、PAH8和PAHs含量分别为0.90~11.33、3.51~84.03、7.41~117.12 μg/kg和129.28~182.80 μg/kg;其中52.2%食用油中BaP含量超过欧盟标准限定值,65.2%食用油中PAH4超过欧盟标准限定值(10 μg/kg);小孩和成年人的MOE值均大于104,ILCR值小于10-4,认为其对小孩和成人没有致癌风险。
Shi Longkai等[50]对中国85 种植物油中的PAHs进行检测,发现BaP、PAH4和EPA16的含量分别为0.12~6.28、1.48~27.84 μg/kg和9.25~154.27 μg/kg,其中13%的油样中BaP和PAH4的含量超出欧盟限定值;植物油中EPA16含量顺序为:花生油>芝麻油>棉籽油>橄榄油>菜籽油>米糠油>玉米油>大豆油>葵花籽油。Zhou Ruize等[51]通过GC-MS对45 个油样进行检测,发现28.9%的油样中检出PAHs,PAHs(EPA16和EFSA16)的含量范围为6.96~42.10 μg/kg,PAH4含量范围为0~6.96 μg/kg,BaP含量范围为0~1.41 μg/kg,没有超出欧盟的限定值。刘玉兰等[52]检测中国不同产地的5 种可直接食用油(花生、核桃、葵花籽、芝麻和大豆)的34 个油样,BaP的平均含量为1.89 μg/kg,中位数为1.15 μg/kg,其中3 个油样中BaP含量超过GB 2762—2017中的限值(5.0 μg/kg),而这5 种食用油的ILCR范围为4.0×10-7~4.78×10-6,PAHs致癌风险在可接受的范围内,表示健康安全风险较小。王国庆等[53]通过冷冻除脂-GC-MS法检测食用植物油中PAHs的含量,发现BaP含量范围是1.94~7.40 μg/kg,平均值为3.18 μg/kg,没有超出GB 2762—2017的限定值10 μg/kg,表明市售食用植物油的PAHs含量处于较安全水平。
我国是粮油消费大国,每年需要进口大量粮油,而食用油是人们生活的必需品;因此确保进口油和自产油的质量与安全十分重要,需要完善和健全食用油质量与安全的法律法规,确保消费者的健康,把健康风险降到最低。
3.3 炙烤和烟熏肉制品
Farhadian等[54]探究了马来西亚流行烤肉的有害物质,发现不同烧烤方式(木炭、煤气和烤箱烧烤)产生的PAHs含量有显著性差异,沙爹牛肉中PAHs含量最高,为132 μg/kg,烤箱烤鸡中PAHs含量最低,为3.51 μg/kg;同时发现炭火烤盘上存在高浓度的PAHs。
Alomirah等[55]通过对科威特本地各种烧烤食品中PAHs的含量分析,发现BaP的平均含量为1.1 μg/kg,PAH8的平均含量为11.7 μg/kg,EPA16的平均含量为148 μg/kg;根据科威特人的食品每天摄入量,计算出儿童/青少年(3~19 岁)和成年人BaP(分别为8.09、9.20 ng/d)、PAH8(分别为84.2、95.7 ng/d)和PAHs(分别为974、1 108 ng/d)的日均暴露量,结果表明成年人对BaP和PAH8的日均暴露量低于EFSA针对一般人群对肉和肉制品中BaP和PAH8的平均每天摄入限定值[7]。
烧烤会导致多环芳烃的形成。Duedahl-Olesen等[56]分析了丹麦203 种商业烧烤肉类(牛肉、猪肉、鸡肉、鲑鱼和羊肉),发现烧烤猪腩肉中PAH4含量最高,为195 μg/kg,鸡胸肉中PAH4含量最低,为0.1 μg/kg。在最坏的情况下(假设每天食用烤肉),市售烤肉和家庭烤肉PAH4的MOE值分别为7 080和8 500(小于10 000),才会对消费者健康造成安全隐患。Husseini等[57]检测到黎巴嫩传统烤鸡中BaP和PAH4的含量分别为nd~3.96 μg/kg和1.52~49.9 μg/kg。廖倩等[58]通过高效液相荧光法测定“北京烤鸭”鸭皮中的3 种PAHs(BaP、BaA和DahA),其含量范围为0.56~3.19 μg/kg,样品中BaP的含量远低于GB 2762—2017规定的烟熏烧烤类食品不能超过5 μg/kg的标准。
3.4 油条、面包和茶叶
Li Ge等[1]通过GC-MS发现中国油条中EPA16含量为9.90~89.97 μg/kg,PAH4含量为1.41~26.56 μg/kg,BaP含量为0.45~5.21 μg/kg,虽然南方地区和北方地区人群因饮食差异而存在PAHs的暴露量差异,但整体上,BaP对儿童、青少年、成年人和老年人的平均直接暴露量分别为0.014 7、0.010 1、0.056 1 ng/(kg·d)和0.010 6 ng/(kg·d);儿童、青少年、成年人和老年人的平均ILCR值分别为8.71×10-8、5.96×10-8、3.33×10-7和6.38×10-8,均可接受。
Shi Yatin等[59]通过磁性固相萃取技术萃取茶叶中的PAHs,发现BaA和BaP的平均含量分别为14.6 μg/kg和18.2 μg/kg。Wang Chong等[60]研究了腌泡鸡翅茶汁的种类对经木炭烧烤的鸡翅中PAHs形成的影响,发现绿茶对PAH8的形成抑制效果最好,可抑制57%的PAH8的形成,其次是白茶(31%)、黄茶(23%)、乌龙茶(2%);而红茶和普洱茶对PAH8的形成有明显的促进作用,使鸡翅在烧烤过程中分别增加126%和54%的PAH8。
Rozentale等[61]通过气相色谱法、串联四极质谱法、气相色谱法与高分辨区质谱法分析了35 种拉脱维亚的谷物和面包样品,发现PAH4的含量为0.22~1.62 μg/kg,其中有14%样品超出了欧盟对BaP和PAH4的限定值。Udowelle等[21]发现尼日利亚日常消费的60 种面包中的BaP含量范围为0.05~0.97 μg/kg,PAH8含量范围为0.47~5.54 μg/kg,PAHs含量范围为0.49~7.57 μg/kg;儿童、青少年、男人、女人和老人的平均每天的PAHs摄入量分别为0.004~0.063、0.002~0.028、0.001~0.017、0.002~0.027 μg/(kg·d)和0.002~0.025 μg/(kg·d);小孩的ILCR值最高,为3.8×10-7,表明如果不对面包中PAHs的进行控制,会引起人体健康安全风险。
油条是中国传统特色食品,深受小孩的喜欢,有些地方将油条当作早餐。油条经过油脂高温油炸后,容易产生PAHs,特别是经劣质油油炸的油条。面包和茶叶也是日常消费品,存在的健康风险不能忽视,应逐步对各类食品中BaP和PAHs的限量作出明确的限定。
4 加工方式和贮藏条件对食品中PAHs形成的影响
食品中PAHs的形成是一个十分复杂的过程[62],烟熏食品中PAHs的来源主要是烟熏燃料高温分解产生化学物质在食品表面环化聚合形成PAHs;食品中有机成分在高温下分解,发生键断裂,不同成分或者同成分之间相互作用,缩合聚合形成PAHs。
Min等[63]探究了不同加热温度、加热时间、水分质量分数、脂质前体和抗氧化剂等对牛肉中PAHs形成量的影响,在80~200 ℃下烤炙15~30 min,冻干牛肉中BaP和PAH4的含量分别为0.71~6.58 μg/kg和2.41~14.7 μg/kg,水分质量分数50%的湿牛肉中BaP和PAH4含量分别为0.50~1.84 μg/kg和1.36~4.21 μg/kg,表明水对PAHs的形成有抑制作用,主要是由于水在加热时提供氧源,可防止不完全燃烧;在分析油脂前体物对肉制品中PAH8形成的影响时发现,甲基亚麻酸甲酯产生PAH8(34.3 μg/kg)和BaP(10.44 μg/kg)量最多,其次是甲基亚油酸甲酯、油酸甲酯和甲基硬脂酸甲酯;随着所添加脂质的不饱和程度增加,PAHs的产生量也增加,这是因为在加热过程中,食物中不饱和脂肪酸更容易受到氧化,而PAHs易由脂质过氧化物的分子内环化形成;人工合成抗氧化剂(丁基羟基甲苯和丁基羟基茴香醚)和天然抗氧化剂(没食子酸酯、α-生育酚、芝麻酚)对肉制品中PAHs的形成均有显著性抑制作用,其中芝麻酚和丁基羟基甲苯的抑制效果最好,与空白组(不添加抗氧化剂)相比,分别抑制了49%和42%的PAHs形成,这主要由于脂质是多环芳烃的重要前体,抗氧化剂可以通过抑制脂质氧化,进而抑制前体物质通过Badger-Howard途径发生环化聚合反应生成PAHs。
Wongmaneepratip等[64]研究了腌泡汁中油类型和pH值对烤鸡中的EPA16形成影响,发现添加商业棕榈油和葵花籽油使烤鸡中的PAHs的含量从190.1 μg/kg分别增加至457.6 μg/kg和376.6 μg/kg,碱性腌泡汁(pH 7.51)能显著增加PAHs的形成量。Zachara等[65]探究了波兰国家不同加工方式(传统烟熏、工业烟熏和液熏)对烟熏肉制品(香肠、猪火腿和鸡肉片)中BaP和PAH4含量的影响,发现传统烟熏肉制品中形成BaP和PAH4含量最高,分别为0.94~6.20 μg/kg和11.37~35.90 μg/kg,其次是工业烟熏(nd~0.20 μg/kg)和液熏(0.21~2.56 μg/kg)。Malarut等[66]探究了泰国烟熏木材(山毛榉、苦楝树、黑铁树、大叶相思树和桉树)对烟熏香肠PAHs形成的影响,发现经传统烟熏木材山毛榉烟熏后的香肠所含有的BaP和PAH4最高,而苦楝树烟熏后含量最低;同时在贮藏过程,苦楝树烟熏香肠的硫代巴比妥酸值和细菌总数显著低于山毛榉烟熏香肠,这表明苦楝树有利于延长烟熏香肠的保质期,因此苦楝树最有可能替代传统烟熏木材山毛榉。相关研究发现与以传统山毛榉木片烟熏的法兰克福香肠相比,以杨树木片和山胡桃木片烟熏可将香肠中的BaP、PAH4和EFSA16降低35%~40%,这表明选择合适的加工方式和加工条件有利于减少熏燃料和食品在烟熏加工过程中发生高温热解所产生化学性质活泼的碳氢自由基和一些分子质量较小的低环类化合物,抑制PAHs前体物的产生,进而减少环化聚合反应生成PAHs[67]。
Chen等[68]通过低密度聚乙烯膜真空包装烤鸭,发现在25 ℃贮藏24 h后,烤鸭中的PAHs含量下降50%以上,其中BaP含量从3.5 μg/kg下降至0.9 μg/kg,BaA的含量从143 μg/kg下降至130 μg/kg,可见低密度聚乙烯膜能降低烤鸭中的PAHs含量。Semanová等[69]通过聚酰胺/低密度聚乙烯复合膜真空包装刚熏制的香肠,发现在15 ℃贮藏3 h后,PAH4的含量由30.1 μg/kg降至5.7 μg/kg,BaA的含量由11.5 μg/kg降至2.1 μg/kg,BaP含量由3.9 μg/kg降至1.1 μg/kg,表明可通过熏制香肠中的PAH4向低密度聚乙烯的迁移作用而降低熏制香肠中PAH4的含量,以符合欧盟对PAH4(12 μg/kg)和BaP(2 μg/kg)的限值。Kuźmicz等[70]探究了不同包装材料对烟熏鲑鱼中EPA16的吸附能力,发现高密度聚乙烯膜的吸附能力最强,包装168 h后的高密度聚乙烯膜中的EPA16含量是空白膜(没有包装烟熏鲑鱼)的6 倍,包装材料吸附能力的强弱为:高密度聚乙烯膜>低密度聚乙烯膜>聚丙烯膜>聚对苯二甲酸乙二醇酯膜;这表明可通过合适的包装材料来吸附烟熏肉制品和烤肉中的PAHs,进而降低食品中的PAHs含量,保证食品安全。
综上,PAHs的形成与加热条件、时间、加工方式、烟熏木材的选择、抗氧化剂、食品的含水量和含脂量、浸泡液的pH值和食品的种类都有着密切的联系。为确保广大消费者的饮食更健康和更安全,应改进传统烟熏制品的加工方式、选择合适的加工温度和时间、适当选择一些具有明显抑制PAHs形成的抗氧化剂、选择比较好的烟熏木材以及采用合适的包装材料以降低产品中的PAHs含量。
5 结 语
本文对消费者日常食品中的PAHs含量进行了全面分析,并对其安全性进行了MOE和ILRC评估。PAHs对人的暴露途径主要通过膳食,食物中的PAHs主要来源于食品加工过程中的化学合成和环境污染物在食品中的积累。通过分析不同国家地区、不同食品中的致癌物BaP和PAH4的含量是否符合欧盟标准以及对其MOE和ILRC进行评价,发现绝大部分食品的PAHs安全隐患较小,但还是存在小部分不符合标准的食品,特别是婴儿食品和传统烟熏肉制品。其中婴儿食品的安全性更应该引起广泛关注,以保护这类弱势群体。为减少或者抑制PAHs在食品中的形成,应改进加工方式和选择合适的包装材料,以降低食品中PAHs的含量。同时,对于PAHs的形成机理以及其毒理学需要进一步深入研究,进而从根本上认识这一类物质,确定不同食品中更精确的PAHs限值。
