Caspase家族与固有免疫关系研究进展
2019-10-30余莹华徐志猛倪荣兴
余莹华,徐志猛,曾 昊,倪荣兴,李 萍
(中国药科大学天然药物活性组分与药效国家重点实验室,南京 210009)
病原体相关分子模式(PAMPs)和受损或死亡细胞释放的损伤相关分子模式(DAMPs)可激活机体固有免疫系统,引发炎症反应。模式识别受体(PRRs)是机体固有免疫系统的重要组成部分,主要在白细胞的细胞膜或胞浆中表达,识别PAMPs和DAMPs。目前已定义5个PRR家族,包括TOLL样受体TLRs、RIG-I样受体RLRs、C型凝集素受体CLRs、核苷酸结合寡聚化域样受体NLRs、黑色素瘤缺乏因子2样受体ALRs,其中来自NLRs和ALRs家族的蛋白可形成炎性小体[1]。炎性小体是2002年由Martinon等[2]共同命名的一种介导炎性Caspase激活的高相对分子质量蛋白复合物。Caspase-1和Caspase-4/5/11可分别通过经典炎性小体和非经典炎性小体途径被激活[2-3]。炎性Caspases另一成员Caspae-12主要定位在内质网[4],但其免疫调控机制仍不明确,有待进一步研究。
与炎性Caspases不同,凋亡Caspases主要引发和执行免疫沉默的细胞程序性死亡-细胞凋亡。以往研究认为凋亡Caspases不参与固有免疫应答过程,但近年来研究发现Caspase-8除引发细胞凋亡外,在固有免疫的调控过程中也不可或缺,既可通过NF-κB等途径促进炎症反应的发生,也可通过抑制坏死性凋亡等途径抑制固有免疫应答[4-5]。
本文主要总结该家族近年来与固有免疫相关的Caspases-1/4/5/11/12及Caspase-8的研究进展,以期为Caspases与固有免疫关系的进一步研究及相关疾病的临床治疗提供一些参考。
1 Caspase家族的分类和结构
根据Caspases的功能,哺乳动物Caspases从广义上被分为两类:炎性Caspases和凋亡Caspases。炎性Caspases包括Caspase-1、Caspase-4、Caspase-5、Caspase-11和Caspase-12。其中人类基因组编码Caspase-1、Caspase-4、Caspase-5、和Caspase-12,小鼠基因组编码Caspase-1、Caspase-11、Caspase-12,人源Caspase-4/5和鼠源Caspase-11是同源物。凋亡Caspases主要分为凋亡起始Caspases和凋亡效应Caspases。起始Caspases包括Caspase-2、Caspase-8、Caspase-9、Caspase-10,效应Caspases包括Caspase-3、Caspase-6、Caspase-7。Caspases最初被合成为非活性单体酶原,只有在适当的刺激下才能获得催化活性,其羧基端蛋白效应域由一个大亚基和一个小亚基组成。Caspase-1/2/4/5/9/11/12还包含一个氨基末端Caspase激活和招募结构域(CARD),Capase-8/10包含两个死亡效应域(DED),Caspase-3/6/7则只有一个较短的前体蛋白结构域。Caspase-12有全长和缩短两种亚型,人类基因组既可编码有活性的全长亚型,也可编码无活性的缩短亚型,小鼠和大鼠基因组则只编码全长亚型[4,6]。人和小鼠的Caspases的分类和结构如表1所示。
Table1 Classification and structure of human and mouse Caspases[4,6]
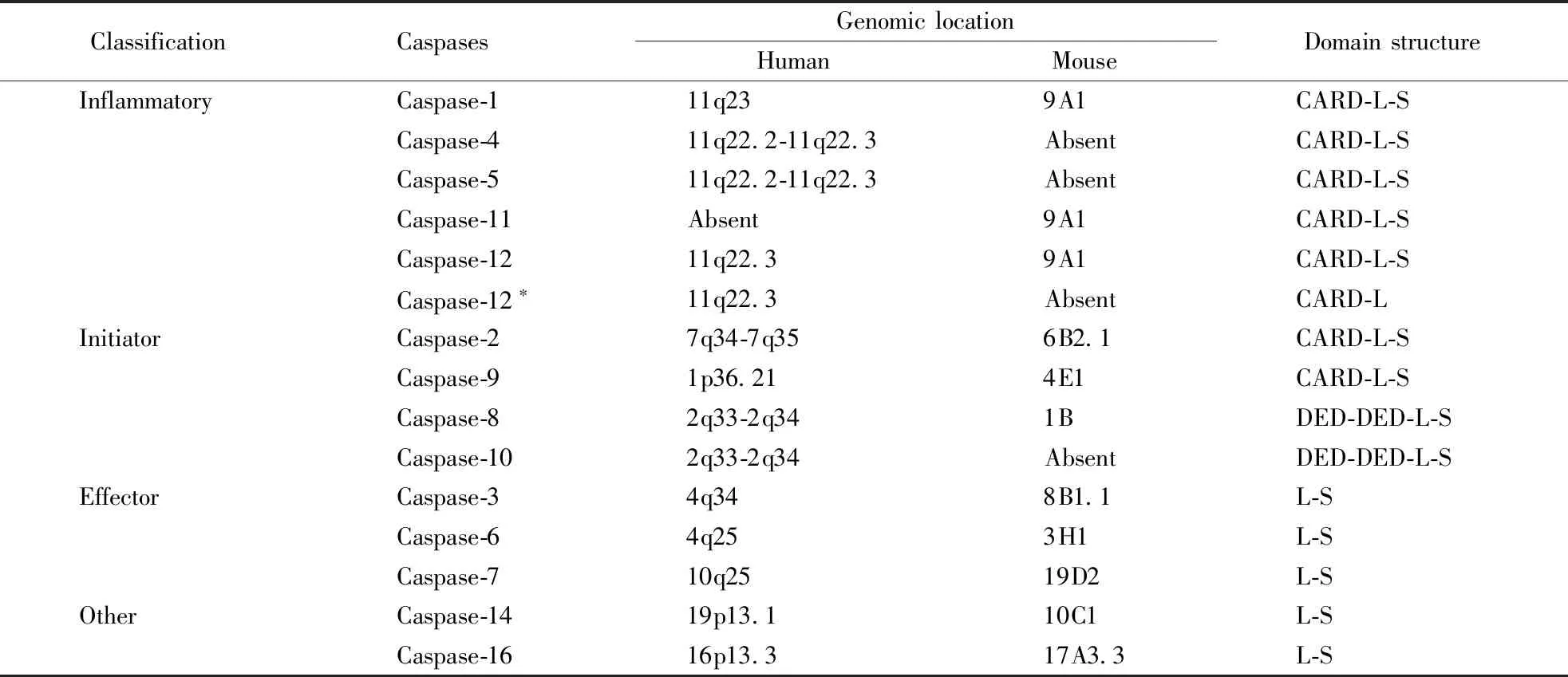
ClassificationCaspasesGenomiclocationHumanMouseDomainstructureInflammatoryCaspase-111q239A1CARD-L-SCaspase-411q22.2-11q22.3AbsentCARD-L-SCaspase-511q22.2-11q22.3AbsentCARD-L-SCaspase-11Absent9A1CARD-L-SCaspase-1211q22.39A1CARD-L-SCaspase-12∗11q22.3AbsentCARD-LInitiatorCaspase-27q34-7q356B2.1CARD-L-SCaspase-91p36.214E1CARD-L-SCaspase-82q33-2q341BDED-DED-L-SCaspase-102q33-2q34AbsentDED-DED-L-SEffectorCaspase-34q348B1.1L-SCaspase-64q253H1L-SCaspase-710q2519D2L-SOtherCaspase-1419p13.110C1L-SCaspase-1616p13.317A3.3L-S
2 Caspase-1与固有免疫关系研究进展
Caspase-1主要通过经典炎性小体途径被激活[1]。经典炎性小体是由NLRs或ALRs、凋亡相关斑点样蛋白ASC、Caspase-1三部分组成的多聚体复合物,通过调控Caspase-1活化介导IL-1β/IL-18的成熟释放和细胞焦亡[7-8]。已有研究表明,NLRP1[9]、NLRP2[10]、NLRP3[11]、NLRC4[12-13]、NLRP6[14-15]、NLRP9b[16]、Pyrin[17-18]和AIM2[19]、IFI16[20]等参与体内外Caspase-1炎性小体的形成。这些经典炎性小体的激活剂及受体结构如表2所示。
Table2 Activators and receptor structure of Caspase-1 inflammasome[1]
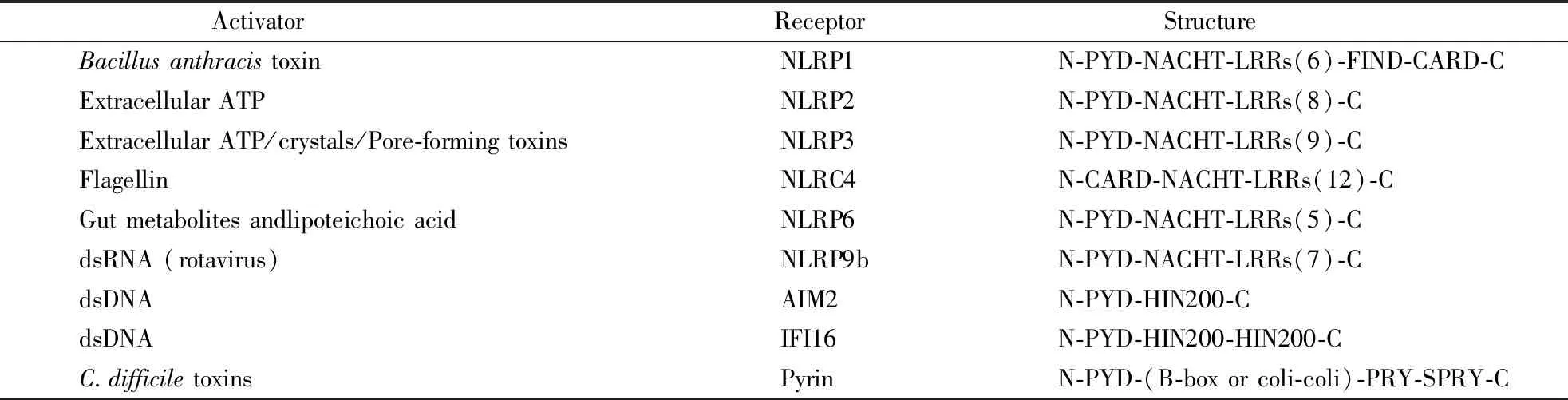
ActivatorReceptor StructureBacillusanthracistoxinNLRP1N-PYD-NACHT-LRRs(6)-FIND-CARD-CExtracellularATPNLRP2N-PYD-NACHT-LRRs(8)-CExtracellularATP/crystals/Pore-formingtoxinsNLRP3N-PYD-NACHT-LRRs(9)-CFlagellinNLRC4N-CARD-NACHT-LRRs(12)-CGutmetabolitesandlipoteichoicacidNLRP6N-PYD-NACHT-LRRs(5)-CdsRNA(rotavirus)NLRP9bN-PYD-NACHT-LRRs(7)-CdsDNAAIM2N-PYD-HIN200-CdsDNAIFI16N-PYD-HIN200-HIN200-CC.difficiletoxinsPyrinN-PYD-(B-boxorcoli-coli)-PRY-SPRY-C
2.1 NLRP3炎性小体
NLRP3炎性小体是现阶段研究最广泛的一种经典炎症小体,由NLRP3受体、衔接蛋白ASC、效应蛋白Caspase-1组装而成。其中NLRP3受体由核苷酸结合寡聚化结构域(NOD/NACHT)、亮氨酸重复序列(LRR)、热蛋白结构域(PYD)3部分构成。该受体中央结构域NACHT含有ATPase活性,对核酸结合和自我寡聚化非常重要,LRR作为高度保守的氨基酸序列,主要用于识别配体[1,21]。衔接蛋白ASC含有PYD和CARD两个结构域,当NLRP3受到相应刺激被激活时,ASC通过PYD结构域与NLRP3同型结合,同时通过CARD结构域招募并活化Caspase-1,完成炎性小体组装和活化[2]。NLRP3的激活通常需要两个过程:预处理过程和活化过程。预处理过程主要通过TLRs激活NF-κB信号通路,诱导IL-1β、IL-18等炎性因子及NLRP3炎性小体相关基因的表达[22]。活化过程包括炎性小体的组装和Caspase-1的活化,主要由细胞外ATP、淀粉样蛋白-β、活性氧、二氧化硅、胆固醇晶体、病原微生物等活化信号介导[1]。对NLRP3炎性小体进行体内外活性鉴定时,除了证明其相关基因表达上调外,更重要的是检测Caspase-1、IL-1β、IL-18、GSDMD剪切体等代表蛋白酶水解活性的指标及显微镜下可见的由NLR、ASC、Caspae-1 3部分寡聚化进行的炎性小体组装。
目前比较公认的NLRP3的激活机制主要有3种。(1)钾离子外流:多种活化信号激活NLRP3时均伴随钾离子外流,如细胞外ATP可激活P2X7嘌呤受体,诱导钾离子通道开放,导致胞内钾离子外流[23]。钾离子外流后,丝氨酸/苏氨酸蛋白激酶NEK7可与亮氨酸重复序列LRR结合,从而激活NLRP3炎性小体[24]。(2)线粒体事件:线粒体产生的活性氧可能通过与硫氧还蛋白相互作用蛋白(TXNIP)结合激活NLRP3[25]。泄露至胞内的线粒体DNA也可通过核酸转移酶(cGAS)-干扰素刺激基因(STING)途径激活NLRP3炎症小体[26]。(3)溶酶体破裂:当较大颗粒的尿酸盐结晶或草酸盐结晶通过胞吞作用进入胞内时,可引起溶酶体破裂,组织蛋白酶释放到胞质中,导致NLRP3炎症小体活化[1,27]。和识别限定配体的模式识别受体不同,NLRP3炎性小体的主要功能是感知细胞或组织的稳态变化。
2.2 其他NLR炎性小体
2013年,Minkiewicz等[10]发现人类星形胶质细胞可表达NLRP2炎性小体,该炎性小体可被ATP激活,诱导Caspase-1和IL-1β剪切。NLRP2可与嘌呤受体P2X7及pannexin 1通道结合,使用P2X7抑制剂丙苯酸及pannexin 1通道拮抗剂亮蓝G均可抑制ATP诱导的NLRP2炎性小体的激活。此项研究结果表明NLRP2是中枢神经系统炎症应答的一个重要组成部分,也许是中枢神经系统疾病炎症治疗的一个潜在靶标。NLRC4主要感知细菌的鞭毛蛋白(flagellin)和保守型Ⅲ型分泌系统(TTSS)杆组件,正常情况下处于自抑制的静息状态,病原菌成分进入胞内时,可被另一类NLR蛋白NAIP亚家族蛋白识别并激活,活化的NLRC4发生自身寡聚化并招募Caspase-1,形成炎症小体[12]。革兰阳性菌产生的脂磷壁酸(LTA)可结合并激活NLRP6炎性小体。与LTA结合后,NLRP6与ASC形成含有Caspase-11和Caspase-1的复合物,促进IL-1β/IL-18成熟,加重感染[15]。轮状病毒(Rotavirus)是幼儿患腹泻及肠胃炎的一个主要诱导因素,具有很高的传染性和潜在致命性。NLRP9b在小肠上皮细胞中特异性表达并且可抑制轮状病毒Rotavirus感染。相关研究表明NLRP9b可通过解旋酶DHX9识别一些较短的双链RNA,随后与ASC和Caspase-1形成炎性小体,杀死被Rotavirus感染的细胞,阻止进一步的感染[16]。与NLR家族其他成员不同,NLRP1含有FIIND结构域,且其可激活C端的CARD结构域。致死因子LF处理NLRP1 后可水解其N端肽段,产生新的N末端。N端水解后的NLRP1蛋白呈现不稳定性,可经蛋白酶体途径降解,游离出有活性的C端。这个活性片段包含CARD结构域和FIIND的UPA亚结构域,UPA-CARD没有跟随其全长蛋白进入蛋白酶体,而是通过CARD募集Caspase-1,实现炎症小体的组装与活化[28-30]。
2.3 dsDNA感知和pyrin炎性小体
2008年在巨噬细胞中鉴定了一个可感知胞质DNA的炎性小体-AIM2炎性小体。AIM2由一个HIN200结构域和一个PYD结构域组成,可以非序列特异性的方式与双链DNA结合,随后招募ASC与Caspase-1,完成炎性小体组装[19]。细胞溶质细菌(包括分枝杆菌和图拉菌)和病毒(如牛痘病毒和巨细胞病毒)及辐照暴露、化疗和HIV天冬氨酸蛋白酶抑制剂治疗等诱导的内源性dsDNA均可被AIM2感知并激活炎症小体[1,19]。干扰素诱导蛋白16(IFI16)包含一个PYD结构域和两个HIN200结构域,可感知核内的dsDNA。研究表明IFI16与Kaposi肉瘤相关疱疹病毒感染的病毒DNA结合,被激活后形成炎性小体复合物[20]。2014年,邵峰研究组[17]发现Pyrin炎性体可以先天免疫感知细菌的Rho GTPases修饰,且其结果证实Pyrin可响应艰难梭状芽胞杆菌的主要毒力因子细胞毒素TcdB的Rho糖基化,从而介导Caspase-1炎性小体激活。研究人员随后也证明洋葱伯克霍尔德菌可通过使switch-I区域中的Asn 41脱酰胺化诱导RHOA失活,引发Pyrin炎性体激活。2016年,Xu等[18]进一步证明RhoA可激活丝氨酸/苏氨酸激酶PKN1和PKN2,活化的PKN1和PKN2与Pyrin结合并磷酸化Pyrin,磷酸化的Pyrin与14-3-3结合,14-3-3在这里作为一个分子开关可抑制Pyrin炎性小体的活化。
3 Caspase-4/5/11与固有免疫关系研究进展
近年来研究发现,Caspase-4/5/11是脂多糖(LPS)的胞内受体,主要通过诱导细胞焦亡介导机体固有免疫应答[31]。GSDMD是细胞焦亡主要调控因子,被剪切后其氨基末端(GSDMD-NT)可插入细胞膜中引发细胞焦亡。GSDMD-NT对哺乳动物内质膜小叶的磷脂酰肌醇磷酸盐、磷脂酸和磷脂酰丝氨酸以及线粒体内膜和细菌细胞壁中存在的心磷脂具有亲和力。这些特性使GSDMD-NT能够插入细菌或细胞膜并在其中产生小孔,从而在不影响细胞器和其他邻近细胞的情况下引发细胞焦亡,发挥抗菌效应[1,32]。适度的细胞焦亡对机体有益,但过度的焦亡应答可造成机体器官损伤及死亡。近期研究表明,谷胱甘肽过氧化物酶4(GPX4)可通过减少磷脂氢过氧化物负性调控GSDMD,从而抑制过度的细胞焦亡[31]。
革兰阴性菌可产生外膜囊泡(OMV),通过内吞作用将LPS传递到宿主细胞的胞质溶胶中[33]。Caspase-4/5/11由CARD、P20、P10三部分组成,其CARD结构域可与胞内LPS的脂质A部分直接作用,诱导Caspase-4/5/11-LPS复合物寡聚化,形成有活性的Caspase-4/5/11非经典炎性小体。活化的Caspase-4/5/11非经典炎性小体可在天冬氨酸276残基位点剪切GSDMD,产生GSDMD的N端和C端结构,N端结构寡聚化插入细胞膜中形成小孔,引发细胞焦亡[34-35]。除此之外,活化的Caspase-4/5/11非经典炎性小体还可诱导NLRP3的组装与激活,随后引发进一步的细胞焦亡并诱导IL-1β和IL-18的成熟与释放[36]。有研究发现,GSDMD的缺失可消除巨噬细胞中胞内LPS诱导的NLRP3的激活,这一现象可能主要由GSDMD孔引发的钾离子外流介导[31,36](具体过程如图1所示)。2016年Zanoni等[37]发现树突状细胞中的氧化磷脂(oxPAPC)可在不介导细胞焦亡的情况下诱导Caspase-11依赖的IL-1β的释放。但也有研究表明oxPAPC可竞争性地抑制LPS与Caspase-11的结合及随后的炎症反应[38]。

Figure1 Mechanism of Caspase-4/5/11-mediated inflammation
4 Capase-8与固有免疫关系研究进展
越来越多研究表明Caspase-8在固有免疫的调控过程中发挥双重作用。既可通过诱导炎性基因的表达[39]、剪切活化IL-1β[5]、诱导细胞焦亡[40-41]等途径促进免疫反应进程,也可通过抑制炎性小体的激活[42]、坏死性凋亡[43]等途径抑制机体固有免疫反应。
4.1 Caspase-8对炎症反应的促进作用
4.1.1 Caspase-8促进IL-1β的成熟和释放 近年来研究表明,除Caspase-1外,Caspase-8也可通过其酶活性直接剪切IL-1β前体,促进IL-1β的成熟和释放(如图2所示)。2008年,Maelfait等[44]首次发现过表达TLR3和TRL4的一个共同衔接蛋白TRIF或用Poly(I∶C)和LPS分别刺激TLR3和TLR4均可诱导Caspase-8在ASP117位点直接剪切活化IL-1β。2015年,Moriwaki等[45]证明在LPS处理的BMDCs中,RIPK3对IL-1β的剪切活化至关重要,并且需要RIPK1、TRIF和FADD参与。据报道,促凋亡的刺激可导致线粒体功能紊乱,诱导第二线粒体衍生的半胱天冬酶激活剂(SMAC)从线粒体释放。SMAC可抑制凋亡抑制蛋白(IAPs),在巨噬细胞中敲除IAPs或使用SMAC类似物处理IAPs后,RIPK3可被激活,介导Caspase-8和Caspase-1依赖的IL-1β的活化[4,46]。也有研究发现,在LPS处理的BMDCs中,内质网应激诱导剂可促进Caspase-8介导的IL-1β的剪切成熟[47]。FAS与FAS配体(FasL)的结合是另外一条介导Caspase-8直接剪切活化IL-1β的途径。在此途径中,衔接蛋白FADD招募Caspase-8与Fas结合,在成熟的IL-1β的产生过程中发挥重要作用[48-49]。在某些刺激下,Caspase-8也可通过组装生物大分子介导IL-1β的剪切。例如在人类树突状细胞识别某些真菌和分枝细菌感染时,Dectin-1和它的衔接蛋白SYK可促进复合物CARD9-BCL-10-MALT1的形成,这个复合物一方面促进IL-1β基因转录,另一方面招募ASC和Caspase-8,形成非经典Caspase-8炎性小体,剪切活化IL-1β[50]。此外,也有一些研究表明Caspase-8可通过激活Caspase-1炎性小体间接产生具有生物活性的IL-1β[51]。

Figure2 Pathways of Caspase-8 directly processing IL-1β
4.1.2 Caspase-8介导炎性基因表达和细胞焦亡 Alexandra等[39]发现Caspase-8可促进c-Rel依赖的炎性因子的表达。在LPS或CpG处理的骨髓来源巨噬细胞(BMDM)中,Caspase-8可上调IκB激酶IKK的磷酸化,使得IκBε亚基被泛素化修饰,随后被蛋白酶体降解,解除对c-Rel的同源二聚体的抑制作用。之后Caspase-8可通过酶活性和支架功能共同促进c-Rel核转位,c-Rel入核后,被招募至Caspase-8依赖的基因启动子上,启动IL-1β、IL-1α、IL-12β等炎性基因的转录。该研究也发现Caspase-8对P65的核转位没有影响,表明Caspase-8对NF-κB家族成员的核转位调控仅限于IκBε。近期也有研究表明,毒力蛋白YopJ通过抑制转化生长因子激酶1(TAK1)活性活化受体相互作用蛋白激酶RIP1和Caspase-8,活化的Caspase-8可通过切割GSDMD引发细胞焦亡[40-41]。
4.2 Caspase-8对炎症反应的抑制作用
4.2.1 Caspase-8抑制细胞坏死性凋亡 细胞坏死性凋亡(necroptosis)是近年来发现的一种程序性细胞坏死。与凋亡不同,坏死性凋亡的特征是细胞体积增大、细胞器肿胀、细胞膜穿孔、随后细胞崩解、释放内容物,引发先天和适应性免疫应答。坏死性凋亡依赖于受体相互作用丝氨酸/苏氨酸激酶RIPK1和RIPK33对混合谱系激酶域样蛋白MLKL的激活。在TNFR1配体诱导的坏死性凋亡中,去泛素化的RIPK1与RIPK3的RHIM结构域同型结合,诱导RIPK3的多聚化与激活,进一步激活MLKL。效应蛋白MLKL被激活后,转位到细胞质膜上,诱导细胞破裂及死亡[52]。
已有研究表明,Caspase-8在引发细胞凋亡的同时可抑制坏死性凋亡。与此密切相关的一个复合物由Fas相关死亡域蛋白(FADD),Caspase-8和FLICE样抑制蛋白(cFLIP)组成。cFLIP是决定细胞命运的一个开关,根据转录后mRNA的剪接,以cFLIP long(cFLIPL)和cFLIP short(cFLIPS)两种形式存在。cFLIPL处于低水平状态时,Caspase-8可自剪切活化,引发细胞凋亡。同时去泛素化的RIPK1通过FADD的DD结构域与FADD-proCaspase-8-cFLIPL复合物同型结合,并进一步通过RHIM结构域与RIPK3结合,形成新的复合物。Caspase-8可在多个位点剪切RIPK1和RIPK3,从而抑制MLKL活化及其介导的坏死性凋亡[43]。
4.2.2 Caspase-8抑制NLRP3炎症小体及Ⅰ型干扰素信号 2013年,Kang等[42]报道Caspase-8对LPS诱导的NLRP3炎性小体激活及IL-1β产生的负性调控作用。与野生型对照组相比,Caspase-8-/-树突状细胞可产生更多IL-1β。机制研究表明,LPS诱导的NLRP3炎性小体的自发性激活依赖于RIPK1和RIPK3。在Caspase-8-/-树突状细胞中基因敲除RIPK1及使用RIPK1激酶抑制剂均可抑制LPS诱导的IL-1β。SiRNA沉默MLKL基因后,也可减少LPS诱导的Caspase-8-/-树突状细胞中IL-1β的产生。这些研究结果表明Caspase-8可负性调控RIPK1-RIPK3-MLKL介导的NLRP3炎性小体的激活。
Andrew等[53]曾研究发现在小鼠基底表皮形成细胞中敲除Caspase-8或诱导表达无酶活性的Caspase-8均可引发慢性皮肤炎症。该研究表明由Caspase-8缺失诱发的炎症并不依赖于真皮巨噬细胞功能、TNF、IL-1β、TOLL样受体MyD88、TRIF等途径。结果发现在Caspase-8敲除的角质细胞中,干扰素调节因子3(IRF3)和TANK结合激酶1(TBK1)可持续磷酸化,诱导表达更高水平的IFNβ和IFN诱导蛋白,基因敲除IRF3可逆转Caspase-8缺失诱发的炎症效应。
5 Caspase-12与固有免疫关系研究
Caspase-12属于炎性Caspases的一员,在多种组织中均有表达[4]。2006年,Saleh等[54]报道Caspase-12是Caspase-1激活的一个主要负调节因子。作者通过在HEK293T细胞中过表达Caspase-12,发现无论全长还是无酶活性的Caspase-12均可抑制Caspase-1的激活和IL-1β/IL-18的分泌。免疫共沉淀结果发现Caspase-12可在结构上与Caspase-1发生直接相互作用,从而抑制Caspase-1蛋白酶活性。另外,他们也证明在LPS/Pam3CSK4/poly(I:C)处理的THP-1细胞中过表达Caspase-12可抑制ATP诱导的IL-1β的分泌。2016年,Walle等[55]研究结果表明,无论是Caspae-12缺失的细胞还是小鼠均未增加Caspase-1的活化。另外IL-1β/IL-18通过典型和非典型炎症小体途径的释放也没有因Caspae-12的缺失有所增强。这两项结果相悖的研究表明,Caspase-12对炎症的具体调控作用仍有待进一步深入研究。
6 总结与展望
越来越多的研究揭示固有免疫相关的Caspases的活性调控及炎症介导机制。当细胞受到DAMPs和PAMPs等刺激时,NLRs或ALRs与ASC及Caspase-1组装形成经典炎性小体,激活Caspase-1,剪切活化IL-1β、IL-18和GSDMD,引发炎症反应和细胞焦亡。鼠源Caspase-11和人源Caspase-4/5是LPS的胞内受体,与LPS结合后寡聚化激活,引发GSDMD介导的细胞焦亡,另一方面也可通过激活NLRP3炎性小体促进IL-1β/IL-18的分泌。目前Caspase-12与固有免疫的关系仍未有统一的定论,具体作用机制亟待进一步深入研究。以往认为炎性Caspases和凋亡Caspases分别调控炎症和凋亡,但近年来研究发现这些Caspases也有一些除既定角色之外的功能。如,凋亡Caspase-8除介导细胞凋亡外,还可在固有免疫调控过程中扮演双重角色,综合调控、平衡机体的免疫应答。
尽管目前已有较多关于Caspase家族成员与固有免疫关系的研究,但还需更广泛更深入的探索以全面阐释二者的关系。如,(1)凋亡Caspases除Caspase-8外,其他成员与固有免疫的关系及作用机制鲜有报道,有待研究。(2)有研究表明Caspases成员之间存在调控关系,如Caspase-11和Caspase-8可介导Caspase-1活化,但具体机制不明确,有待深入研究。(3)Caspase-12虽属炎性Caspases成员,但其免疫调控作用及机制均不明确,有待进一步研究。(4)在心肌梗死、脑卒中等心脑血管疾病的发生发展进程中,因组织缺血缺氧往往伴随细胞坏死、坏死性凋亡、细胞焦亡、细胞凋亡等与Caspases相关的多种死亡方式。明确Caspase家族在该类疾病中的作用,可为其临床治疗提供更有效的靶标和策略。(5)天然产物对Caspases介导的固有免疫的调控及机制研究。
