含DNA嵌入基团的抗肿瘤铂类配合物研究进展
2019-10-30王天帅喻俊杰曾金金崔景新
王天帅,喻俊杰,张 艳,2,曾金金,崔景新
(湖北医药学院 1药学院;2武当特色研究湖北省重点实验室,十堰 442000)
铂族金属的物理化学性质独特,目前被广泛应用于各种高新技术领域并发挥着不可替代的作用[1]。在过去的40多年中,以抗肿瘤铂类配合物为代表的金属抗肿瘤药物,已成为临床上治疗恶性肿瘤的一线药物。第一个上市的铂类药物是顺铂,其后上市的铂类药物均与顺铂具有相似的顺式平面结构,称为经典顺铂类抗肿瘤药物。经典顺铂类抗肿瘤药物由于其优良的抗肿瘤效果、独特的抗肿瘤作用机制和抗肿瘤谱广等特点被广泛的应用于各种肿瘤的化疗或者联合化疗方案中。虽然经典顺铂类抗肿瘤药物具有显著的临床疗效,但也存在着一定的局限性,如:剂量限制局限性、无靶向性、严重的系统不良反应、耐药性或交叉耐药性等[2-3],这些局限性严重限制了此类药物在临床上的应用。为了克服经典顺铂类药物的临床缺陷,国内外学者在已上市铂类抗肿瘤药物结构的基础上合成了大量的新型铂类配合物,以期获得更高生物活性、较低毒性以及克服耐药性或者交叉耐药性的抗肿瘤铂类药物,在已报道的多种非经典抗肿瘤铂类配合物中,含DNA嵌入基团的铂类配合物由于其双重DNA识别结合模式在提高抗肿瘤疗效和克服经典铂类药物缺陷方面具有独到优势而备受关注。
1 含DNA嵌入基团铂类配合物的抗肿瘤作用机制
DNA是生物体遗传信息的携带者,其不仅是生物体生命活动的基础,而且与生物体的遗传疾病、病毒感染以及肿瘤等密切相关。经典顺铂类抗肿瘤药物的主要作用靶点就是DNA,目前普遍认可的铂类药物抗肿瘤作用机制主要是通过与DNA结合形成螯合物,限制DNA的解旋从而影响DNA复制,导致肿瘤细胞凋亡。虽然经典顺铂类药物与非铂类抗肿瘤药物一样,抑制肿瘤细胞DNA的复制是非特异性的,但是由于肿瘤细胞增殖速度比正常细胞快且其高通透性和滞留效应促进了铂类药物在肿瘤组织的选择性分布,另一方面快速增殖的肿瘤细胞应对受损DNA的修复功能不完善,因此,肿瘤细胞对铂类药物的细胞毒作用较正常细胞更敏感,铂类抗肿瘤药物显示出对肿瘤细胞良好的治疗效果[4]。铂类化疗药物在体内发挥其抗肿瘤作用的机制主要经历以下5个过程:(1)药物注射进入体内后通过跨膜运转进入细胞;(2)在细胞内发生离解、水合反应生成水合阳离子;(3)带正电荷的水合离子在DNA静电引力作用下向靶DNA迁移;(4)到达细胞核与DNA结合形成螯合物,抑制DNA复制转录;(5)细胞坏死或凋亡[5]。
Figure1 Mechanism of classical cisplatin-based antitumour drugs
DNA嵌入剂是一类以DNA为靶向的芳香族小分子化合物,其结构大小与DNA沟槽或碱基对之间空间相符,并能通过静电作用、氢键等作用力与DNA形成复合物。以DNA为靶点的药物发挥药效作用的实质是药物分子与DNA相互作用,如铂类药物可与DNA通过共价结合形成螯合物发挥药效作用。除通过共价作用与DNA结合外还可通过外部静电结合、沟槽结合和嵌入结合等非共价形式相互作用[6]。沟槽结合模式不同于嵌插结合,DNA双螺旋结构有两个大小不同的沟槽,根据沟槽的尺寸大小可将其区分为大沟槽和小沟槽。DNA结构的两个沟槽都是药物分子可能的作用位点,与大沟槽结合还是小沟槽结合取决于化合物的结构大小,再根据配体对核苷酸的亲和度选择AT富集区或者GC富集区。沟槽结合配体一般是由带有合适柔性链的两个及两个以上芳香环构成,并且其构象呈现月牙形才有可能与DNA双螺旋结构的沟槽完美结合。此外,配体的功能基团通过氢键与沟槽底部的碱基相互作用或者直接与碱基配合[7]。嵌插结合模式最早由Lemrna在20世纪60年代提出[8]。嵌插结合是小分子化合物与DNA作用的重要形式,在DNA双螺旋结构中,碱基对是平行排布的,所以只有平面的芳香分子才能够嵌入到两个碱基对之间,嵌入剂以芳香环的离域π体系与碱基π体系之间的π-π共轭、偶极-偶极相互作用及疏水作用和范德华力等作用形式,与碱基形成有序堆积,从而识别核苷酸序列[9]。嵌插结合有两种不同的方式,一种是通过破坏碱基对之间的氢键和极性,嵌入基团的两端与碱基对作用,另一种是直接嵌入平行的碱基对之间,不破坏碱基对之间的氢键和极性。DNA与小分子嵌入剂结合引起DNA双螺旋结构改变,DNA构象的变化导致其正常生理功能受到影响,如不能与RNA聚合酶或拓扑异构酶结合,转录或复制受阻等[10]。含DNA嵌入剂的铂类配合物不仅表现出嵌入剂和铂类药物的双重靶向抗肿瘤作用机制优势,一些配合物还表现出对细胞内非DNA靶点作用导致细胞凋亡的作用机制类型。
2 含DNA嵌入基团的铂类配合物的研究进展
DNA嵌入剂为铂类抗肿瘤药物靶向作用于肿瘤细胞提供了基础,其双重DNA结合模式,为得到治疗效果明显、不良反应小和耐药程度低的新型铂类抗肿瘤药物提供了研究方向。总结近几年关于含DNA嵌入剂的抗肿瘤铂类配合物的研究报道,可将此类药物按照所含DNA嵌入剂不同分为6大类:吖啶类、喹啉类、吲哚类、萘酰亚胺类、蒽醌类和其他类。
2.1 含吖啶类DNA嵌入剂的铂类配合物
吖啶类化合物属于经典的DNA嵌入剂,其结构中的刚性平面大环共轭体系决定了该化合物具有特殊的杂环化学性质,在医学诊疗领域被广泛应用。安吖啶、吖啶酮乙酸、多氢吖啶类衍生物他克林等都是已经应用于临床的吖啶类化合物。吖啶-铂类配合物(AP)与DNA的结合模式不同于顺铂,配合物结构中的吖啶类多芳香基配体嵌插入碱基对之间,引起DNA形变和碱基对的氧化[11]。吖啶类化合物与碱基对之间较强的亲和力是通过带正电荷的嵌入剂和带负电荷的DNA骨架之间的静电作用、氢键等作用力维持。AP的初步研究揭示具有柔性链和更高电荷的配合物表现出更高的生物活性和DNA亲和力,这表明柔性桥链有利于此类药物与DNA进行双重结合,同时配合物的电荷与杂环吖啶氮的pKa有关,即若氮在生理pH环境下发生质子化,则其电荷和DNA亲和力均增加[12]。吖啶类嵌入剂通过柔性链连接到铂离子中心形成的AP表现出优于顺铂对肿瘤细胞的细胞毒活性[13-14]。AP结构中的吖啶环嵌入到DNA碱基对中间,铂离子中心与DNA结合位点附近的核苷酸快速形成单加合物,双重作用致使其产生比顺铂诱导交联更严重的DNA损伤[15-16]。其中作用效果尤为突出的是[Pt(PL)(en)Cl]n+类配合物1~10(图2),PL代表吖啶类嵌入剂,这些配合物以氯离子为离去基团,发挥作用时与DNA形成单加合物,研究发现随着增加接头链长度,形成的加合物结构倾向于顺式,并且与经典顺铂类药物相比,DNA靶向化合物的平板化速率大大提高,这表明该类PA在发挥抗肿瘤作用机制时可能不需要氯配体的预水解机制[17-18]。活性实验表明这类PA对顺铂耐药的肿瘤细胞系表现出较好的体外活性[19-21]。含吖啶类嵌入剂的抗肿瘤铂类配合物与DNA的双重结合模式(栓系插入)和经典铂类药物交联DNA有着明显差异,可有效避免机体的DNA修复机制,提高药物的耐药性。基于含单吖啶基团铂类配合物表现出的良好抗肿瘤效果以及在药物耐药性方面的优势,含吖啶-双核铂配合物11和双吖啶-铂配合物12(图2)的活性及抗肿瘤作用机制被研究,研究发现配合物12中的两个生色团优先嵌入5′-TA/TA碱基对之间,而铂离子位于DNA螺旋结构小沟,并且双吖啶-铂通过酶限制位点的BstZ17I酶抑制DNA的解旋。与单吖啶-铂配合物作用机制不同的是双吖啶-铂配合物优先与TA结合,致使铂离子不能和碱基形成加合物,并且双吖啶与碱基对之间的结合方式是可逆的。该研究证明了双功能DNA嵌入基团铂类配合物潜在的研究价值[22]。
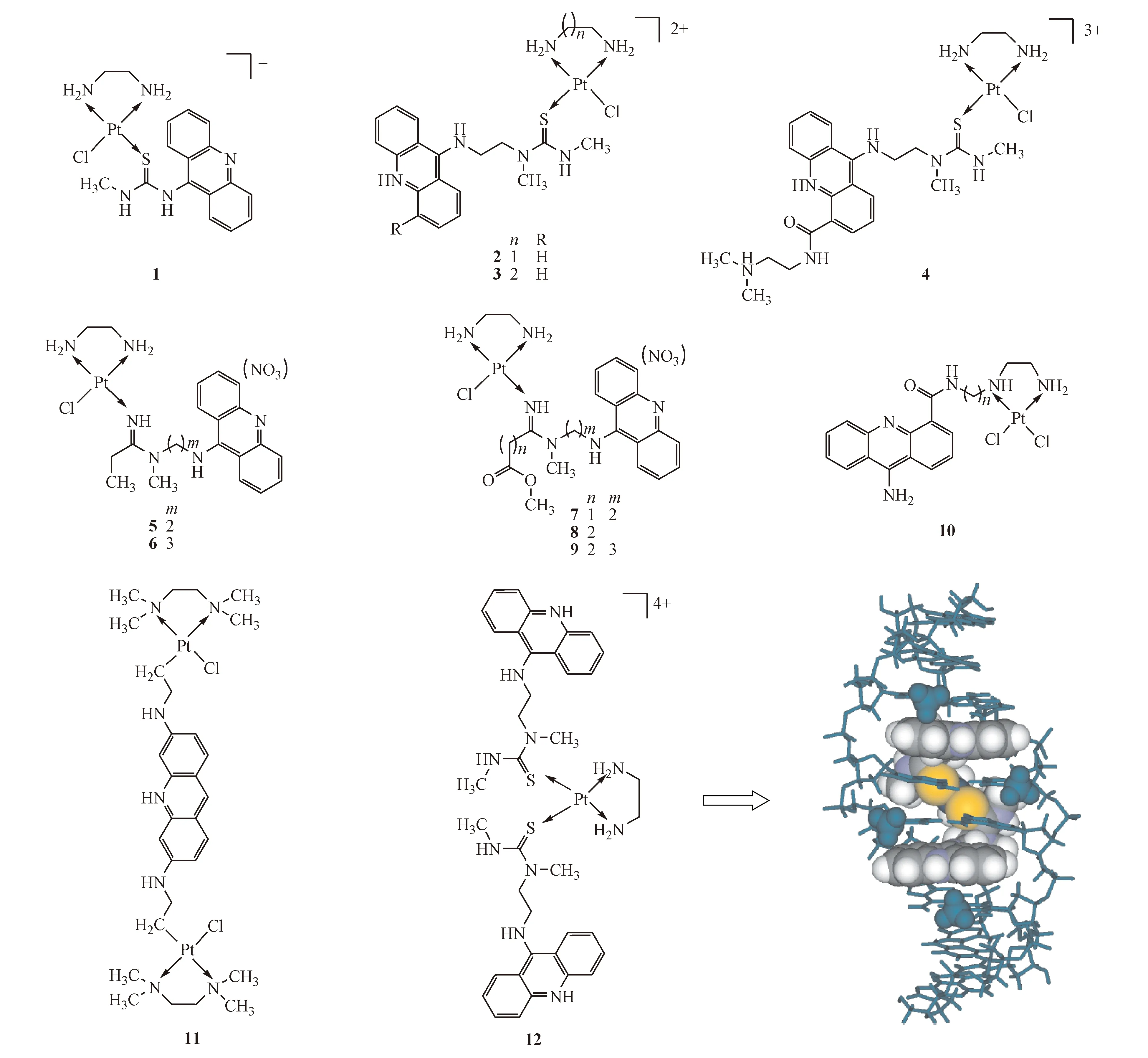
Figure2 DNA intercalators of platinum-acridine antitumor agents and the bisintercalative DNA binding model of bifunctional platinum-acridine agent12
2.2 含喹啉类DNA嵌入剂的铂类配合物
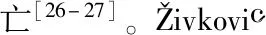
2.3 含吲哚类DNA嵌入剂的铂类配合物
吲哚类化合物是一类重要的杂环衍生物生物碱,长春碱、喜树碱等天然抗肿瘤药物的发现引起了吲哚类衍生物抗肿瘤活性研究的热潮。吲哚类衍生物已被证明具有广谱抗肿瘤活性,其作为DNA嵌入剂倾向作用于相邻的腺嘌呤,其细胞毒性作用与抑制拓扑异构酶Ⅱ的作用力有关,而其与金属铂所形成的配合物(图4)发挥着协同作用,抑制DNA修复功能从而引起细胞凋亡[34]。吲哚-2,3-二氧合酶是一种免疫抑制酶,能够导致免疫逃逸和肿瘤细胞的耐受性,因此该酶也是肿瘤免疫疗法的靶点,吲哚-2,3-二氧合酶抑制剂能够有效的提高抗肿瘤药物的治疗效果,吲哚-2-酮是吲哚类衍生物中较为突出的一个吲哚-2,3-二氧合酶抑制剂,能够与抗肿瘤药物协同作用提高治疗效果[35]。Sunitinib(SUO11248)是第一个靶向多种激酶的二氢吲哚-2-酮激酶抑制剂,已被批准用于治疗肾细胞癌和胃肠道间质瘤[36]。Li等[37]在研究吲哚类化合物衍生物抗肿瘤活性时得到了抗肿瘤活性显著增强的化合物33,基于该化合物显著的抗肿瘤活性以及化合物结构中与金属离子良好的配位基团,该课题组进一步研究了该化合物与铂形成的配合物34的活性。实验结果表明配合物34以高亲和力与小牛胸腺DNA非共价结合,对结肠癌细胞系HCT-116,乳腺癌细胞系MCF-7和MDA-MB-231的细胞毒活性显著增强。
Figure3 DNA intercalators of platinum-quinoline antitumor agents

Figure4 DNA intercalators of platinum-indole antitumor agents
2.4 含萘酰亚胺类DNA嵌入剂的铂类配合物
萘酰亚胺类化合物从首次报道细胞毒活性以来,先后有众多药物批准进入临床应用,研究表明萘酰亚胺类衍生物的细胞毒活性主要是通过抑制拓扑异构酶Ⅱ的活性,含萘酰亚胺类DNA嵌入剂的铂类配合物(图5)中萘酰亚胺类化合物既作为药物载体又作为DNA嵌入剂,其与铂(Ⅱ)的双重DNA靶向作用破坏DNA的复制从而抑制细胞的增殖。萘酰亚胺类衍生物与铂(Ⅱ)形成的配合物在肿瘤细胞系中的细胞毒性被证明要高于母体铂(Ⅱ)配合物,协同效应可能是其细胞毒性提高的原因。Banerjee等[38]研究了一种基于4-氨基-1,8-萘二甲酰亚胺的新型铂(Ⅱ)配合物35,这类配合物具有较高的DNA结合亲和力和良好的细胞毒性,研究表明配合物35很容易被乳腺癌和宫颈癌细胞系吸收,从而诱导细胞凋亡,并且其与DNA亲和力以及细胞毒性显著高于顺铂。Herrera等[39]合成了6个含萘酰亚胺的铂类配合物36~41,并研究了这些配合物的抗肿瘤活性及作用机制,研究结果表明非共价结合的铂离子中心结合模式增加了该化合物的细胞毒作用,同时萘酰亚胺基团距离铂离子中心的链长决定了配合物活性强弱。配合物36和37对耐顺铂的肿瘤细胞系活性最高。机制研究结果表明这类配合物主要是通过铂离子中心和萘酰亚胺双重DNA作用实现的,此外,研究结果表明除了与肿瘤细胞DNA作用外,这类配合物还可能与肿瘤细胞中的其他目标物结合,该结论的提出扩大了含萘酰亚胺类DNA嵌入基团铂类配合物作用靶点的范围。Chua等[40]设计合成了新型萘酰亚胺三齿配体铂配合物42,43。虽然这两种化合物与DNA加合的加合物结构非常相似,抗肿瘤细胞活性与顺铂相当,但顺式异构体相对于反式异构体具有更快的细胞毒性作用,对细胞功能的影响也更为显著。进一步研究发现两个同分异构体对DNA的结合位点具有显著的选择性区别,由于受到配体立体结构的影响,反式异构体对特殊DNA序列元素的反应性受到限制,但是顺式异构体在核小体的内部可以有效地形成加合物。这为在体内控制核小体靶向位点提供了可能性。以萘酰亚胺DNA嵌入剂为配体的四价铂类配合物引起了研究人员的兴趣,Navarro-Ranninger等[41]在前期研究的基础上进一步研究了含萘二甲酰亚胺嵌入基团双重DNA靶向的新型四价铂配合物44,实验结果表明该化合物在肿瘤细胞系中的细胞毒性比其二价铂配合物高,原因在于配体萘二甲酰亚胺与母体铂(Ⅳ)发生协同作用,提高了该配合物的细胞毒性,机制研究发现该含有萘酰亚胺的四价铂配合物作用机制不同于以脂肪胺为配体的四价铂配合物机制,萘二甲酰亚胺配体阻碍铂离子中心的水合转化过程,在体内还原路径不同于脂肪胺铂(Ⅳ)配合物。Perez等[42]研究了含有2个萘酰亚胺DNA嵌入基团的单核铂配合物活性45,46,结果表明萘酰亚胺基团与铂离子中心协同发挥作用,与DNA分子的结合更加稳定,两种化合物共价修饰pUC8速率由大到小依次为45、46、顺铂。
2.5 含蒽醌类嵌入剂的铂类配合物
通过烷基氨基桥连接蒽醌嵌入剂的铂类配合物已被广泛研究,含蒽醌类DNA嵌入剂的铂类配合物的抗肿瘤活性与其结构密切相关。含蒽醌嵌入剂的铂类配合物中具有双氯离去基团的配合物47和50比只含有单个氯离子离去基团的配合(图6)物48和49活性高。铂类配合物桥接在蒽醌结构1号位点的活性比桥接在2号位点的活性高,如配合物47的活性为配合物51活性的100倍。双功能基铂类配合物52表现出的活性低于单功能基团铂类配合物50,并且桥链长度越短时活性越高,其中n=2,3时活性最高。这一趋势和DNA嵌入剂与DNA的结合常数相近,也意味着蒽醌结构中不同取代位点在该化合物发挥抗肿瘤活性中具有重要意义[43]。Alderden等[44]研究的多柔比星-Pt(Ⅱ)配合物53,将铂配合物连接到多柔比星糖上,实验表明该配合物抗肿瘤活性高于顺铂,与多柔比星活性相当。但是机制研究表明该配合物导致肿瘤细胞死亡的原因并不是和DNA作用的结果,而是该配合物能够被溶酶体截获,在肿瘤细胞的溶酶体部位有效积累导致的细胞损伤凋亡,在细胞核中没有检测到铂离子以及铂和DNA的加合物。溶酶体捕获该碱性基团使得铂类配合物不能到达细胞核与DNA形成加合物,也是肿瘤细胞产生耐药的主要原因。此外由Jansen等[45]合成的N,N′-双(氨基烷基)-1,4-二氨基蒽醌系列的双核铂配合物54,55也表现出良好的抗肿瘤活性,其中最短的氨基桥链铂络合物显示出最高的活性。进一步研究发现该配合物作用机制与配合物53类似,进入细胞后被溶酶体截获,在溶酶体内积累。

Figure5 DNA intercalators of platinum-naphthalimides antitumor agents
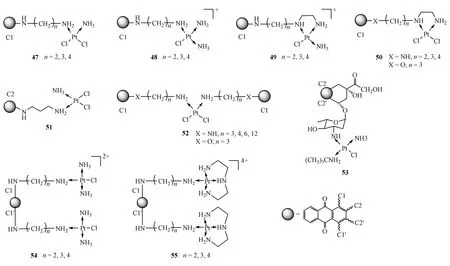
Figure6 DNA intercalators of platinum-anthraquinone antitumor agents
2.6 含其他类DNA嵌入剂的铂类配合物
含DNA嵌入剂的铂类配合物作用机制不同于经典铂类抗肿瘤药物,在克服经典铂类药物不良反应、耐药性和交叉耐药性等问题上有明显优势,因此,近年来含DNA嵌入基团的铂类配合物逐渐成为研究热点,以期获得更好的铂类抗肿瘤药物。除上述所述的5种铂类配合物外,还有许多含其他类DNA嵌入剂的铂类配合物(图7)被合成,并表现出较好的抗肿瘤活性。
2.6.1 含腺嘌呤的铂类配合物(如配合物56) 由于腺嘌呤是DNA中的靶核碱基之一,因此各种铂类配合物与腺嘌呤及其衍生物的相互作用已成为许多科学家的研究热点。腺嘌呤基配体的主要配位模式包括通过腺嘌呤部分的N7单齿配位和N1,N7-双齿配位模式。在含有单齿配位的腺嘌呤基配体的情况下,配位点优先顺序为N7>N1>N3>N6>N9=C8。铂离子中心与腺嘌呤配体桥接的位点也相对丰富,其中含有N6-苄基腺嘌呤的配体(例如罗可嘌呤)的一系列顺铂和奥沙利铂衍生物具有良好的体外细胞毒性[46-47]。

Figure7 Platinum antitumor agents containing other DNA intercalators
2.6.2 含三联吡啶的铂类配合物(如配合物57,58) 该类铂配合物与经典顺铂类抗肿瘤药物作用机制不同,它们在核碱基之间插入平面芳香族部分可逆地与DNA结合,嵌入时DNA链不被破坏,碱基之间距离增大,导致DNA容易裂解,这种相互作用常常通过带正电荷的嵌入剂和带负电荷的DNA主链之间的静电作用、氢键等作用力而得到稳定。因此这类配合物在克服细胞耐药性并呈现较小的不良反应上具有很大潜力[48-51]。
2.6.3 含三元杂菲DNA嵌入剂的铂类配合物(如配合物59~61) 邻二氮菲以环上N原子与铂离子中心形成的顺式配合物空间结构紧凑,其表面空间屏蔽作用使得该类化合物与DNA分子的亲和性降低,结合力减弱,但是反式构型的铂(Ⅳ)-邻二氮菲配合物表现出较好的活性。与三元杂菲芳香环外的氨基络合形成的铂类配合物60表现环上N原子铂类配合物迥异的高活性,特别是环上N原子连接的碳连长度越短化合物活性越强[52-54]。
2.6.4 含酚嗪类DNA嵌入剂的铂类配合物 酚嗪类多环骨架可以嵌入到DNA碱基对之间,酚嗪环上的多个N原子能降低无N原子多环体系特有的致癌性和细胞毒性,配合物62,63的铂离子单元中心与酚嗪环上的N原子和双(二苯基膦)甲烷中的膦原子共价连接,可以促进配合物在DNA平面碱基之间的插入,并提高其疏水性,从而促进其被细胞摄取[55-56]。
2.6.5 含多重DNA嵌入剂的铂类配合物(如配合物64~66) 结构中同时含有两个及两个以上DNA嵌入基团的铂类配合物被不断合成并研究其活性。多种DNA嵌入基团与铂离子中心形成的配合物与单DNA嵌入剂-铂配合物相比与DNA结合能力更强,表现出更高的选择性以及更低的解离速率[57-61]。
3 总结与展望
DNA嵌入剂的平面不饱和多芳香环共轭体系赋予了这类化合物许多特殊的性质,可以嵌插、堆叠到DNA双螺旋结构中,通过共价作用、静电作用、沟槽结合及嵌插等多种方式结合引起DNA构象变化或使机体内的一些酶受到影响,致使其生理功能受阻。在疾病的预防、诊断和治疗中被广泛应用。含DNA嵌入基团的金属嵌入剂主要由八面体结构和平面二维结构两种,八面体结构的金属嵌入剂以Ru、Rh、Os络合物为代表,平面二维结构的金属嵌入剂以铂类配合物为代表。平面二维结构的金属嵌入剂可以通过配位和插入结合模式与DNA相互作用,这种双模结合作用导致DNA表现出与单功能嵌入剂或金属药物作用方式不同的畸变,并出现新的抗肿瘤生物活性机制。铂类抗肿瘤药物的用药剂量大、不良反应严重、耐药性以及交叉耐药性是有效治疗肿瘤的主要障碍,而含DNA嵌入剂的新型双功能铂类配合物在克服经典铂类药物缺陷方面具有独特的优势,为得到治疗效果明显、不良反应小和耐药性程度低的靶向新型抗肿瘤金属药物提供新的研究方向。虽然含DNA嵌入剂的铂类抗肿瘤药物表现出不同的抗肿瘤机制以及良好的效果,但此类化合物对DNA的亲和力要求较高,且仍然存在耐药性问题。与单功能铂类抗肿瘤药物的研究相比,此类化合物的研究报道较少,继续研究探索此类配合物,对筛选出具有理想活性的铂类抗肿瘤药物有重要意义。
