基于代谢组学技术的玛咖产地鉴别
2019-10-29张宏蕊张九凯韩建勋邢冉冉
张宏蕊,张九凯,韩建勋,邢冉冉,郑 磊,陈 颖,*
(1.中国检验检疫科学研究院,北京 100176;2.合肥工业大学食品与生物工程学院,安徽 合肥 230009)
玛咖(Lepidium meyenii Walp.)是十字花科独行菜属1 a生或2 a生的草本植物,原产地位于海拔3 700~4 500 m的秘鲁安第斯山脉[1]。玛咖根是主要的食用部位,在南美药食兼用的历史已有数千年之久,享有“南美人参”的称号[2-4]。玛咖中含有丰富的蛋白质、氨基酸、膳食纤维、维生素和矿物质等营养物质[5-8],此外,研究发现玛咖还含有玛咖酰胺、玛咖烯[9]、芥子油苷[10]、生物碱[11]和甾醇[12]等次级代谢产物。国外对玛咖的研究较早,主要集中在玛咖的成分分析、药理功效、保健作用及机理等方面,较多研究证明玛咖能够提高生育力、改善性功能[13]、缓解疲劳[14]、抗氧化[6]、保护神经[15]、减缓更年期综合征[16]和预防骨质疏松[17]等。
1982年,联合国粮食及农业组织通过国际会议呼吁玛咖的营养价值和保健作用,多次向各国推荐种植[18-19]。2011年原中国卫生部发布公告批准玛咖粉为新资源食品[20]。2002年玛咖在我国云南引种成功,随后在四川、新疆、西藏、贵州和青海等地进行广泛引种,玛咖种植得到迅速发展,其中,种植面积最大的基地主要位于云南丽江、迪庆和会泽等地[21-22]。但玛咖的生长条件较为苛刻,只适合在高海拔高寒地区、昼夜温差大和雨水充沛的环境中生长,所以不同产地玛咖的品质相差甚大[23]。秘鲁玛咖历史悠久,被视为“秘鲁国宝”,所以不法商家为了谋取更多利益,通常利用国内云南和新疆等地玛咖冒充秘鲁玛咖进行销售;而云南产地的地理条件更接近秘鲁玛咖生长条件,玛咖大而饱满,售价高于其他产地,尤其是丽江玛咖品质出众,售价相对较高,因而常以新疆、西藏和四川等地玛咖冒充云南丽江玛咖出售[24]。因此很多学者开展对玛咖的产地鉴别研究。目前玛咖产地鉴别的主要研究方法包括红外光谱、近红外光谱、液相色谱-质谱联用和电喷雾质谱等。王元忠等[25-26]分别通过红外光谱和近红外光谱结合化学计量学方法对云南及秘鲁玛咖进行了产地区分;刘宇等[27]采用红外光谱结合主成分分析(principal component analysis,PCA)有效地区分了玛咖产地;杨春艳等[28]根据傅里叶变换红外光谱结合马氏距离判别分析方法鉴别玛咖产地,正确率达92.7%;另外Pan Yu等[29]利用液相色谱紫外检测串联质谱研究了不同产地的玛咖的玛咖酰胺含量差异,并根据正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)模型区分产地;孙佳明等[30]应用电喷雾串联质谱法检测了玛咖的低极性组分,通过灰色关联度分析和偏最小二乘法分析得到最佳促睾丸间质细胞增殖活性成分的是N-苄基-十六酰胺,另外结合多种化学计量学方法区分了云南和秘鲁玛咖。
代谢组学具有整体分析的能力,能够反映外源性物质对生物体产生的整体性效应。代谢组学所研究的代谢物位于生理、生化活动调控的末端,更能够反映生物体变化规律的整体性。基于代谢组学技术的玛咖产地鉴别,更能全面、准确地进行产地的区分并能发现代谢物在各产地的分布差异。本研究通过基于代谢组学技术的液相色谱-质谱方法对不同产地的玛咖进行全扫描分析,根据靶标和非靶标代谢组学方法筛查鉴定玛咖代谢物,分析各产地代谢物差异,旨在为玛咖的产地鉴别和质量评价提供参考。
1 材料与方法
1.1 材料与试剂
共收集玛咖干根样品13 种,分别来自于秘鲁、云南、西藏、四川和新疆5 个产地,采集于2017年11—12月,生产年限均为1 a。所有样品由云南省农业科学院药用植物研究所李晚宜研究员进行形态鉴定,并在实验室内采用实时荧光聚合酶链式反应方法进行物种确证。样品编号及产地信息见表1。

表1 实验样品信息Table 1 Information about Maca samples
甲醇、甲酸、乙酸铵和乙腈(均为色谱纯) 美国Sigma-Aldrich公司。
1.2 仪器与设备
TripleTOF 5600超高压液相色谱-四极杆飞行时间质谱仪(配有电喷雾离子源和大气压化学电离源)美国AB SCIEX公司;LC-20A高效液相色谱仪 日本岛津公司;TissueLyser II型组织研磨仪 上海凯杰企业管理有限公司;Bencbtopk冷冻干燥机 美国VirTis公司;Biofuge Stratos离心机 德国贺利氏有限公司;R-215旋转蒸发仪 瑞士Büchi有限公司。
1.3 方法
1.3.1 样品制备
玛咖干根置于液氮中至少浸泡1 min,用研钵捣碎,于料理机中打成粗粉,放入真空冷冻干燥机中冷冻干燥48 h。用组织研磨机研磨成细腻的粉末,转移至50 mL离心管,放入-40 ℃冰箱贮存。称取0.2 g样品加入3 mL甲醇于离心管中,30 ℃超声水浴1 h,8 000 r/min离心10 min,上清液转移到5 mL离心管中,残余物用2 mL甲醇再萃取1 次。合并上清液旋转蒸干,每种溶剂定容到2 mL,12 000 r/min离心10 min,过滤膜,稀释4 倍备用。参考Qiu Shi等[31]代谢物提取方法,提取溶剂选择甲醇、乙醇、乙酸乙酯3 种溶剂提取玛咖代谢物,甲醇提取的玛咖代谢物离子响应强度最大,因此最终的提取溶剂确定为甲醇。
1.3.2 色谱条件
Phenomenex Kinetex®C18色谱柱(100 mm×2.1 mm,2.6 µm);流动相A为3 mmol/L乙酸铵溶液含0.02%甲酸,流动相B为3 mmol/L乙酸铵-乙腈溶液含0.02%甲酸;进样量2 µL;流速0.3 mL/min;柱温40 ℃;洗脱梯度:0~3 min,10% B;3~14 min,10%~40% B;14~17 min,40%~100% B;17~17.1 min,100% B;17.1~20 min,10% B。整个洗脱过程时间为20 min。在正离子模式下向流动相中加入乙酸铵能够诱导[M+NH4]+离子的产生,加入甲酸有助于洗脱离子的质子化,使得较弱强度的[M+H]+离子更容易被检测到。
1.3.3 质谱条件
电喷雾离子源,正离子扫描方式;离子源温度500 ℃;正离子喷雾电压5 500 V;去簇电压80 V。质谱数据通过信息依赖检索方法进行动态背景扣除。雾化气压力50 psi,辅助加热气压力50 psi,气帘气压力35 psi。离子碰撞能量40 eV,质量扫描范围m/z50~1 000。每个循环内包括1 个一级质谱扫描(250 ms)和10 个二级质谱扫描(每个50 ms)。
1.3.4 数据预处理和化学计量学分析
采用MarkerView 1.2.1软件对Q-TOF获得的数据进行预处理,包括数据的挖掘、校准和归一化等。具体参数设置如下:数据挖掘的范围m/z100~1 000,保留时间0.5~18 min;峰检测:最小光谱宽度为2.5×10-5,最小色谱峰宽为6,噪声阈值为100;峰校准和筛选:质量数偏差为1×10-5,保留时间偏差为0.5 min[32]。最大出峰数设为8 000。数据预处理后将峰度信息导出到SIMCA 14.0软件中进行PCA和OPLS-DA。另外,利用MeV4.9软件进行各产地玛咖代谢物的热图分析。
1.3.5 非靶标代谢物鉴定
将检测到的所有峰的信息导入到SIMCA软件,进行PCA和OPLS-DA后,得到载荷图。根据载荷图,变异权重参数值(variable importance in projection,VIP)大于1以及P值小于0.05筛选出标志离子。将标志离子的信息导入PeakView软件,利用Formula Finder进行分子式的确定,理论和实际的理论偏差小于5×10-6,同位素的分布在理论分布范围的20%以内。标志物在HMDB、Metlin等数据库搜索后得到二级质谱信息,与PeakView软件中标志物的二级质谱信息进行匹配,确定标志物的分子式结构。
1.3.6 靶标代谢物鉴定
通过查找文献中玛咖存在的代谢物建立玛咖代谢物数据库(表2),将数据库中化合物的分子式和离子加合方式输入PeakView软件中的内置XIC manager插件中并导入样品数据,软件根据化合物分子质量和同位素的误差情况计算待分析样品中该化合物的质谱信息,并且匹配出液相色谱的丰度和出峰时间[51]。其他参数的设置:峰面积大于1 000,信噪比大于10,同位素峰的丰度应满足在理论分布范围的20%内。通过PeakView软件可以得到化合物的一级和二级质谱信息,去除没有一级或二级质谱信息的化合物,将化合物的一级和二级质谱信息与PubChem、Metlin等数据库进行比对确认。

表2 文献中的玛咖代谢物Table 2 Maca metabolites reported in the literature

续表2
2 结果与分析
2.1 超高效液相色谱-四极杆串联飞行时间质谱代谢组学分析
如图1所示,不同产地玛咖的出峰时间大体一致,但出峰数量和丰度存在差异。秘鲁、四川和云南产地的玛咖出峰数量相对较多,四川玛咖在12~16 min丰度很高,秘鲁玛咖在5~6 min丰度较高,说明不同产地代谢物组分种类和含量都具有一定的差异。
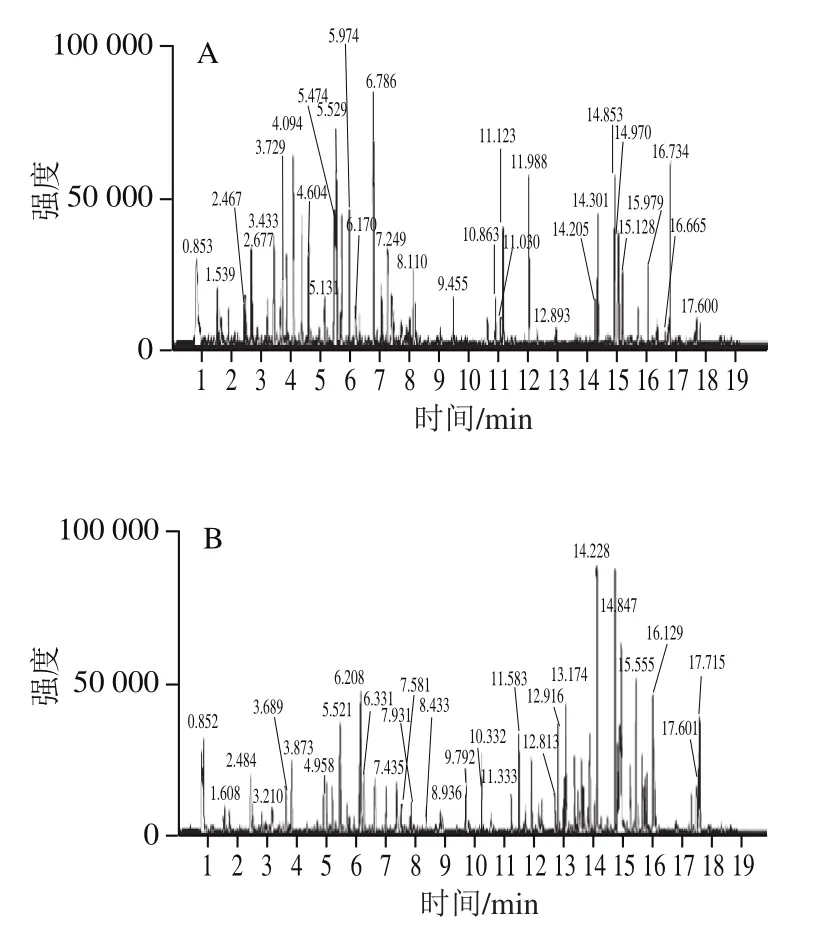
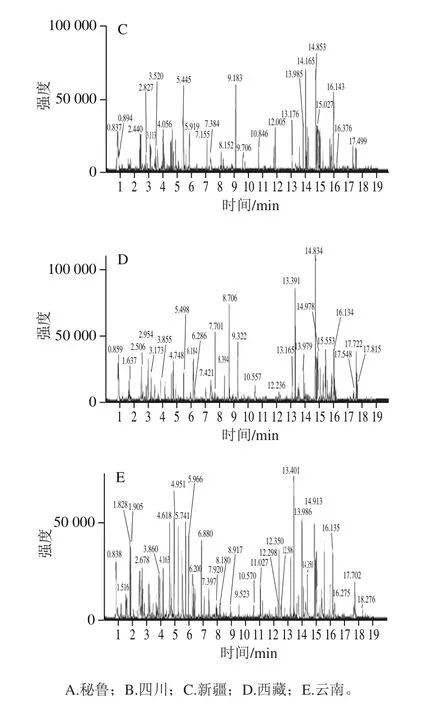
图1 不同产地玛咖的超高效液相色谱-四极杆串联飞行时间质谱基峰图Fig. 1 UPLC-QTOF-MS base peak chromatograms for Maca from different origins
2.2 化学计量学分析
经过数据挖掘和比对后,为减少信号的冗余并对数据进行降维处理,选择单一同位素(同位素类型中m/z值最低的信号)的峰进行化学计量学分析,其他峰去除后在正离子模式下共检测到731 个峰,负离子模式下检测到240 个峰。为能区分玛咖的各个产地,在正负离子模式下分别进行无监督PCA,但结果表明各产地玛咖广泛分散,没有明确的划分(图2A、B)。在此基础上进行有监督的OPLS-DA(图2C、D),45 份玛咖可以根据产地来源被分成5 组,秘鲁组(n=9)、云南组(n=9)、四川组(n=9)、新疆组(n=9)、西藏组(n=9)。图2E、F中各点代表检测到的各个峰,越靠近原点的离子表示各产地均能检测到,越靠近外面的离子代表各产地的差异性离子。正离子模式下的OPLS-DA模型验证后RX2为0.879,RY2为0.964,Q2为0.773,负离子模式下的OPLS-DA模型验证后RX2为0.884,RY2为0.856,Q2为0.727,理论上,R2、Q2的值越接近1说明模型越可靠,通常情况下两者均大于0.5且两者的差值小于0.3较好。相比较,正离子模式下模型具有较好的可靠性和预测性。结果表明基于代谢组学技术的液相色谱-质谱方法可以用于玛咖产地的区分。与负离子模式相比,正离子模式下的OPLS-DA模型有较好聚类结果,同时正离子模式下检测到更多的峰,因此选择正离子模式采集的数据进行代谢物的鉴定。
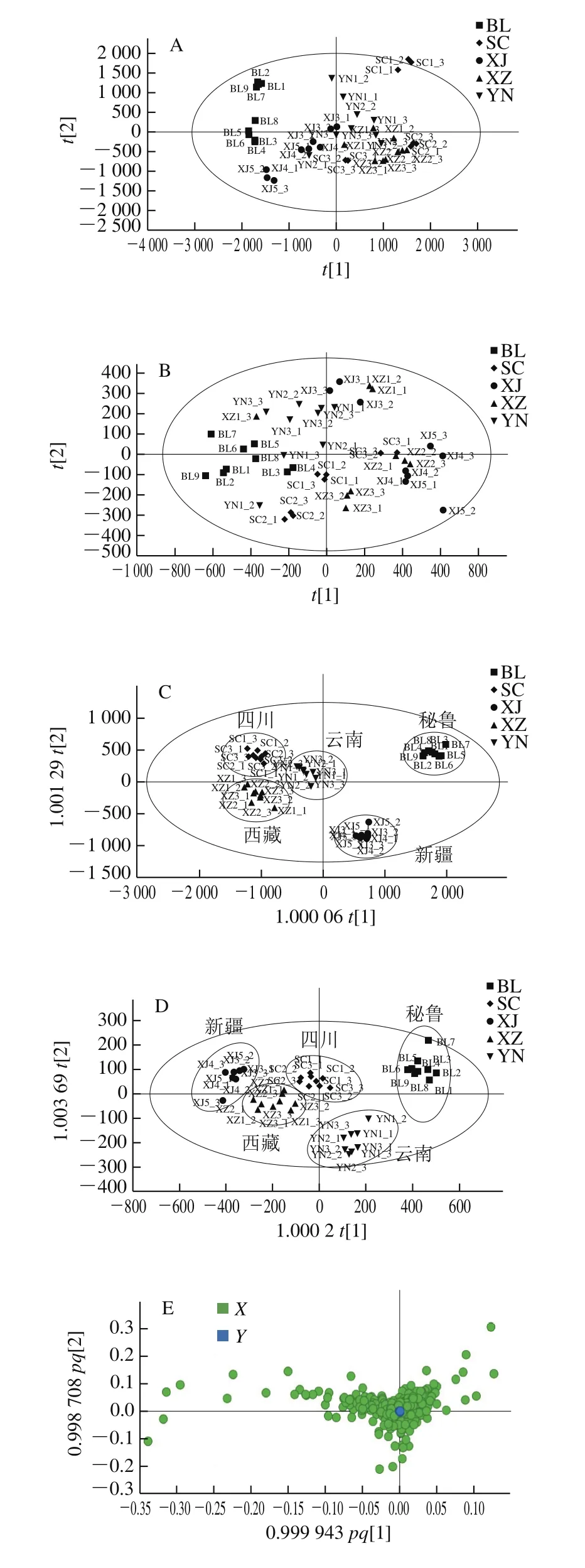

图2 不同产地玛咖的PCA图Fig. 2 Principal component analysis of Maca from different origins
2.3 非靶标代谢产物鉴定
标志物经过筛选后由Formula Finder软件根据母离子的精确质量数、母离子同位素组成以及碎片离子的信息进行元素组成的确定。该软件能够根据“MS排名”和“MS/MS排名”对所推导的分子式进行排序,排名靠前的分子式比较准确。同时,该软件能够反映理论计算和实验的同位素组成差异和离子m/z值的差异。实验中推测得到的分子式的质量误差小于5×10-6,具有较高的可信度。实验推测得到的分子式输入到在线数据库(HMDB、Metlin等)中进行候选参考化合物的筛选。本研究中用到的Fragment Pane软件能够获得每个候选分子可能的质谱碎裂方式,增加了选择正确离子的可能性。Fragment Pane软件能够通过基于化学智能的碎片峰匹配算法对鉴定的化合物进行确认。最后鉴定到的不同产地的标志物结果如表3所示。其中,鉴定得到2 个西藏产地的标志物,3 个秘鲁产地的标志物。由于数据库无法匹配到其他化合物对应的结构式,因此无法鉴定出它们的结构。但二级质谱信息已知,保留该标志物,标记为unknown。
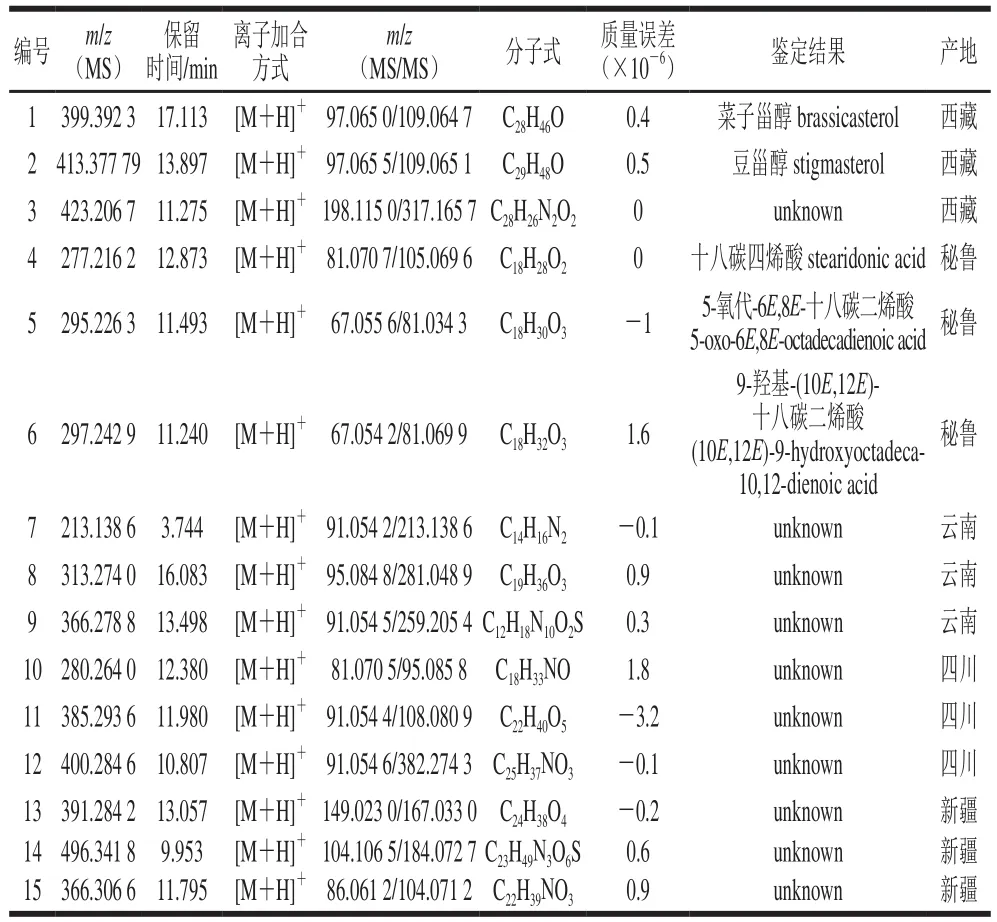
表3 不同产地玛咖中的标志物Table 3 Markers of Maca from different geographical origins
2.4 靶标代谢产物鉴定
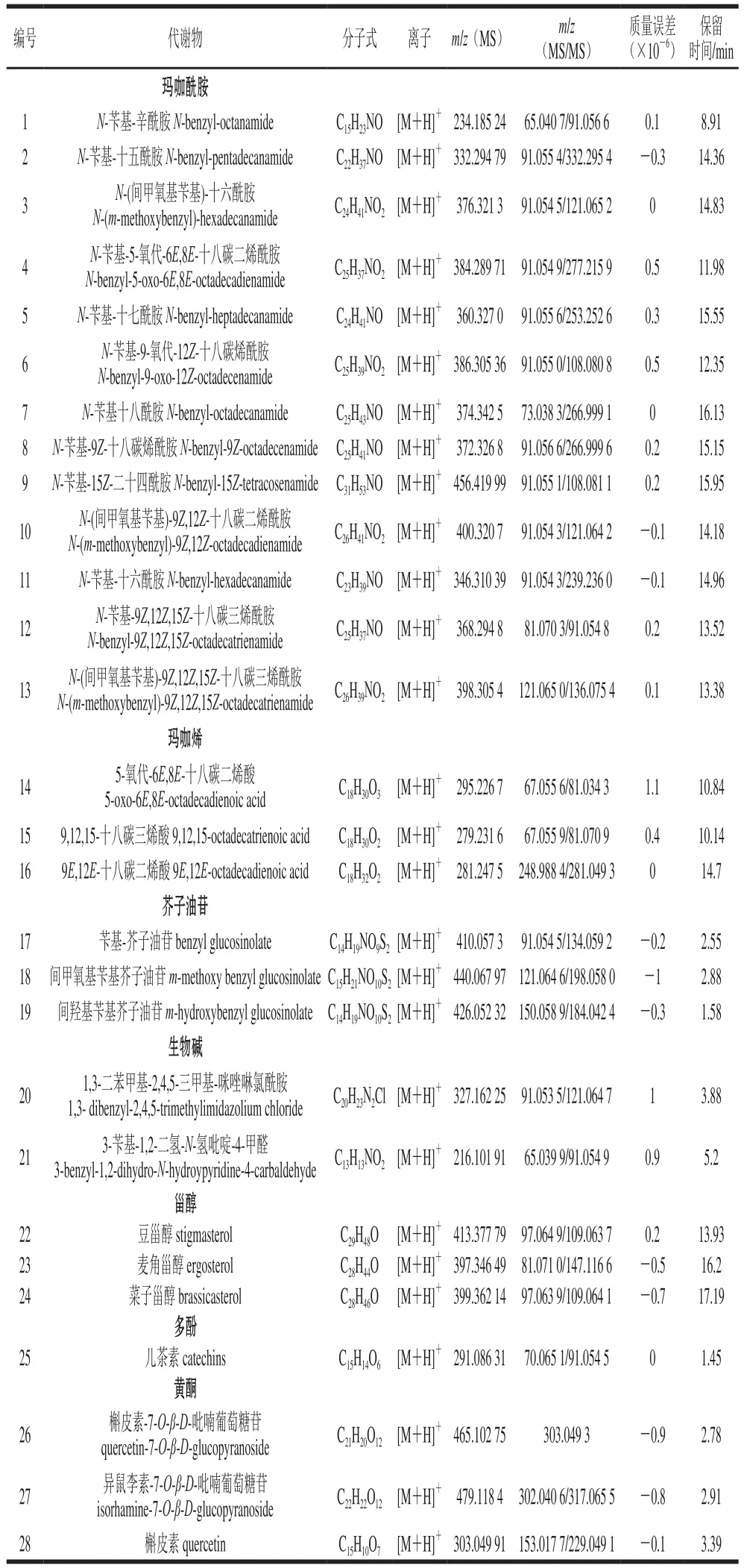
表4 通过靶标代谢组学分析鉴定出的玛咖代谢物Table 4 Maca metabolites identified by target metabolomics analysis
传统的代谢组学数据处理方法是数据经过处理后,对每个峰都进行测定,得到一级和二级质谱信息后再进行分析鉴定,此方法比较耗时,而且数据库的代谢物种类有限,有很多代谢物在数据库中无法查到二级质谱信息。本研究采用逆向鉴定代谢物模式,首先通过查找文献中已鉴定的玛咖代谢物,建立理论代谢物数据库(表2),将其输入到PeakView的XIC manager中与实验数据的精确质量数和同位素类型匹配情况进行比较得到玛咖的可能代谢物。这种方法的最大优点是可以快速匹配理论数据库与待测物,筛查到玛咖的代谢物。本研究在不同产地玛咖中共鉴定出了28 种代谢物,包括13 种玛咖酰胺、3 种玛咖烯、3 种芥子油苷、2 种生物碱、3 种甾醇、1 种多酚、3 种黄酮(表4),均为玛咖常见的代谢物,表明此方法覆盖度较好。
2.5 代谢物差异性分析

图3 XIC manager玛咖中靶标代谢产物热度图Fig. 3 Heat analysis of targeted Metabolites of Maca
如图3所示,颜色代表了代谢物的丰度高低,颜色由绿色到黑色再到红色代表着代谢物丰度逐渐升高。结果显示,玛咖酰胺和玛咖烯在5 个产地的玛咖中均检测到,且在所有代谢物中丰度较高,表明这2 种代谢物是玛咖中的主要代谢物质。其中四川、西藏、云南3 个产地的玛咖酰胺含量相对较高,秘鲁的玛咖烯和生物碱3-苄基-1,2-二氢-N-羟基吡啶-4-甲醛含量最高,西藏的豆甾醇和菜子甾醇含量较高,新疆的黄酮类物质含量较高。热图直观呈现了代谢物在各个产地的分布情况。玛咖酰胺和玛咖烯是玛咖中特有的活性成分,玛咖酰胺是由氨基化合物与不同脂肪酸形成的酰胺类生物碱,在提高生育力、保护神经等方面功效显著。玛咖烯是一种长链不饱和脂肪酸,是引起性功能改善的主要物质。玛咖酰胺和玛咖烯对于玛咖的质量评价有重要的参考价值。Pan Yu等[29]利用高效液相层析、液相色谱-质谱的方法研究了不同产地的玛咖酰胺含量的差异,共鉴定出12 种玛咖酰胺,其中N-苄基-9-氧代-12Z,15Z-十八碳二烯酰胺、N-苄基-13-氧代-9E,11E-十八碳二烯酰胺和N-苄基-9Z,12Z-十八碳二烯酰胺在本研究未鉴定出来,其余9 种均鉴定得到,在此基础上又鉴定出N-苄基辛酰胺、N-苄基-十五酰胺、N-苄基-5-氧代-6E,8E-十八碳二烯酰胺、N-苄基-15Z-二十四烷酰胺4 种玛咖酰胺。
本研究中5 个产地玛咖中检测到的玛咖酰胺和玛咖烯种类一致,秘鲁产地N-苄基-十六酰胺含量较高,剩余12 种玛咖酰胺含量相对于其他4 个产地相对较低,而3 种玛咖烯含量相比于其他4 个产地相对较高。四川产地中N-苄基-5-氧代-6E,8E-十八碳二烯酰胺和N-苄基-9-氧代-12Z-十八碳烯酰胺含量相对较高,新疆产地的各化合物丰度相对较低,西藏产地N-苄基-十六酰胺、N-苄基9Z-十八碳烯酰胺、N-苄基-9Z,12Z,15Z-十八碳三烯酰胺、N-(间甲氧基苄基)-9Z,12Z-十八碳二烯酰胺和N-苄基十八烷酰胺含量较高,云南产地N-苄基-十六酰胺、N-苄基9Z-十八碳烯酰胺和N-苄基-9Z,12Z,15Z-十八碳三烯酰胺含量较高(图4)。上述研究结果表明不同产地的玛咖代谢物分布存在差异。
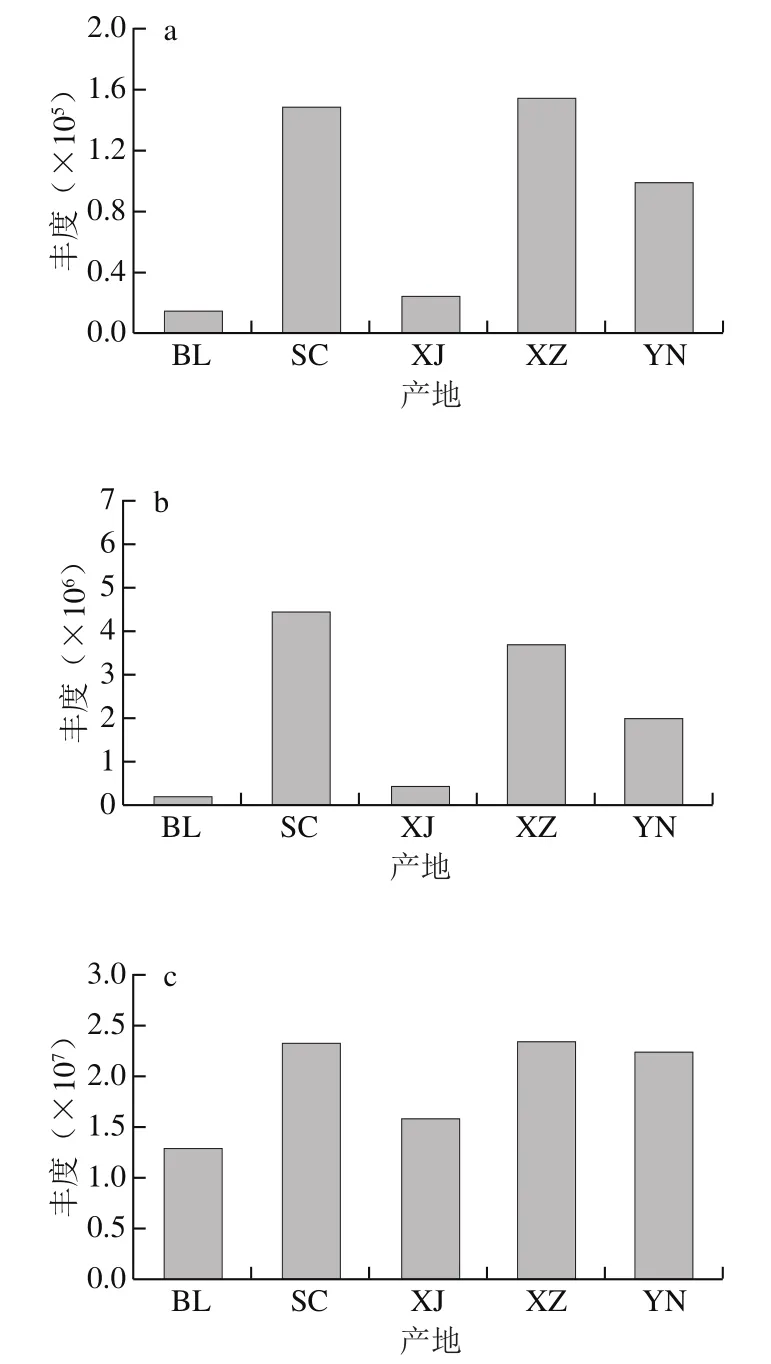
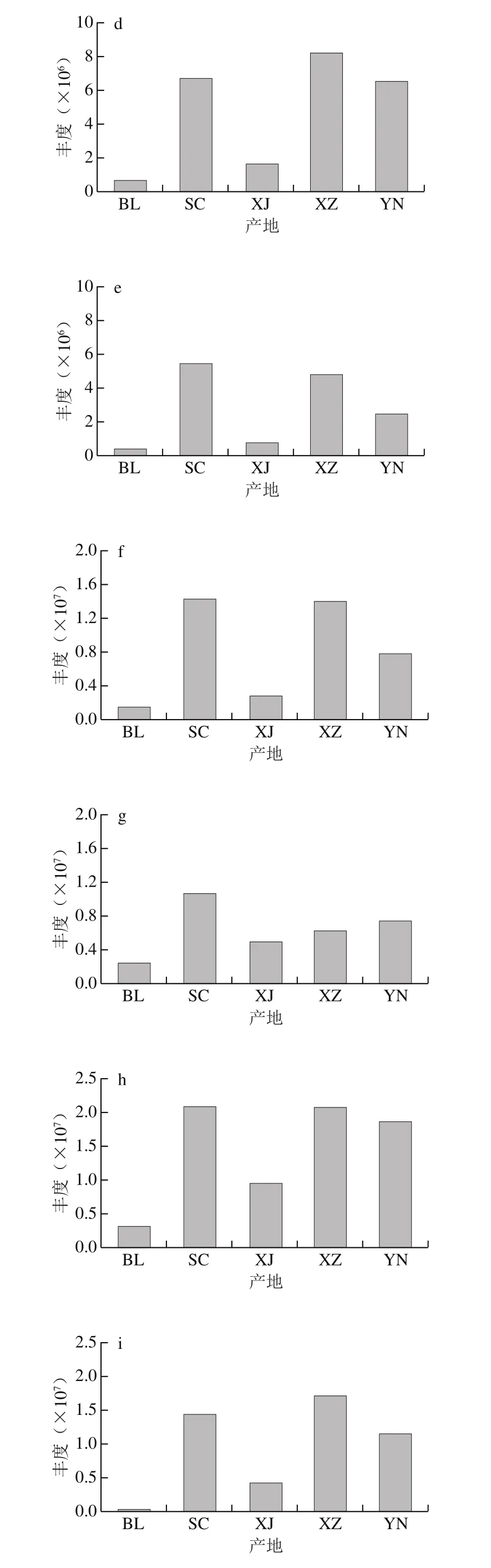


图4 不同产地玛咖的玛咖酰胺和玛咖烯类化合物比较Fig. 4 Comparison of macaamide and macaene compounds of Maca from different geographical origins
3 结 论
已有研究大多以玛咖酰胺一类代谢物进行产地的区分,忽略了其他代谢物的产地差异。本研究采用基于超高效液相色谱-四极杆串联飞行时间质谱的代谢组学方法结合OPLS-DA成功区分了玛咖产地,分析了各个产地的玛咖多种代谢物,更加全面地阐述了产地对代谢物产生的影响。利用非靶标代谢组学分析鉴定出15 种产地标志物,可用于玛咖产地的区分。利用靶标代谢组学分析共鉴定出28 种玛咖代谢物,其丰度以热图形式呈现,反映了代谢物在不同产地的分布情况。玛咖中丰度较高的代谢物为玛咖酰胺和玛咖烯,其次为生物碱和甾醇。结果证明代谢组学技术结合化学计量学方法可以为玛咖的产地鉴别提供依据。
