产蛋白酶芽孢杆菌的筛选及其发酵对豆粕的影响
2019-10-29牛红红苗欣宇王景会
郑 丽,李 达,牛红红,苗欣宇,王景会*,苏 颖*
(吉林省农业科学院农产品加工研究所,吉林 长春 130033)
豆粕是大豆提取完油脂之后的副产物,其蛋白含量高、氨基酸种类均衡,因此在食品和饲料工业中常作为廉价的优质蛋白原料使用[1-2]。但是,豆粕中含有的一系列抗营养因子过敏性蛋白、植酸和胰蛋白酶抑制剂等限制了豆粕的使用范围[3]。通过发酵可以有效降解这些不良因子并提高豆粕的营养价值[4]。应用于豆粕发酵的微生物种类繁多,并且不同微生物发酵的豆粕具有不同的特性[5]。近期利用芽孢杆菌生产发酵豆粕成为研究趋势。芽孢杆菌生长周期短、成本低廉,并且其发酵的豆粕产品具有营养价值高、抗营养因子低等优点[6]。
芽孢杆菌在固态发酵过程中会产生碱性蛋白酶,蛋白酶对豆粕大分子蛋白进行分解,产生小分子蛋白质、肽和氨基酸,首先会导致豆粕pH值稍微下降,然后随着发酵的进一步加深,蛋白酶继续水解蛋白质片段变成氨,最终导致豆粕pH值上升[7]。因此,在发酵过程中,豆粕中的大分子过敏源大豆球蛋白和β-伴大豆球蛋白在不同的阶段降解成不同种类的小分子物质。有研究表明,在已知芽孢杆菌最佳生长温度的情况下,发酵时间对豆粕的质量有非常重要的作用。发酵时间过短,豆粕中的过敏源分解不完全,不利于消化和吸收,发酵时间过长,会导致蛋白质的过度分解,并产生刺鼻的气味,不仅会降低总蛋白含量,也会影响豆粕的品质[8]。
豆粕加工过程中蛋白成分的变化成为研究者们关注的焦点。Seo等[9]使用双向电泳技术检测了枯草芽孢杆菌发酵过程中蛋白亚组分的变化;Yang Yong等[10]使用傅里叶变换红外光谱检测了5 种豆粕蛋白水解后的二级结构变化。但是,芽孢杆菌发酵过程中豆粕蛋白的微观结构变化研究相对较少。有研究表明蛋白质的微观结构与蛋白质的理化性质和消化性相关,如Peng Quanhui等[11]观察到豆粕蛋白的分子结构会影响其溶解性和肠道消化性。因此,研究大豆的微观结构可以更好地了解其营养功能。
本研究筛选到1 株高产蛋白酶的芽孢杆菌,通过形态学、生理生化鉴定,以及进化树的构建,结果显示其是1 株暹罗芽孢杆菌。研究芽孢杆菌发酵对豆粕化学成分的变化以及对豆粕蛋白的微观结构影响,本实验可为进一步研究微生物发酵对豆粕蛋白结构影响提供理论支持。
1 材料与方法
1.1 材料与培养基
脱脂豆粕 吉林华展生物工程有限责任公司;脱脂乳粉 新西兰恒天然集团。
改良LB液体培养基:酵母浸粉3 g/L、蛋白胨10 g/L、氯化钠10 g/L、葡萄糖3 g/L,121 ℃高压灭菌20 min。改良LB固体培养基:改良LB液体培养基添加16 g/L琼脂粉。豆粕发酵培养基:10 g豆粕(过20 目筛)、0.2 g红糖、10 g蒸馏水,搅拌均匀,115 ℃高压灭菌15 min。脱脂乳固态培养基:脱脂乳粉50 g/L、琼脂粉1.5 g/L,115 ℃高压灭菌15 min。
1.2 仪器与设备
MLS-3780高压蒸汽灭菌锅 日本Sanyo公司;Cary 300紫外-可见光分光光度计 美国Varian公司;全自动凝胶成像系统 美国Bio-Rad公司;DK-8D电热恒温水浴锅 上海一恒科学仪器有限公司;RC冷冻离心机 美国Thermo公司;JSM-6700F扫描电镜(scanning electron microscopy,SEM) 日本JEOL公司;D/max 2550 X射线衍射(X-ray diffraction,XRD)仪 日本Rigaku公司;2300k凯氏定氮仪 丹麦Foss公司。
1.3 方法
1.3.1 产蛋白酶菌株筛选
初筛:挑取活化后的芽孢杆菌单菌落接种于液体培养基,37 ℃、200 r/min恒温振荡培养24 h。将培养菌液在4 ℃、8 000 r/min离心15 min后,取上清液过0.22 μL无菌滤膜。在脱脂乳固体培养基表面摆放牛津杯(直径6 mm),使牛津杯与培养基接触面无缝隙,然后在牛津杯中注入200 μL滤液。将脱脂乳培养基放置于40 ℃恒温培养箱内培养24 h,使用游标卡尺测量水解圈的大小。
复筛:将初筛时具有较大水解圈的芽孢杆菌分别接种10%(加入液体培养基的体积为豆粕质量的10%,活菌数约为108CFU/mL)于豆粕发酵培养基中,37 ℃培养24 h。使用60 mL、50 mmol/L、pH 7.0的磷酸盐缓冲液提取酶液。将培养基和缓冲液混合后室温条件下振荡30 min,继续放置在4 ℃静置2 h,8 000 r/min离心15 min,取上清液。蛋白酶活力检测:参照SB/T 10317—1999《蛋白酶活力测定法》[12]。
1.3.2 产蛋白酶菌株的鉴定
1.3.2.1 形态观察
将产蛋白酶的菌株在改良LB固体培养基上划线培养,并在37 ℃恒温培养箱中培养24 h后观察菌落生长情况,将菌体进行结晶紫染色后在显微镜下观察菌体形态。
1.3.2.2 生理生化鉴定
参照文献[13-14]方法,检测菌株的性质,包括各种糖发酵、V-P反应、接触酶实验。
1.3.2.3 16S rDNA序列扩增与鉴定
参考腾军伟等[15]的方法。使用DNA提取试剂盒提取DNA,引物设计和PCR体系如下:正向引物27F(5’-AGAGTTTGATCATGGCTCAG-3’),反向引物1492R(5’-TAGGGTTACCTTACGACTT-3’)。50 μL反应体系为:上游引物与下游引物各0.5 μL,DNA模板2 μL,按照PCR试剂盒添加反应溶剂10.5 μL,最后加入超纯水36.5 μL。反应参数为:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1.5 min,72 ℃延伸1 min,30 个循环;72 ℃末端延伸8 min,4 ℃保存。将目的片段送至生工生物工程(上海)股份有限公司测序。在EzBioCloud(http://www.ezbiocloud.net/eztaxon/identify)中选取菌株与目的菌株使用MEGA5.0制作系统发育树。
1.3.3 豆粕发酵时间对豆粕成分的影响
1.3.3.1 豆粕发酵
豆粕过20 目筛,加入与豆粕质量相同量的无菌水和其质量1%的红糖。接种10 mL/100 g(加入液体培养基的体积与豆粕质量比例,活菌数约为108CFU/mL)振荡培养16 h的芽孢杆菌菌液,将混合物覆盖两层湿纱布,放在37 ℃培养箱中培养60 h。每12 h取样检测成分变化。发酵结束后,将样品在阴凉通风处干燥,并在-20 ℃冷柜中贮存备用[16]。
1.3.3.2 芽孢随时间的生长变化
取1 g发酵完的样品,加入生理盐水,80 ℃保温20 min杀死营养细胞,采用平板计数法测定芽孢数。
1.3.3.3 可溶性还原糖检测
采用3,5-二硝基水杨酸法[17]。
1.3.3.4 粗蛋白检测
参照GB 5009.5—2010《食品中蛋白质的检测》[18]。
1.3.3.5 可溶性蛋白检测
采用Bi Hua等[19]方法,检测方法与粗蛋白检测条件一致。
1.3.3.6 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDSPAGE)检测致敏蛋白分解
电泳用蛋白提取采取Song等[20]方法,电泳分析采用Teng Da等[21]方法。
1.3.4 豆粕蛋白提取
参考Molina等[22]的方法。发酵豆粕粉碎过60 目筛,取25 g样品加入200 mL纯净水,取1 mol/L NaOH溶液调节pH 8.0,静置1 h,10 000 r/min离心10 min,弃上清液,将沉淀溶入8 倍体积水中,使用1 mol/L HCl溶液调节pH 4.5,10 000 r/min离心10 min,弃上清液,溶解沉淀,将溶液pH值调至中性,冷冻干燥。
1.3.5 SEM检测
参考刘建华等[23]的方法。样品采用离子喷金进行检测,加速电压为5 kV。
1.3.6 豆粕蛋白XRD检测
参考Zhao Xiaoyan等[24]的方法。试样用XRD仪检测,入射波长0.154 8 nm,铜靶。仪器检测设定:管压50 kV,管流20 mA,扫描区域5°~40°,连续扫描。
1.4 数据分析
所有实验重复3 次。实验数据使用SPSS软件分析,所有数据结果表示为。
2 结果与分析
2.1 菌株的筛选
2.1.1 初筛
豆粕发酵过程中蛋白水解是主要的生化反应过程,并且豆粕蛋白营养的提高程度与蛋白酶活力呈正相关[25],所以筛选高产蛋白酶的菌株对发酵结果有重要影响。实验室保存的51 株芽孢杆菌中,有34 株分离于辽宁省的稻草中,17 株分离于吉林省的猪饲料中。本实验采用脱脂乳平板测定蛋白酶水解活力,由于所有菌株在脱脂乳平板上生长扩散严重,所以选择采用牛津杯法初步检测菌株的蛋白酶活力。选择其中13 株菌液产生的水解圈直径在15 mm以上的芽孢杆菌用于复筛实验。
2.1.2 复筛
有研究[26]表明在筛选芽孢杆菌的过程中,由于底物的不同,芽孢杆菌生长状态不同,导致其对不同底物中不同种类蛋白质分解效率不同。文献指出在脱脂乳平板上水解圈较小的芽孢杆菌在豆粕培养基上生长迅速,可以产生高活性蛋白酶。因此,本实验中脱脂乳平板水解圈与蛋白酶活力数值由于在不同底物培养基中测定,并不完全呈正相关。从表1可知,菌株JL8在豆粕为底物的培养基中产蛋白酶活力最高,24 h蛋白酶产量可达(519.1±4.7)U/g,因此JL8被选择作为豆粕发酵菌株,对其进行深入研究。
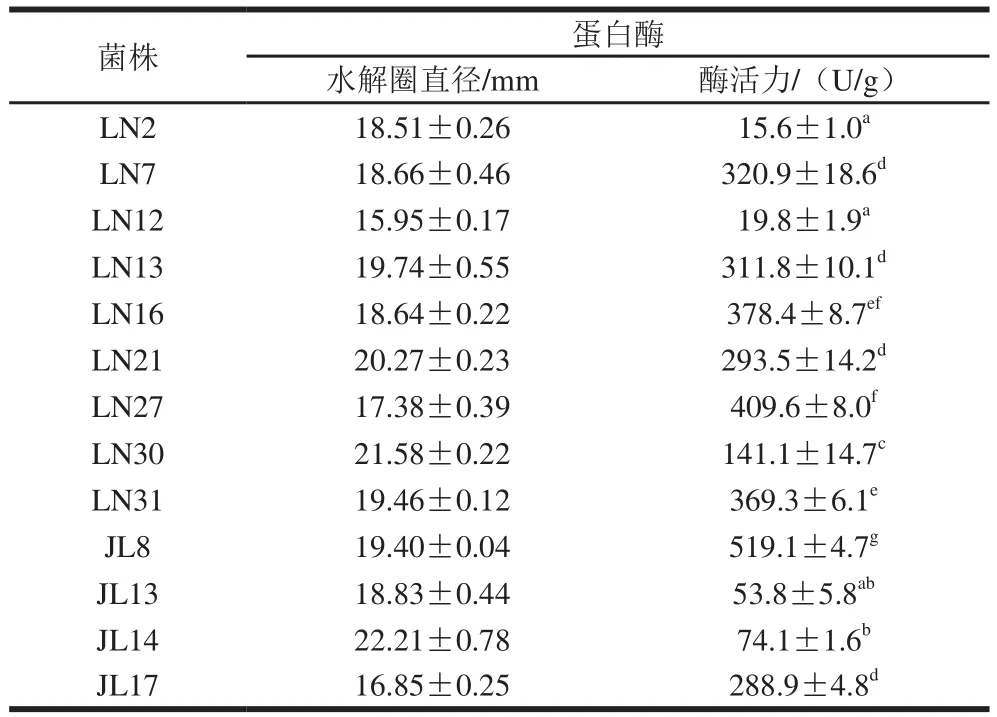
表1 13 株芽孢杆菌的蛋白酶水解圈直径和蛋白酶活力Table 1 Qualitative and quantitative determination of protease produced by 13 Bacillus strains
2.2 菌株鉴定
2.2.1 形态学鉴定
将JL8在固体LB培养基上划线培养24 h后,其菌落为乳白色,边缘不整齐,表面粗糙,中央凸起,会分泌黏液。通过结晶紫染色、革兰氏染色、芽孢染色、穿刺实验显示,JL8为需氧菌、革兰氏阳性短杆菌,产芽孢。图1为JL8的菌落照片和显微镜观察的结晶紫染色图片。
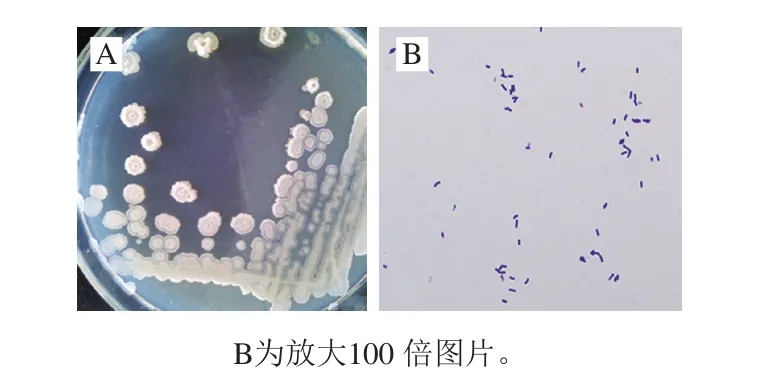
图1 JL8菌落形态(A)和菌体显微镜照片(B)Fig. 1 Colony morphology (A) and micrograph of strain JL8 (B)
2.2.2 生理生化鉴定
如表2所示,JL8更接近暹罗芽孢杆菌或解淀粉芽孢杆菌[15,27]。

表2 JL8的生理生化实验结果Table 2 Physiological and biochemical characteristics of JL8
2.2.3 菌株JL8的分子生物学鉴定
菌株JL8的PCR扩增结果如图2所示。根据1%琼脂糖凝胶的电泳结果,在分子质量约为1 500 bp处有特异性条带,与预计结果相同。使用生工试剂盒回收电泳产物,并送生工生物工程(上海)股份有限公司进行产物碱基序列分析,结果表明JL8的16S rRNA序列长度为1 451 bp。将所得序列上传至EzBioClous的分析系统(http://www.ezbiocloud.net/eztaxon/identify)进行分析,结果显示JL8与1 株暹罗芽孢杆菌(Bacillus siamensisXY18T)的同源性达到99.14%。在基因库中选取10 株与JL8同源性较高的菌株,使用MEG 5.0构建系统发育树(图3)。发育树显示JL8与B. siamensisXY18T在同一个分支上[28-29]。结合上述形态学和生理生化实验结果可将菌株确定为暹罗芽孢杆菌,并命名为B. siamensisJL8。
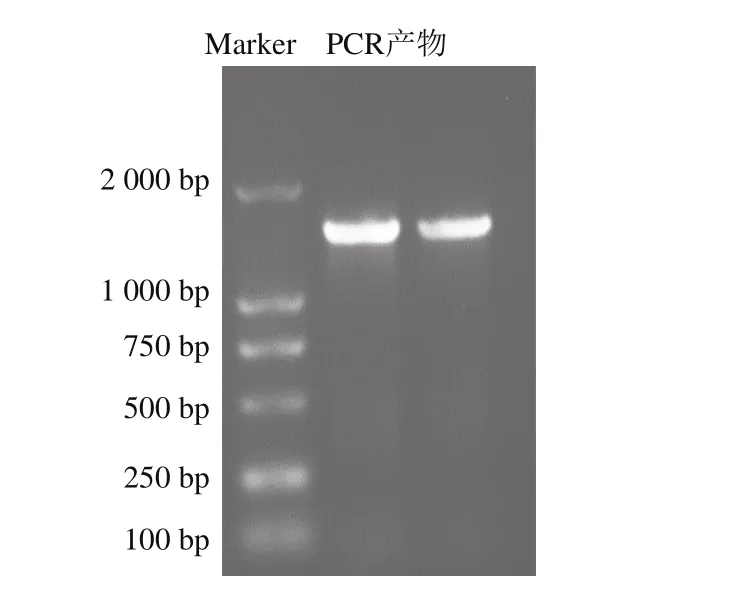
图2 菌株JL8的16S rDNA琼脂糖凝胶电泳Fig. 2 Electrophoresis pattern of PCR amplified product of 16S rDNA from strain JL8
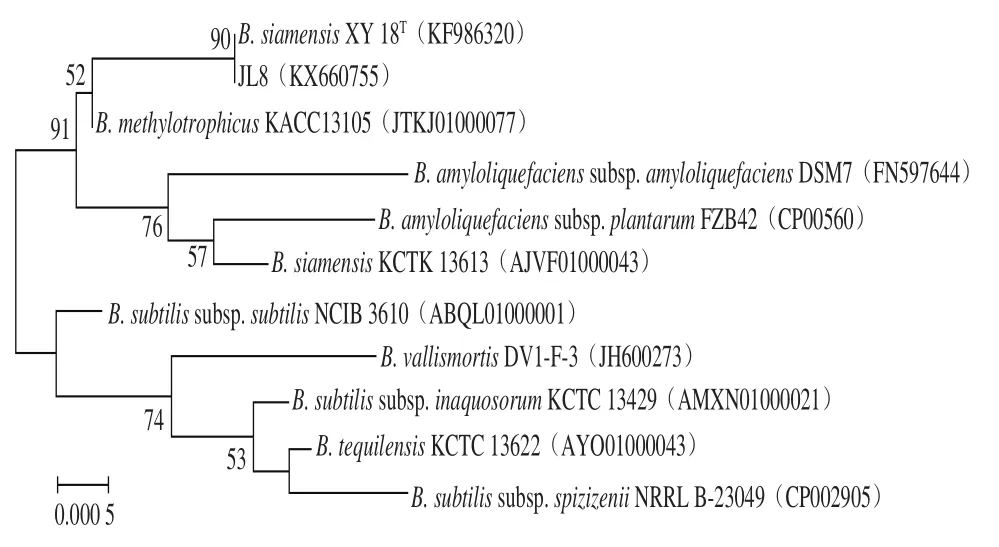
图3 根据16S rDNA序列构建的系统发育树Fig. 3 Phylogenetic tree based on 16S rDNA gene sequences
2.3 发酵时间对豆粕营养成分的影响
2.3.1 发酵菌株芽孢数分析
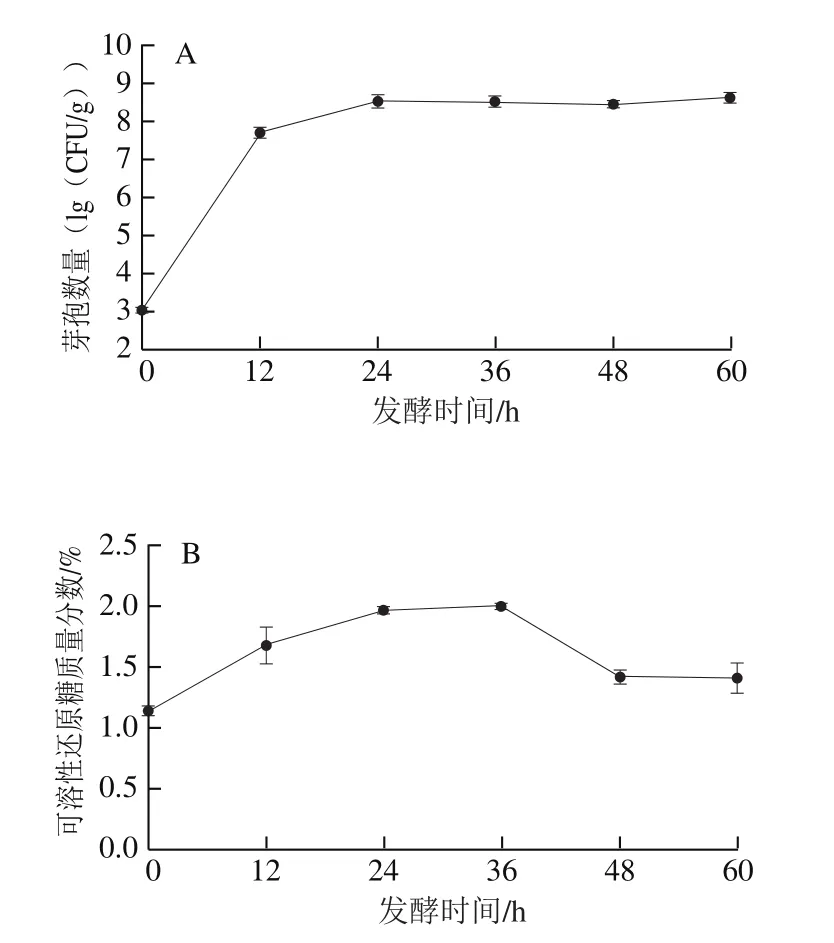

图4 发酵时间对芽孢杆菌数量及豆粕成分的影响Fig. 4 Effects of fermentation time on spore quantity of JL8 and chemical composition of soybean meal
如图4A可知,JL8芽孢数从发酵开始到24 h迅速增长,进入对数生长期,并在发酵24 h后芽孢数量无明显变化进入稳定期,并一直持续到发酵结束,芽孢数没有明显减少,可知整个发酵过程中芽孢杆菌没有进入衰亡期。
2.3.2 豆粕可溶性还原糖含量分析
根据图4B可知,未发酵的豆粕中可溶性还原糖质量分数约为(1.14±0.04)%,发酵开始时至36 h可溶性还原糖的含量小幅度上升,在发酵36 h质量分数达到最大值(1.99±0.02)%。然后含量开始迅速下降,几乎恢复到与未发酵豆粕一致,可能由于芽孢杆菌大量繁殖消耗导致这一现象。整个发酵过程中,可溶性还原糖的含量变化并不显著,也可能由菌株生长过程中的消耗所致。
2.3.3 豆粕总蛋白含量分析
从图4C可以看出,豆粕总蛋白含量较高,未发酵豆粕蛋白质量分数为(41.24±0.84)%,随着发酵进行总蛋白含量逐渐上升,在24 h到最大值(46.69±0.24)%,此后基本稳定,但是在48 h后蛋白含量逐渐下降。这是因为,在芽孢杆菌发酵过程中会将蛋白质分解成氨氮并产生氨气[30],发酵过度的豆粕不但会产生刺鼻的气味,还会降低豆粕的营养成分。
2.3.4 豆粕可溶性蛋白占总蛋白含量分析
如图4D所示,未发酵的豆粕中可溶性蛋白只占总蛋白的(0.77±0.02)%,但是在JL8产生的蛋白酶作用下,可溶性蛋白的含量大幅度上升,在发酵48 h质量分数达到最大值(15.03±0.02)%,含量几乎为未发酵豆粕的20 倍。同时,也可看出48 h后可溶性蛋白含量大幅度下降,这与蛋白酶过度水解有关。另外,从图4D可看出,发酵24~48 h过程中可溶性蛋白含量差别较小,因此,24 h结束发酵对可溶性蛋白含量影响不大。
2.3.5 SDS-PAGE检测过敏蛋白
SDS-PAGE通常用于检测大豆蛋白中的过敏蛋白组分:大豆球蛋白和β-大豆伴球蛋白。从图5可以看出,通过24 h发酵除了20 ku处的碱性亚基,几乎所有大分子蛋白都被蛋白酶降解成小分子产物,降低了豆粕蛋白的过敏源,同时也提高了蛋白的消化性,因为小分子蛋白更容易被人或动物消化吸收。并且延长发酵时间超过24 h并没有进一步分解大分子蛋白,因此24 h发酵已经充分降解了过敏源。
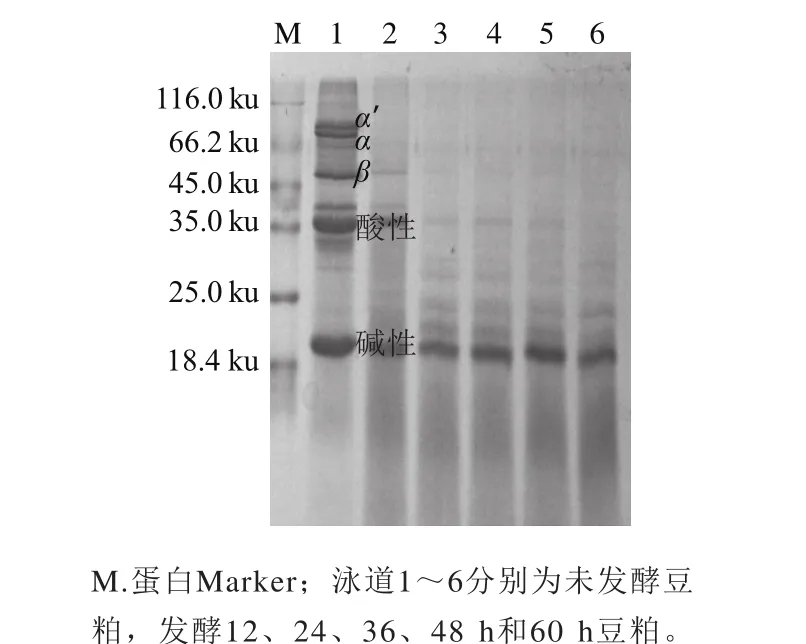
图5 不同发酵时间豆粕蛋白成分分析Fig. 5 SDS-PAGE analysis of protein profile of soybean meal at different fermentation times
2.4 发酵豆粕蛋白的微观结构
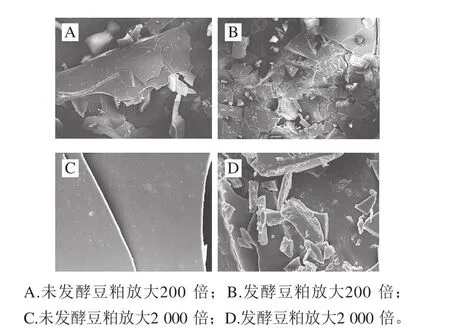
图6 豆粕蛋白与发酵豆粕蛋白SEM图Fig. 6 SEM photos of native and fermented soybean meal protein
从图6可以看出,发酵豆粕蛋白与未发酵豆粕蛋白相比具有更加疏松的结构。在放大200 倍的情况下,可以看出未发酵豆粕呈更大的片状结构相对更加致密,而发酵豆粕呈破碎的小片结构,有些结构在蛋白酶的作用下已经出现孔状结构。进一步放大2 000 倍后,可以看出未发酵豆粕只能观察到非常大的片状结构,结构相对完整,而发酵豆粕依旧可以观察到破碎的不规则结构——被蛋白酶分解过的蛋白碎片。SEM图片反映出JL8菌株蛋白酶对豆粕蛋白的作用效果非常明显,破坏了蛋白相对完整的空间结构。并且疏松的蛋白结构更加有利于消化和吸收,同时也提高了豆粕的营养性。
2.5 蛋白结构的XRD分析
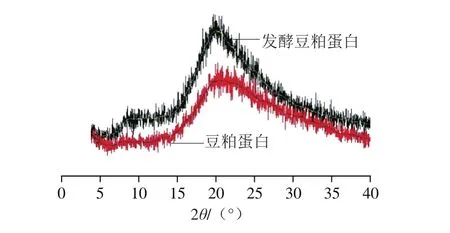
图7 豆粕蛋白与发酵豆粕蛋白XRD图Fig. 7 X-ray diffraction patterns of native and fermented soybean meal protein
如图7所示,两种豆粕蛋白都存在两个2θ峰值,并且都处于2θ约为20°附近,但是强度明显不同,发酵豆粕的2θ角约为20.2°,强度为268,而未发酵豆粕的2θ角为20.7°强度为177,另外,在2θ角为9.2°处发酵豆粕产生一个强度为106的小峰,而未发酵豆粕的小峰为63。未发酵豆粕蛋白XRD结果与张娜等[31]的检测结果基本一致。而图中不同的峰距和不同的强度值,均反映芽孢杆菌分泌的蛋白酶改变了豆粕蛋白的主链结构。Zhao Xiaoyan等[24]认为豆粕蛋白2θ角的吸收峰强度和位置可能会反映出蛋白结构中β-折叠结构的变化,图中2θ角在20°的峰值可以反映出β-折叠结构在整个二级结构中所占的比例,本研究结果中XRD图谱的两种豆粕蛋白的吸收峰有显著差异,发酵的后β-折叠结构的峰强度显著增加,说明发酵豆粕中的β-折叠结构含量明显增加。
3 结论与讨论
经分离、鉴定发现1 株高产蛋白酶的菌株暹罗芽孢杆菌JL8,本研究对发酵大豆制品生产过程中蛋白的变化分析提供了重要的理论依据,并且证明了JL8具有潜在的工业生产可能性。国际范围内,尤其亚洲国家对大豆发酵制品非常青睐,由于其可以降血压、降血脂促进人体健康,越来越多人喜欢食用发酵豆制品,例如日本的纳豆、韩国的豆酱以及泰国的Thua-nao[8,30,32]等。国内外的多项研究表明这些发酵豆制品可以提高产品的营养成分,将大豆中不易消化的大分子蛋白和碳水化合物,分解成人体易于吸收的多肽和可溶性糖[7]。同时,本研究获得的高产蛋白酶菌JL8为暹罗芽孢杆菌,虽然国内外有大量研究使用芽孢杆菌发酵豆粕或其他大豆产品,但是多为枯草芽孢杆菌和解淀粉芽孢杆菌[31,33],近期Kostyleva等[34]使用γ-射线人工诱变出可以用于分解大豆蛋白的地衣芽孢杆菌,但是其他芽孢杆菌用于大豆发酵的研究相对较少,本研究为筛选更多种类的芽孢杆菌用于发酵大豆制品提供了理论支持。
通过对不同发酵时间豆粕产品的成分变化可以得出结论:24 h发酵的豆粕中的大分子过敏性蛋白已经充分降解,即使延长发酵时间也不会使其进一步降解,并且总蛋白质量分数在24 h达到最大值(46.69±0.24)%。虽然根据可溶性蛋白和可溶性还原糖的检测结果,24 h均不是其最大值,但是其24 h值与其最大值差异并不显著,例如:可溶性还原糖24 h质量分数为(1.96±0.03)%,36 h质量分数为(1.99±0.02)%,几乎相同。因此,从生产角度上看发酵24 h可以充分达到发酵目的,并且过长时间的发酵会增加生产成本,也可能导致蛋白过度水解而产生的产品质量下降等问题。
Zheng Li等[16]通过使用暹罗芽孢杆菌JL8在与本研究相同条件下发酵豆粕,结果显示大豆球蛋白、β-伴大豆球蛋白和胰蛋白酶抑制剂等蛋白类过敏源均显著下降,降低幅度分别为86.0%、70.3%和95.0%。总蛋白质量分数从(41.84%±0.84)%显著上升至(46.69±0.24)%。同时,豆粕的体外消化率提高了8.7%,其中大豆球蛋白和β-大豆球蛋白含量检测与本实验中SDS-PAGE分析结果基本一致。这些结果均可以反映出豆粕发酵后影响性有所提高。
最后,通过对24 h发酵豆粕的SEM图谱分析,可以得出发酵已经改变了豆粕蛋白的微观结构,并且SEM结果显示蛋白质具有更加疏松的结构,蛋白颗粒更加小。有研究表明,小颗粒的蛋白具有更高的溶解性,可能更有利于人类或者动物的吸收[35]。崔素萍等[36]通过利用红外光谱分析脱脂豆腐粉蛋白二级结构时发现,大豆蛋白中二级结构主要的类型为β-折叠和无规卷曲,并且这两者的含量多少决定大豆蛋白的溶解性高低。本实验XRD图反映出发酵可以显著提高豆粕蛋白中的β-折叠结构,可能对提高大豆蛋白的溶解性有一定促进作用。
本研究使用的暹罗芽孢杆菌具有发酵周期短、生产成本低等优点,因此,具备产业化开发和应用的潜在优势。
