基于高通量分析流通方式对大目金枪鱼品质与微生物种群变化影响
2019-10-29蓝蔚青巩涛硕张墨言孙晓红
蓝蔚青,车 旭,巩涛硕,张墨言,孙晓红,*,肖 蕾,谢 晶,*
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海冷链装备性能与节能评价专业技术服务平台,食品科学与工程国家级实验教学示范中心(上海海洋大学),上海 201306)
金枪鱼为鲈形目鲭科大洋性高洄游性鱼类,主要分布在太平洋、大西洋、印度洋温带、热带与亚热带水域,大多栖息于大洋上层[1]。其肉质滑嫩鲜美,富含糖类、蛋白质、胆固醇、VA、VD、VE和钙、磷、铁、钠、钾、镁、锌、铜等,尤其以二十二碳六烯酸(docosahexaenoic acid,DHA)和二十碳五烯酸(eicosapntemacnioc acid,EPA)等n-3多不饱和脂肪酸含量极高[2-3],被国际营养组织推荐为世界三大营养鱼类之一[4]。近年来联合国粮食及农业组织列出了7 种世界主要捕捞金枪鱼类,分别为大目金枪鱼、黄鳍金枪鱼、长鳍金枪鱼、马苏金枪鱼、北方蓝鳍金枪鱼、太平洋蓝鳍金枪鱼与鲣鱼[5]。其中,大目金枪鱼(Thunnus obesus)属瘦肉型金枪鱼,产量较高,也是制作生鱼片的主要鱼种。然而,大目金枪鱼在流通过程中由于温度及环境的影响,极易受到微生物的生长代谢而导致其腐败变质,产生异味。新鲜鱼肉样品中的微生物种类复杂,然而随着流通时间的延长,仅有少数适应生长的特定优势腐败菌会使鱼样产生异味腐败物质。其在流通过程中生长代谢力旺盛,致腐能力强,可加速蛋白质、脂肪与核苷酸物质等的降解,导致生物胺与有机酸等物质产生,释放出不良气味导致鱼肉腐败变质。目前,国内外研究人员主要针对金枪鱼冷藏期间的微生物多样性进行分析,如刘爱芳等[6]研究得出大目金枪鱼在冷藏条件下假单胞菌的致腐能力较强,其次是热死环丝菌与不动杆菌。而对其流通期间的微生物多样性研究较少,且分析方法相对单一。
高通量测序技术也称“下一代”测序技术,以能一次并行对几十万到几百万条DNA分子进行序列测定和一般读长较短等为标志,是微生物领域中重要的研究方法,具有测序通量高与结果精准等优点,现已成为微生物领域中重要的研究课题之一[7-9]。因此,虽然该技术建立时间不长,但发展迅速,现已应用于基因组,包括测序、表观基因组学与功能基因组学研究等方面[10]。高通量测序能将待测样品中不可培养的微生物、低丰度的微生物检测出,从而更好反映样品中微生物的种群结构特征,能使待测样品的菌群结构分析得更加全面[11]。近年来,陆续有相关学者利用高通量技术进行水产品贮藏加工期间菌群结构变化的研究。如Yang Shengping等[12]将高通量与生理生化鉴定相结合研究常温(25 ℃)与冷藏(4 ℃)南美白对虾菌群结构的差异,结果发现常温组样品的优势菌为变形杆菌属,冷藏组样品的优势菌为腐败希瓦氏菌、约氏不动杆菌与温和气单胞菌;Zhang Yuemei等[13]研究得出冷藏鲤鱼片经肉桂精油处理后,其菌群结构发生改变,贮藏末期的优势菌为气单胞菌属与乳球菌属,而肉桂精油处理并经真空包装后,其气单胞菌属相对丰度较低;Zhan Huang等[14]研究发现冷藏草鱼片的优势菌为假单胞菌属、气单胞菌属、希瓦氏菌属与不动杆菌属,桂皮精油处理能使草鱼片贮藏期间的菌相组成发生显著改变,使假单胞菌属成为处理组草鱼片的优势菌,并主导其腐败;Zang Jinhong等[15]研究得出腌酸鱼发酵过程中的优势菌为乳酸菌属、大球菌属与葡萄球菌属;而采用高通量测序技术研究水产品流通期间的菌群变化还鲜有报道。
基于此,本实验模拟冷链与断链两种流通方式,分别测定大目金枪鱼样品在不同流通阶段中的pH值、总挥发性盐基氮(total volatile base nitrogen,TVB-N)值、菌落总数与嗜冷菌数的变化,通过高通量测序研究其在不同流通条件下的微生物菌群变化规律,进一步分析大目金枪鱼在两种流通过程中的主要优势菌,以期为水产品流通保鲜提供理论参考。
1 材料与方法
1.1 材料与试剂
大目金枪鱼由浙江丰汇远洋渔业有限公司于2017年6月捕捞于太平洋近海,经船上屠宰冷冻后直接抽真空冻藏于-55 ℃,购自上海海洋大学海洋科学学院。
平板计数琼脂(plate count agar,PCA)、轻质氧化镁、盐酸、硼酸、磷酸盐缓冲液(phosphate buffered saline,PBS)(均为分析纯) 国药集团化学试剂有限公司;TIANamp Stool DNA Kit试剂盒 德国Qiagen生化试剂有限公司;75510-019琼脂糖凝胶试剂、Marker(DL15000)、琼脂糖凝胶电泳缓冲液 美国英杰生命技术有限公司。
1.2 仪器与设备
Nanodrop型紫外定量仪 美国Thermo Scientific仪器有限公司;DYY-6C型电泳仪 北京六一生物科技有限公司;BG-gdsAUTO(130)型凝胶成像系统 北京百晶生物技术有限公司;2720型聚合酶链式反应(polymerase chain reaction,PCR)扩增仪 美国ABI仪器有限公司;FLX800T型酶标仪 美国BioTek公司。
1.3 方法
1.3.1 实验设计
将大目金枪鱼样品分别进行冷链(CK)与断链(L1)两种流通方式处理,具体如下:
CK组:CS1为-55 ℃贮藏120 h;CS2为-55 ℃贮藏192 h;SM-HR为经CS2处理后,再经4 ℃、24 h冷藏存放(家庭冷藏)。
L1组:SM为-55 ℃贮藏120 h后,再经2 ℃、24 h贮藏(超市售卖);SM-FF为样品经SM处理后转入-18 ℃、24 h贮藏(超市冻藏);SM-RS为经过SM-FF处理后重新2 ℃冷藏柜销售24 h(超市二次售卖);R-FT为SM-RS处理后转入4 ℃、24 h冷藏(家庭冷藏)。
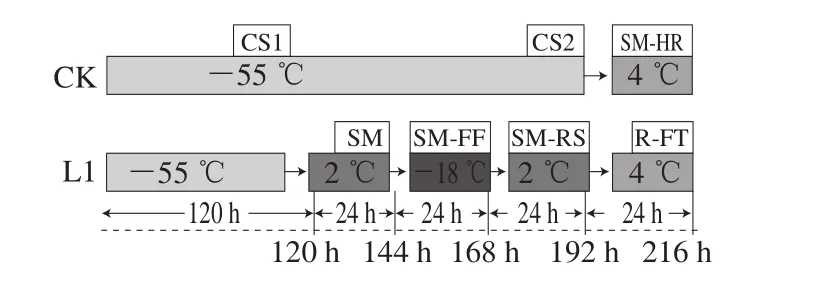
图1 大目金枪鱼流通过程设计路线图Fig. 1 Temperature fluctuations during different circulation processes
如图1所示,CK组样品选取3 个关键点(CS1、CS2、SM-HR),L1组样品选取4 个关键点(SM、SM-FF、SMRS、R-FT)分别进行相关指标测定与高通量分析。
1.3.2 pH值测定
取剁碎的大目金枪鱼肉5 g于烧杯中,加45 mL蒸馏水搅拌均匀,静置30 min后用pH计进行测定[16]。每组样品平行测定3 次。
1.3.3 TVB-N值测定
参考GB 5009.228—2016《食品中挥发性盐基氮的测定》[17],根据半微量凯氏定氮原理利用自动凯氏定氮仪进行测定。每组样品平行测定3 次。
1.3.4 菌落总数与嗜冷菌数测定
在无菌工作台称取10 g大目金枪鱼肉,放入无菌均质袋中,加入90 mL无菌生理盐水后均质机拍打5 min,取1 mL于试管中10 倍稀释;选取3 个最适浓度的稀释液,移取1 mL稀释液于灭菌的培养皿内,倾注培养基,并轻轻转动培养皿使其混合均匀。待其凝固后,将平板翻转,置于恒温培养箱进行培养,培养条件如表1所示,每个稀释度做3 个平行。

表1 大目金枪鱼流通期间的菌落总数与嗜冷菌数培养条件Table 1 Culture conditions for TVC and Psychrobacter count
1.3.5 两种流通方式在不同流通阶段样品的总DNA提取与PCR扩增
不同流通时期大目金枪鱼样品先用灭菌的PBS(pH 7.4)充分洗涤,洗涤液在4 ℃、2 000 r/min离心5 min,取上清液再次于4 ℃、10 000 r/min离心10 min,收集沉淀。再用PBS充分洗涤收集沉淀,移入干净的离心管中,按TIANamp Stool DNA Kit试剂盒要求进行操作,完成样品中细菌DNA提取,分别使用0.8%琼脂糖凝胶电泳和紫外分光光度计检测提取DNA,最后将DNA溶液于-20 ℃保存备用。通用引物选择序列V3-V4通用引物(前引物序列:ACTCCTACGGGAGGCAGCA;后引物序列:GGACTACHVGGGTWTCTAAT)。
随后进行PCR扩增,第1轮PCR步骤:94 ℃骤热启动3 min;94 ℃、30 s变性,45 ℃、20 s退火,65 ℃、30 s延伸,5 个循环;随后94 ℃、20 s变性,55 ℃、20 s退火,72 ℃、30 s延伸,20 个循环,最后72 ℃延伸5 min。第2轮PCR步骤:95 ℃骤热启动3 min;94 ℃、20 s变性,55 ℃、20 s退火,72 ℃、30 s延伸,5 个循环,最后72 ℃延伸5 min。2 轮PCR扩增体系如表2所示。2 轮PCR扩增结束后取3 μL PCR产物于1.2%琼脂糖凝胶电泳检测,具体为样品与Marker上样量5 μL、电压120 V、电流80 mA、电泳时间20 min。
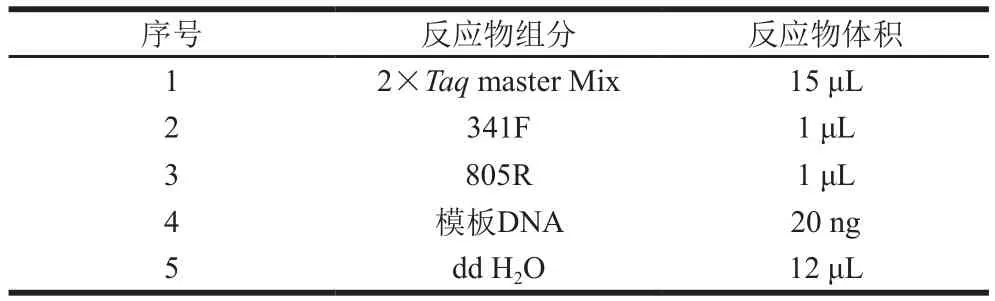
表2 PCR扩增体系Table 2 PCR reaction system
1.3.6 样品DNA纯化回收
参考Caporasoa等[20]方法对细菌扩增的PCR产物和正常扩增片段在400 bp以上的PCR产物,选用0.6 倍的磁珠(Agencourt AMPure XP)处理。在25 μL PCR产物中加入体积0.6 倍的磁珠,振荡充分悬浮后放在磁力架上吸附5 min,移液枪吸出上清液;加入30 μL 0.6 倍的磁珠洗涤液,振荡充分后放在磁力架上吸附5 min,吸出上清液;加入90 μL WashBuffer,反向置于磁力架上,使磁珠吸附到PCR管另一面,充分吸附后吸出上清液;将其放在55 ℃烘箱中处理5 min,再加入30 μL Elution Buffer洗脱;将PCR管放在吸附架上5 min,充分吸附,移出上清液到离心管中,定量备用。
1.3.7 两种流通方式在不同流通阶段样品的高通量测序
将定量好的DNA文库样本送至派森诺生物(上海)股份有限公司进行高通量测序。
1.4 数据处理
实验数据均采用3 次平行实验的平均值,数据用软件Origin(Pro)8.5绘制曲线,数据间差异通过统计软件SPSS19.0中的Duncan新复极差法进行方差分析与多重比较,结果以表示。对测序得到的数据在测序平台进行分析。
2 结果与分析
2.1 两种流通方式在不同流通阶段样品的pH值测定结果
水产品在贮藏期间的pH值变化会出现先降后升的变化趋势,可能由于原料捕获宰杀贮藏期间,先后经历僵硬、解僵、自溶与腐败等阶段。僵直期间其中的ATP分解产生乳酸、丙酮酸、磷酸等酸性物质,使其pH值有所下降。后期鱼肉中的蛋白质及其部分含氮物质会被分解成氨基酸、氨、三甲胺、硫化氢、吲哚等碱性物质,导致样品的pH值逐渐上升[21]。

图2 流通方式对大目金枪鱼pH值变化的影响Fig. 2 Changes in pH value in big-eye tuna during different circulation processes
从图2可看出,L1组样品的pH值低于CK组,CK组变化平缓,L1组则呈明显先降后升趋势。说明在低温条件下鱼肉中微生物活动受到抑制,酸性物质等释放较少,因此pH值无显著变化。而L1组样品在168 h前的pH值降幅明显,说明鱼肉从解冻开始微生物活动旺盛,使酸性物质大量分解,168 h后样品的pH值缓慢上升说明此时氨及胺类物质逐渐被释放。李双双[22]研究了不同浓度生物保鲜剂对-18 ℃冻藏黄鳍金枪鱼品质变化影响,其实验结果与本研究结果变化趋势相一致。因此,温度波动对微生物产生影响,导致其pH值变化剧烈[23]。
2.2 两种流通方式在不同流通阶段样品的TVB-N值测定结果
鱼肉贮藏过程中由于微生物及鱼体内源酶的共同作用,鱼肉蛋白质发生降解,产生胺类物质,导致其TVB-N值升高,该值与鱼体鲜度相关性好,是常用的判断水产品腐败程度的标准之一[23]。TVB-N值越高,表明样品的腐败程度越严重。

图3 流通方式对大目金枪鱼TVB-N值变化的影响Fig. 3 Changes in TVB-N value in big-eye tuna during different circulation processes
由图3可知,两组样品在贮藏前期的TVB-N值差异不明显,从144 h后,对照组样品TVB-N值开始缓慢上升,而L1组样品相较于CK组,其值明显偏高。可能由于鱼肉在低温条件下,微生物生长被抑制。其中,CK组样品在216 h时,其TVB-N值仍保持较低水平,而L1组样品在168 h后显著增长,216 h时达(16.05±0.17)mg/100 g,超出鲜度水平,处于不可接受状态。因此,大目金枪鱼样品的TVB-N值随着贮藏温度与流通时间的延长相应增加,当流通温度达2 ℃与4 ℃时,其TVB-N值的上升幅度明显加剧。Hozbor等[24]研究发现TVB-N与细菌性腐败有关。汤元睿等[25]研究了冷链物流过程中温度变化对大目金枪鱼新鲜度的影响,结果得出温度变化可能加快细菌繁殖,导致TVB-N值升高,鱼肉腐败加速。
2.3 两种流通方式在不同流通阶段样品的菌落总数与嗜冷菌数测定结果
菌落总数对水产品在贮藏过程中品质的影响特别明显,由微生物生长和新陈代谢所造成的水产品损失可达30%。菌落总数的变化可反映样品中的蛋白质和氨基酸分解代谢情况,反映其腐败程度。金枪鱼生食标准提出可食用的菌落总数上限为4.0(lg(CFU/g))[26]。由图4所示,CK组样品的菌落总数在168 h后开始增长,216 h后菌落总数达(3.51±0.19)(lg(CFU/g)),此时金枪鱼已接近生食限值。而L1组样品在168 h时超过生食限值,可能由于2 ℃与4 ℃时,温度波动相对剧烈,且在销售温度2 ℃细菌生长加剧。徐慧文等[27]研究了冰藏和冷藏条件下大目金枪鱼品质变化影响表明,与冷藏处理相比,冰藏能有效抑制微生物的增殖,更有利于延缓样品品质的劣变,其研究结果验证了本研究的菌落总数变化特点。
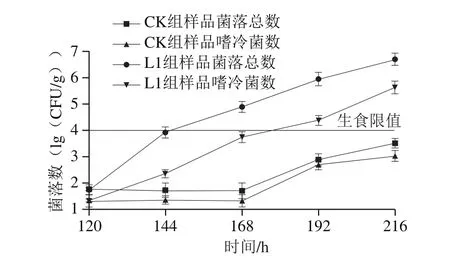
图4 流通方式对大目金枪鱼菌落总数与嗜冷菌数变化的影响Fig. 4 Changes in TVC and PC in big-eye tuna during different circulation processes
在菌落总数中,嗜冷菌一般占10%以上。人们在生产中采取低温保藏的方式抑制微生物生长繁殖,嗜温菌与嗜热菌等的生长繁殖在低温贮藏过程中受到抑制,而嗜冷菌能在低温环境中能正常生长,因而逐渐成为优势菌株。由于嗜冷菌种类繁多,其菌落组成很大程度决定了生鲜食品的质量[28]。由图4可知,样品在低温流通过程中,其嗜冷菌始终存在,在-55 ℃超低温条件下相对较少,而从-18 ℃开始有明显增长。随着温度波动的加剧,两组样品的嗜冷菌数均显著增加,L1组样品的嗜冷菌数始终高于CK组样品。216 h后两组样品的嗜冷菌数分别为(3.03±0.21)(lg(CFU/g))与(5.64±0.24)(lg(CFU/g))。嗜冷菌的变化趋势与菌落总数基本一致,因此导致样品发生腐败。
2.4 两种流通方式在不同流通阶段样品的PCR扩增结果
对两种流通方式在不同阶段的7 个样品分别进行样本总DNA提取,在16S RNA V3-V4区基因扩增,并对PCR扩增结果进行胶回收,扩增片段大小为500 bp,以获得样本文库,如表3所示。
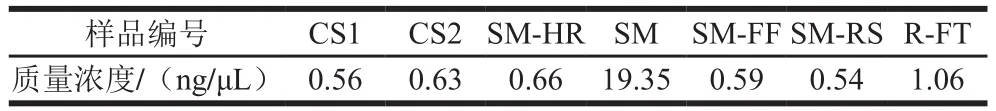
表3 大目金枪鱼样本PCR产物定量结果Table 3 Quantitative results of total microbial DNA from big-eye tuna with PCR ampli fi cation
从表3可看出,大目金枪鱼的PCR产物定量分析结果不高,表明其DNA浓度低,但仍可开展后续研究。
2.5 两种流通方式在不同流通阶段样品的微生物群落结构差异比较
通过对两种流通方式7 个样本的有效基因序列在软件中进行分析,根据各个样本中细菌种类组成绘制成柱状图。图5显示在细菌属水平上分析两种不同流通过程中在不同温度及不同流通时间下的变化情况,图中各种细菌种类的比例代表不同阶段细菌活性的状态。
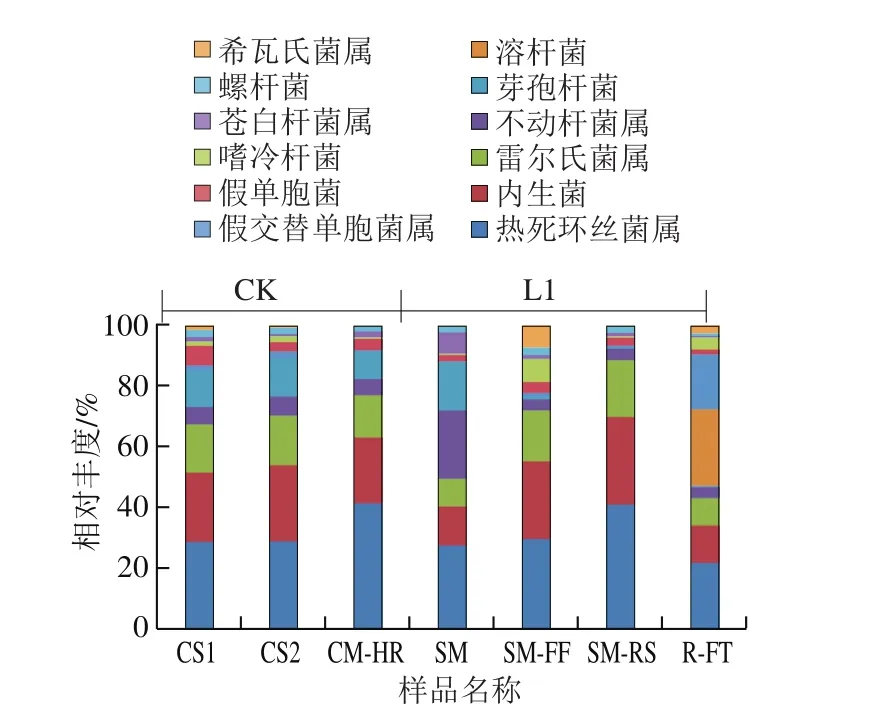
图5 不同流通方式样品在属水平上微生物群落结构组成差异Fig. 5 Difference in microbial population structure during different circulation processes at the genus level
由图5可知,CK组(CS1、CS2与SM-HR)细菌种类相似,其中SM-HR与CS1、CS2相比,有略微上升趋势。说明在冷链过程中保持-55 ℃细菌种类与菌数相对不变。后期由于样品在216 h时温度达到4 ℃,流通温度时有一定增长,表明温度波动使细菌种类与菌数上升。SM-HR的优势菌主要为热死环丝菌(Brochothrix thermosphacta)、内生菌(Endophytes)、雷尔氏菌(Ralstonia solanacearum)、不动杆菌属(Acinetobacterspp.)、芽孢杆菌属(Bacillusspp.)与假单胞菌属(Pseudomonasspp.);而R-FT的主要菌为热死环丝菌、内生菌、雷尔氏菌、不动杆菌属、溶杆菌(Lysobacter)、假交替单胞菌属(Pseudoalteromonasspp.)、嗜冷杆菌属(Psychrobacterspp.)与希瓦氏菌属(Shewanellaspp.),其假单胞菌与嗜冷杆菌都占有相当比例,前期通过对不同流通阶段样品嗜冷菌数的测定结果进一步验证了后期高通量测定结果,其综合变化趋势与刘爱芳等[6]研究结果一致。因此,大目金枪鱼流通期间需合理控制温度波动,抑制微生物生长繁殖。
2.6 两种流通方式在不同流通阶段样品的主成分分析
主成分分析可反映样本间分析组分的差异,主成分分析相应坐标轴上样本距离越近,其分析组分间的相似性越高[29]。其中,高乾坤等[30]采用主成分分析法分析了不同产地带鱼冷藏期间的细菌群落差异,表明不同产地样品间菌群结构变化明显,也充分说明了将其应用于高通量测序结果分析的可行性。
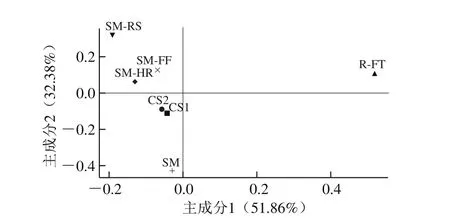
图6 不同流通方式对大目金枪鱼样品菌群结构变化的主成分分析Fig. 6 Principal component analysis of changes in microbial population in big-eye tuna during different circulation processes
如图6所示,主成分1贡献率为51.86%;主成分2贡献率为32.38%。这2 个主成分是两种不同流通方式在不同阶段样品微生物群落结构组成差异的主要因子[31]。在主成分1方向上,CK组样品CS1、CS2与L1组样品SM的样本点分布差异不大,而其与L1组样品R-FT差异十分显著,说明流通方式与流通阶段在主成分1水平上对样品菌群结构变化影响显著;在主成分2水平上,各组样品在不同流通阶段中的分布区域十分明显,CK组样品的样本点基本上分布于Y轴的下方,L1组样品的样本点分布于Y轴的上方,即主成分2是解释各组样品在不同流通阶段中菌群结构变化的主要成分,该研究结果与高通量群落结构分析结果基本一致。
3 结 论
CK组微生物变化不显著,其在216 h时各项指标仅有较小增幅;L1组样品在流通期间的品质指标与CK组差异显著,其pH值呈先降后升的变化趋势,TVB-N值、菌落总数与嗜冷菌数增幅显著。其在-55 ℃、120 h,-18 ℃、24 h,2 ℃、24 h后趋势明显,样品在流通168 h后超出生食标准。
SM-HR优势菌主要为热死环丝菌、内生菌、雷尔氏菌、不动杆菌属、芽孢杆菌属与假单胞菌属;而R-FT的主要菌为热死环丝菌、内生菌、雷尔氏菌、不动杆菌属、溶杆菌、假交替单胞菌属、嗜冷杆菌属与希瓦氏菌属。主成分分析结果可用于表征两种流通方式在不同流通阶段大目金枪鱼样品间的菌群结构差异。
