肠膜明串珠菌ATCC 12291蔗糖磷酸化酶的酶学性质及转糖苷分子改造
2019-10-29何贺贺林厚民寇力丹覃凤兰韦宇拓黄日波杜丽琴
何贺贺,林厚民,寇力丹,覃凤兰,韦宇拓,黄日波,杜丽琴*
(亚热带农业生物资源保护与利用国家重点实验室,广西大学生命科学与技术学院,广西 南宁 530005)
蔗糖在植物体内广泛存在,是人类生产生活中最重要的食品添加剂之一[1]。利用生物酶资源拓宽蔗糖的应用范围,生产高附加值产品成为研究热点方向之一。蔗糖磷酸化酶(EC 2.4.1.7)在碳水化合物活性酶数据库属于糖基水解酶13家族[2]。此酶能够可逆催化蔗糖和无机磷酸生成D-果糖和葡萄糖-1-磷酸[3],葡萄糖-1-磷酸是糖酵解途径的重要中间体[4],这使得蔗糖磷酸化酶在代谢中具有重要作用。蔗糖磷酸化酶除能水解蔗糖以外,还具有催化转移葡萄糖苷键的能力[5],并且受体较为广泛,包括无机磷酸、水,及含有酚羟基、醇羟基及羧基的物质[6]。葡萄糖基具有极性强、结构稳定的特点,因此所生成的产物在理化性质如耐热性、水溶性、抗氧化性等方面都普遍得到改善,使得该酶在食品、医药、及化妆品等行业具有较强的应用价值和潜力[7]。目前此酶研究最多的是催化转糖苷反应,并且对其分子改造大多也是为了改善转糖苷性质。其中糖类底物的转糖苷产物益生元低聚糖,常被作为低热量、非龋齿性的食品添加剂,也是目前研究热点之一[8]。
蔗糖磷酸化酶主要存在于微生物体内,最早于20世纪40年代分别被Kagan[9]与Doudoroff[10]等从肠膜明串珠菌和嗜糖假单胞菌中发现。Schwarz等[11]通过对肠膜明串珠菌的蔗糖磷酸化酶进行突变改造,确定了196位点的天冬氨酸为其转糖苷关键位点之一,揭开了探索该酶催化机理的序幕。Van Den Broek等[12]克隆表达了来自青春双歧杆菌DSM 20083的蔗糖磷酸化酶,并研究转糖苷性质,发现其对于单糖具有良好的转糖苷特性,而二糖和三糖并不适合作为其底物。李恬等[13]以蔗糖作为葡萄糖的供体底物,麦芽四糖作为加成引物,利用蔗糖磷酸化酶和葡聚糖磷酸化酶协同作用探索出了直链糊精的低成本且操作简单的合成途径,为工业化大规模生产提供了理论基础。
为改善酶学性质,对蔗糖磷酸化酶的分子改造也取得了较多进展。Verhaeghe等[14]利用半理性突变的方法,构建突变体文库并进行高通量筛选,得到了一个对曲二糖选择性高达95%的双位点突变体,为其在食品及益生元领域的应用提供了基础。Kraus等[15]首次对于活性位点进行突变,间接性的增大活性口袋空间,使得该酶能对以多酚类的底物具有转糖苷作用。其中对于槲皮素的糖基化能提高其抗氧化还原能力[16],并且人体对于其吸收利用能力也得到增强[17]。
综上,对于蔗糖磷酸化酶的研究必定是以大量酶学性质数据作为基础和支撑的。本研究旨在丰富不同来源蔗糖磷酸化酶的数据,对蔗糖磷酸化酶进行改造,进一步挖掘潜在的结构和理论价值,得到更多有关于分子改造的经验,为此酶分子改造技术的进步以及在食品行业的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
肠膜明串珠菌Leuconostoc mesenteroidesATCC12291、大肠杆菌Escherichia coliM15/pREP4、大肠杆菌E. coliXL10-Gold均为本实验室保存。
高保真DNA聚合酶Prime STARTMHS、dNTP Mixture、λDNA/Hind III Marker、蛋白质Marker以及限制性内切酶EcoR I、Hind III、BamH I、T4DNA连接酶等大连TaKaRa宝生物工程有限公司;DpnI 富酶泰斯生物技术(深圳)有限公司;DNA纯化试剂盒、胶回收试剂盒、质粒DNA小量提取试剂盒 BioFlux杭州博日科技有限公司;镍亲和层析填料Ni-NTA 德国Qiagen公司;异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG) 美国Gibco公司;葡萄糖-1-磷酸 美国Sigma公司;色谱级乙腈 美国Fisher公司;葡萄糖、蔗糖等其他糖类试剂为国产分析纯。
1.2 仪器与设备
Biometra聚合酶链式反应(polymerase chain reaction,PCR)仪 德国耶拿公司;SHEL LAB W20M-2水浴锅 上海精宏实验设备有限公司;恒温培养箱 上海予腾生物科技有限公司;恒温摇床 上海智城分析仪器制造有限公司;台式离心机 德国艾本德公司;酶标仪 美国伯腾仪器公司;1260 infinity Series高效液相色谱分析仪 美国安捷伦公司。
1.3 方法
1.3.1 肠膜明串珠菌ATCC 12291蔗糖磷酸化酶基因的克隆
将肠膜明串珠菌ATCC 12291活化培养,采用机械破胞法提取基因组DNA。对已报道的肠膜明串珠菌ATCC 12291蔗糖磷酸化酶基因lmsp所编码的氨基酸序列进行蛋白质结构和信号肽分析,然后设计扩增引物,引物为:LMsp-F:5’-CGCGGATCCGAAATTCAAAACA AAGCAATGTTG-3’,引入BamH I酶切位点;LMsp-R:5’-CCCAAGCTTTTAGTGGTGGTGGTGGTGGTGGTTCTGAGT CAAATTATCACT-3’,引入Hind III酶切位点和组氨酸标签。
PCR程序:98 ℃、2 min预变性,98 ℃、10 s变性,56.5 ℃、15 s退火,72 ℃、2 min延伸,30 个循环;72 ℃、10 min。将PCR产物和pQE30质粒分别进行BamH I和Hind III双酶切处理,之后经连接并转化至E.coliXL10-Gold中。经过测序,将成功构建的重组质粒命名为pQE-lmsp。
1.3.2 重组酶LMsp的诱导表达和蛋白质纯化
将重组质粒转入E. coliM15/pREP4中,于37 ℃培养至OD600nm约0.4~0.6时,加入终浓度为0.5 mmol/L的IPTG,20 ℃、180 r/min培养22 h。离心并收集菌体,超声波破碎后,对上清液进行Ni-NTI镍亲和层析,纯化后得到重组酶命名为LMsp,并进行变性十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)。
1.3.3 重组酶LMsp的酶学性质分析
利用3,5-二硝基水杨酸比色法测定酶学的基本参数[18]。反应体系设为200 µL。取180 µL 0.2 mol/L磷酸氢二钠-0.1 mol/L柠檬酸缓冲液、10 µL 20 g/100 mL蔗糖,在最适反应温度温浴2 min后,加入10 µL适当稀释酶液,精确反应20 min后加入2 倍体积3,5-二硝基水杨酸(400 µL)终止反应,沸水浴5 min显色。待样品冷却至室温,取200 µL至96 孔酶标板中,在540 nm波长处读取样品的吸光度。
蔗糖磷酸化酶活力单位(U)的定义:在最适反应条件下,每1 min水解蔗糖释放1 µmol还原糖所需的酶量。
1.3.3.1 最适pH值的测定
以pH 4.0~8.0的磷酸氢二钠-柠檬酸缓冲液配制反应体系,加入适当稀释纯酶液在37 ℃条件下精确反应20 min,测定不同pH值条件下的酶活力。以最高活力为100%,计算不同pH值条件下酶的相对活力,相对活力最高的pH值即为酶最适反应pH值。
1.3.3.2 最适温度的测定
在最适p H值条件下,测定在不同反应温度(30~65 ℃)条件下的酶活力,以最高活力为100%计算不同温度条件下酶的相对活力,相对活力最高的温度即为酶最适反应温度。
1.3.3.3 重组酶pH值稳定性的测定
将重组酶在不同pH值的缓冲液(4.0~8.0)中于4 ℃保存12 h,在最适反应条件下测定其残存酶活力,以保存在pH 7.0的磷酸氢二钠-磷酸二氢钠洗脱液中的酶活力为100%,计算不同pH值下重组酶的相对活力。
1.3.3.4 重组酶热稳定性的测定
将重组酶保存在不同温度(25~60 ℃)下1 h,立即取出放于冰上,在最适反应条件下测定残存酶活力,以4 ℃保存的酶活力为100%,计算不同温度下重组酶的相对活力。
1.3.3.5 重组酶Km和Vmax值的测定
在最适反应温度和pH值条件下,测定以不同浓度(1.5~234 mmol/L)蔗糖为底物时的酶活力,带入经典米氏方程得到酶的Km、Vmax值。
1.3.3.6 转糖苷功能的测定
以15%葡萄糖-1-磷酸(溶于最适pH值的磷酸氢二钠-柠檬酸缓冲液)为葡萄糖基供体,5%的D-阿拉伯糖、L-阿拉伯糖、D-木糖、D-木糖醇、D-半乳糖、D-甘露糖、D-甘露糖醇、D-果糖、D-葡萄糖、L-山梨糖、D-山梨糖醇、L-鼠李糖为受体,加入60 µg纯化酶液配制成200 µL反应体系,在最适条件下反应12 h,沸水浴10 min终止反应,冷却至室温后,12 000 r/min离心30 min取上清液进行高效液相色谱分析,检测其反应产物。转化率定义为实验组底物减少量与对照组底物量的比值。
色谱检测条件:检测器:示差折光检测器(Agilent 1260 RID)、散射蒸发光检测器(Allteach 2000ES ELSD);色谱柱:Alltima Aminoz NH2柱(4.6 mm×250 mm,5 µm);流动相:72%乙腈;流速:1 mL/min;柱温:室温(26 ℃);上样量:20 µL。
1.3.4 LMsp的分子改造
采用半理性设计的方法寻找可能影响蔗糖磷酸化酶LMsp转糖苷活性的关键氨基酸,并利用反向PCR技术进行定点突变改造。
使用建模软件SWISS-MODEL对蔗糖磷酸化酶LMsp的氨基酸序列进行分析,以青春双歧杆菌蔗糖磷酸化酶的3D结构(序列一致性>36%)为模板,建立LMsp的蛋白质三维模型。使用PyMOL软件对LMsp的蛋白质三维模型进行分析,并结合与另外2个氨基酸序列相差较小,但转糖苷性质差异较大的两个序列的比对结果(分别来自于肠膜明串珠菌NRRL B1149、肠膜明串珠菌NRRL B1355的蔗糖磷酸化酶),找到了3 个可能影响LMsp转糖苷活性的关键氨基酸残基,并进行突变改造。突变引物如表1所示。
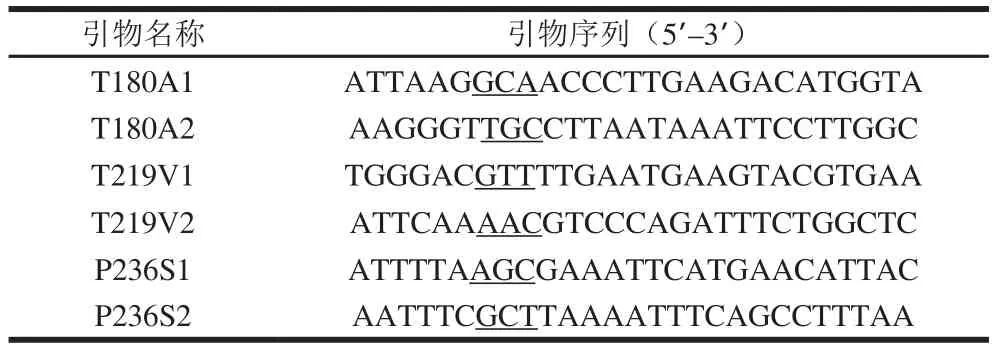
表1 反向PCR引物Table 1 Primer sequences used for inverse-PCR
定点突变PCR程序:除退火温度为57 ℃外,其他条件同1.3.1节。PCR产物中加入Dpn I酶消解质粒模板,胶回收后将PCR产物转入E. coli XL10-Gold中经过测序获得正确突变体。并且在单点突变体基础上,进行累积突变,获得T180A-T219V、T180A-P236S、T219V-P236S和T180A-T219V-P236S四个联合突变体。
蔗糖磷酸化酶LMsp突变体的诱导表达参照1.3.2节进行;酶学性质测定及转糖苷性质研究参照1.3.3节进行。
2 结果与分析
2.1 蔗糖磷酸化酶的生物信息学分析和基因克隆
使用SMART软件对肠膜明串珠菌ATCC12291的蔗糖磷酸化酶基因所编码的氨基酸序列进行蛋白质结构组件分析。生物信息学分析与基因克隆结果如图1所示。结果表明其N端30~337位氨基酸为α-淀粉酶结构域,不具有信号肽。以肠膜明串珠菌ATCC12291的基因组DNA为模板,用引物LMsp-F、LMsp-R按照1.3.1节中方法PCR扩增目的基因,得到一条大小约为1.5 kb的特异性条带,测序正确后将其命名为lmsp,对应的蛋白质大小预计为55 848.77 Da。
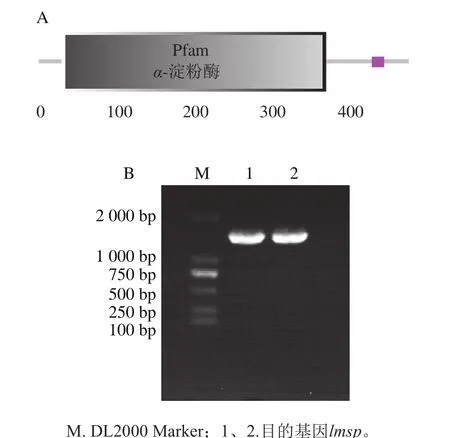
图1 LMsp蛋白质结构组件(A)及目的基因的克隆(B)Fig. 1 Modular architecture (A) and cloning (B) of target gene
2.2 重组酶LMsp的诱导表达和蛋白质纯化
重组菌诱导后裂解物菌体蛋白的SDS-PAGE分析如图2所示。含有重组质粒的菌株约在56 kDa大小处表达有明显的蛋白质特征条带,与理论分子质量一致。纯化后的重组蛋白LMsp在预期大小处的条带明显且单一,说明目的蛋白符合预期,即lmsp已在宿主菌内成功表达,可进一步测定酶学性质。

图2 重组蛋白LMsp的SDS-PAGE分析Fig. 2 SDS-PAGE analysis of recombinant protein LMsp
2.3 重组酶LMsp的酶学性质分析
2.3.1 pH值和温度对于重组酶LMsp的影响
如图3A、B所示,LMsp的最适pH值为6.5,在pH 5.5~7.5之间能保持50%以上的酶活力。最适温度为40 ℃,在30~45℃之间能保持50%以上的酶活力。
LMsp在pH 4.5~8.0的磷酸二氢钠-柠檬酸缓冲液中4 ℃保存24 h后,残余酶活力在70%以上(图3C),说明在此范围内LMsp的酸碱稳定性较好。在25~40 ℃条件下水浴保温1 h后,仍残留有50%以上的酶活力,其中在25~35 ℃时能稳定保留有80%以上的酶活力(图3D)。
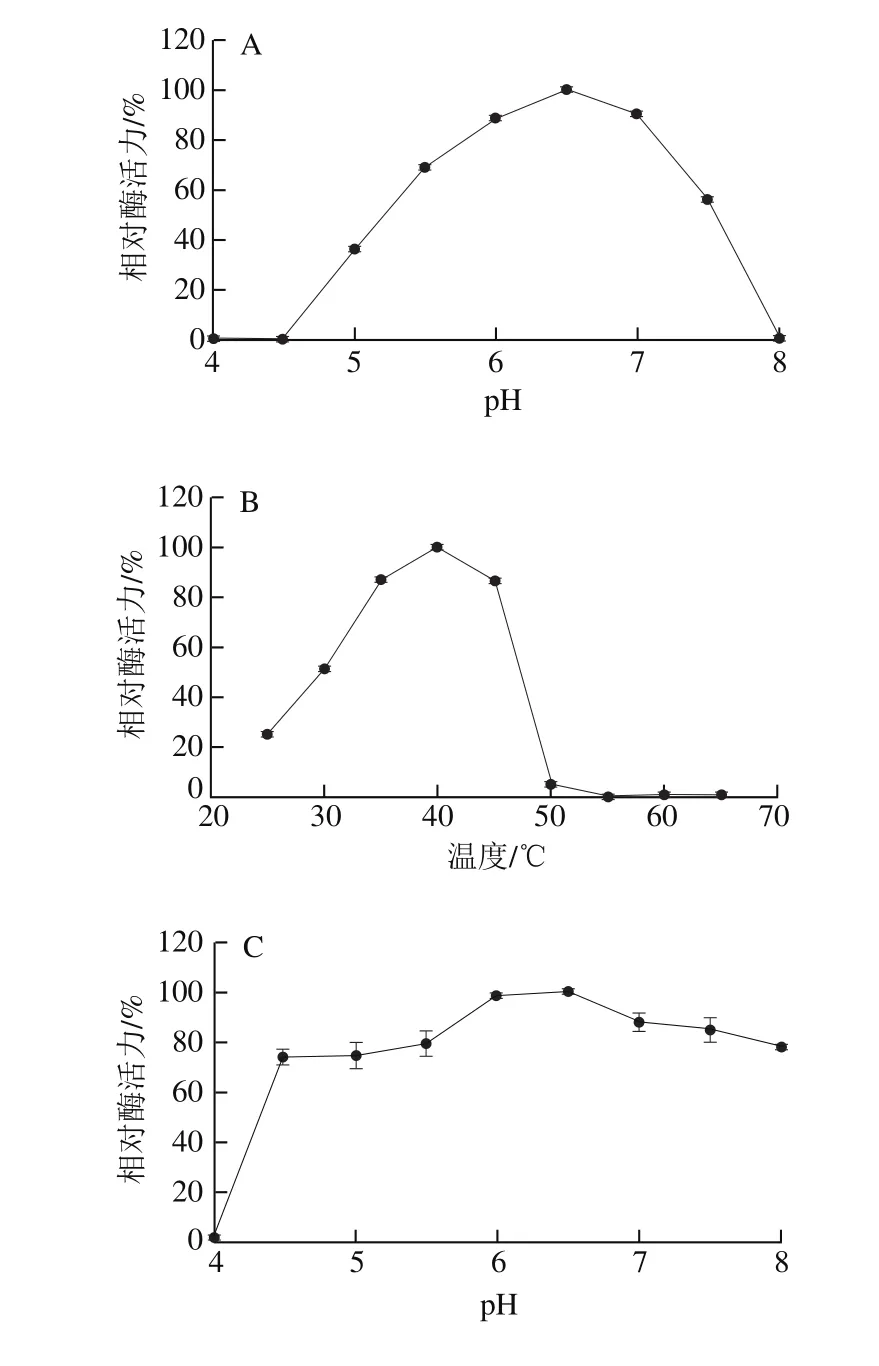
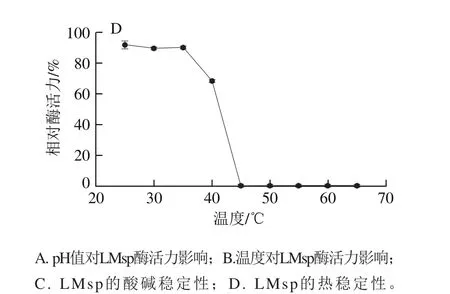
图3 pH值和温度对重组蛋白质LMsp酶活力的影响Fig. 3 Effect of pH and temperature on recombinant enzyme activity
2.3.2 LMsp的动力学常数测定结果
利用GraphPad Prism 5软件对所测酶活数据进行处理,通过非线性回归拟合得到动力学常数(图4)Km为(34.16±1.219)mmol/L,Vmax值为(370.5±6.049)μmol/(mg·min)。
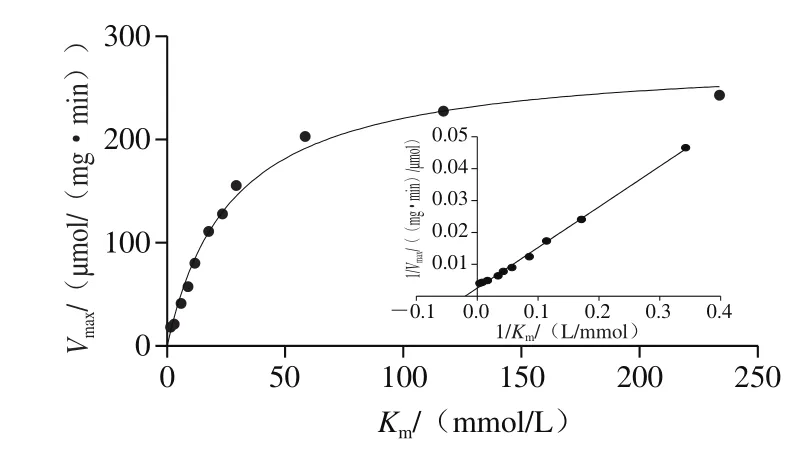
图4 LMsp的Km和Vmax值Fig. 4 Km and Vmax values of LMsp
2.3.3 LMsp转糖苷功能分析
在以15%的葡萄糖-1-磷酸为供体,受体为5%的糖类时,检测反应产物并计算转化率如表2所示。可知LMsp对D-阿拉伯糖、L-阿拉伯糖、D-木糖醇、D-半乳糖、D-甘露糖、D-果糖、D-葡萄糖、L-山梨糖具有转糖苷活性,尤其对L-阿拉伯糖具有75%的转化效率。
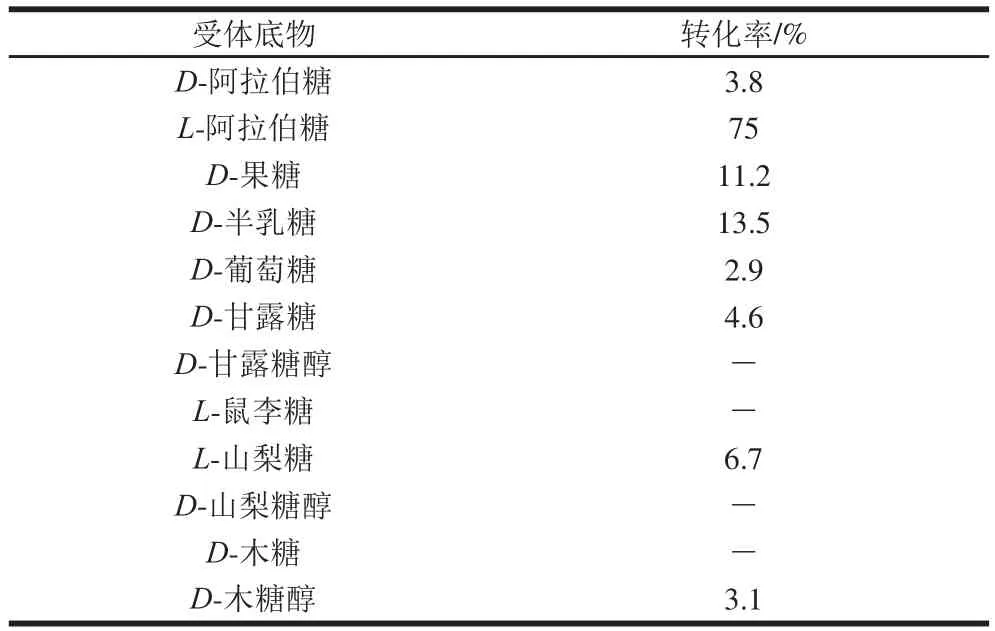
表2 LMsp转糖苷产物的转化率Table 2 HPLC analysis of transglycosidase products from LMsp
2.4 LMsp的分子改造
2.4.1 LMsp的同源建模分析与突变位点的选择
选择来自与蔗糖磷酸化酶LMsp氨基酸序列一致性大于30%(序列一致性为36.58%)的青春双歧杆菌3D结构为模板,使用SWISS-MODEL建立了LMsp的蛋白质三维结构。找出了距离LMsp催化亲核试剂196位天冬氨酸10 Å以内的氨基酸残基位点(图5中的橘黄色棒状物)。
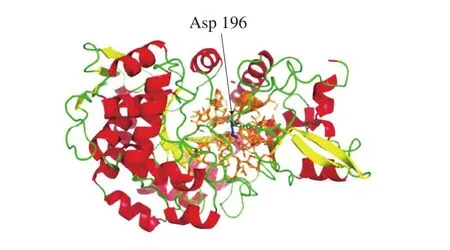
图5 距离LMsp催化亲核试剂10 Å以内的氨基酸残基Fig. 5 Amino acid residues from the catalytic nucleophile of LMsp within 10 Å
已有研究[19]发现来自肠膜明串珠菌NRRL B1149和肠膜明串珠菌NRRL B1355的蔗糖磷酸化酶与LMsp有高达86%以上的氨基酸序列相似性,但转糖苷活性差别较大,因此推测2 种菌中不同的氨基酸残基中包含有影响转糖苷活力的关键位点。
结合LMsp同源建模所找到的距离催化亲核试剂10 Å以内的氨基酸残基位点,并根据序列比对分析的结果,找出了3 个可能影响LMsp转糖苷活性的氨基酸残基位点,即T180、T219、P236,如图6所示。将这3 个位点突变成为肠膜明串珠菌NRRL B1355氨基酸序列上所对应的T180A、T219V、P236S,并在此基础上进行累积突变,直至获得LMsp在180、219、236三个位点上的全部7 个突变体。
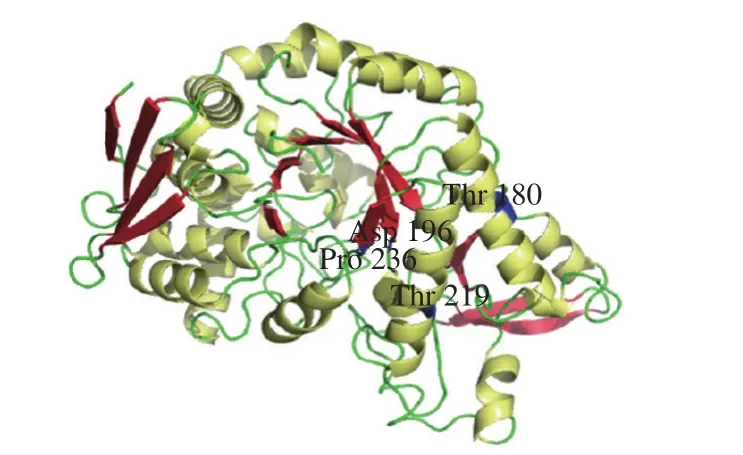
图6 LMsp突变位点的选择Fig. 6 Selection of mutation site in LMsp
2.4.2 突变体的获得与突变蛋白的表达纯化
用表1中引物,以pQE-lmsp为模板反向PCR扩增得到目的产物,将测序正确的突变质粒转入E. coliM15/pREP4中得到突变体。突变体经诱导表达并使用镍亲和层析纯化,纯化后的7 个突变蛋白分子质量大小一致,约为56 kDa,与预期大小相符。SDS-PAGE分析结果如图7所示。

图7 突变蛋白SDS-PAGE分析Fig. 7 SDS-PAGE analysis of purified mutant proteins
2.4.3 突变酶酶学性质
将所得突变体,按照1.3.3节中的酶活测定方法,对比野生酶LMsp结果如表3所示。突变酶的最适温度和最适pH值与野生重组酶LMsp相比变化不大,Km、Vmax值较野生酶相比变化明显。其中T180A的Km值为(77.74±5.671)mmol/L,比野生酶高出(43.58±4.452)mmol/L,提高了约1.28 倍,该突变体对蔗糖的亲和力降低最大。同时也得到了对于底物亲和力提高的突变体T219V-P236S。突变酶T180A的Vmax值((618.1±23.37) μmol/(min·mg))比野生酶高出(247.6±17.321)μmol/(min·mg),酶活力显著上升。而其余各突变酶的Vmax值与野生酶相比均有不同程度的下降,其中P236S、T180A-T219V、T180A-P236S及T219V-P236S的Vmax值与突变前相比下降幅度较明显,分别约为之前的60%、41%、63%和60%。
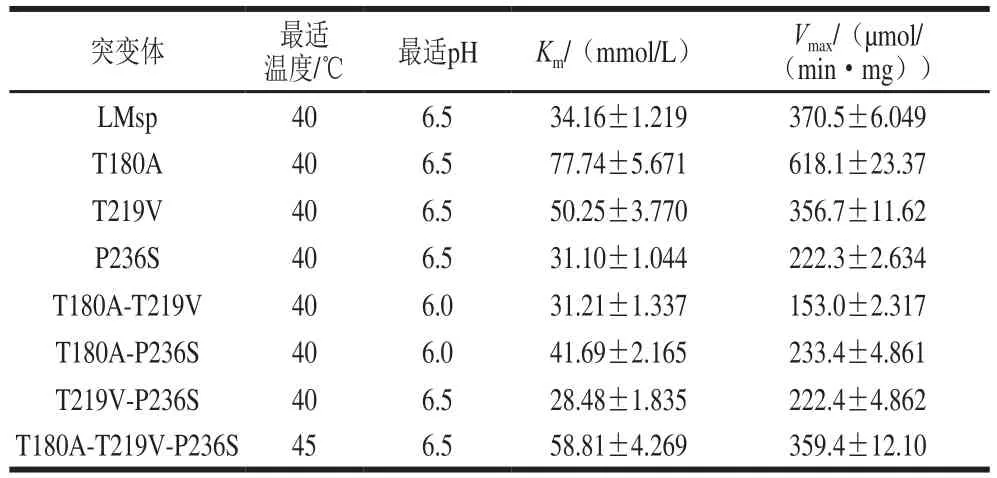
表3 突变体酶学性质测定结果Table 3 Enzymatic properties of mutants
2.4.4 突变体转糖苷功能
由表4可知,在以15%的葡萄糖-1-磷酸为供体,受体底物为5%糖类时,LMsp及其突变体对L-阿拉伯糖均有很高的转糖苷活性。与野生重组酶相比,突变酶T180A、P236S对L-山梨糖的转糖苷活性提高了约15%;T180A、P236S、T180A-P236S对L-阿拉伯糖的转糖苷活性基本不变;T180A、T219V、T180A-T219V对D-果糖的转糖苷活性基本不变;P236S、T219V-P236S对D-葡萄糖的转糖苷活性与野生酶基本一致;T180A、T219V-P236S、T180A-T219V-P236S对D-木糖醇的转糖苷活性基本不变;P236S对D-甘露糖,T219V对L-山梨糖的转糖苷活性同野生酶相当。除此之外,其他突变体对各受体底物的转糖苷活性都有不同程度的下降,甚至对部分底物失去活性。

表4 LMsp及突变体对底物的转化率Table 4 Conversion efficiencies of LMsp and mutants toward substrate
3 讨 论
本研究从肠膜明串珠菌ATCC 12291基因组中克隆得到了蔗糖磷酸化酶基因lmsp,并在大肠杆菌M15中成功实现了异源表达。目的酶蛋白分子质量大小约为56 kDa,最适温度为40 ℃,最适pH值为6.5,在25~40 ℃、pH 4.5~8.0条件下能保持酶活力稳定。Lee等[20]报道来自肠膜明串珠菌NRRL B1149的蔗糖磷酸化酶的最适温度为37 ℃,李群良等[21]测定来源于Bacillus megateriumNCIB 8508的蔗糖磷酸化酶最适温度为50 ℃,最适pH值为7.5,一定程度上表明不同来源的酶在酶学性质上表现有差异,这是在菌株需要不断适应外界环境而长期进化造成的。在以蔗糖为底物时Km为(34.16±1.219)mmol/L,Vmax值为(370.5±6.049)μmol/(mg·min)。LMsp对D-阿拉伯糖、L-阿拉伯糖、D-木糖醇、D-半乳糖、D-甘露糖、D-果糖、D-葡萄糖、L-山梨糖具有转糖苷活性。
为找到影响转糖苷反应的关键残基位点,以提高转糖苷活性,对其进行了分子改造。依据Morler等[22]的距离定义即:离活性中心距离超过10 Å即被认定为远距离位点。以青春双歧杆菌蔗糖磷酸化酶的3D结构为模板,建立了LMsp的蛋白质三维模型。并结合同源蔗糖磷酸化酶的氨基酸序列比对分析,选取了距离LMsp亲核试剂Asp 196位点10 Å以内的T180、T219、P236三个位点进行了定点及累积突变,获得了7 个近距离突变体。其中突变体T180A、P236S对L-山梨糖的转糖苷活性有所提高,对其他一些受体底物则出现了反向变化。
为解释性质改善的原因,经过分析发现,苏氨酸与丙氨酸相比,R基上多一个羟基和甲基,空间结构较复杂。脯氨酸是一种有着环状结构的亚氨基酸,其空间结构比丝氨酸更加复杂,空间位阻更大。因此当180、236位点上的苏氨酸和脯氨酸突变成为空间位阻较小的丙氨酸和丝氨酸时,酶的活性口袋更容易与底物相契合,使得酶对这些底物的转糖苷活性上升。突变体T180A、P236S对L-山梨糖的转糖苷活性均有所提高,而T180AP236S联合突变体对于山梨糖的活性却发生了降低,即多位点的相互叠加并不会把单点突变的优势叠加起来,反而造成了活性的减弱。结合建模分析,推测由于突变后氨基酸空间结构改变对相邻氨基酸产生了影响,酶的空间构象发生变化,造成了底物与酶在诱导契合过程中产生了阻碍作用。
为改善酶学特性,远距离突变的改造方案也曾被采用,并取得了一定成果。Whittle等[23]曾在距离活性中心19 Å的位置进行了突变,使酶活力增强了32 倍。Van Den Heuvel等[24]在距离活性中心远达32 Å的位置引入突变,使酶活力增强了4.2 倍。一定程度上表明了远距离的氨基酸变化可以通过一系列的接触传递到活性中心,从而影响酶活力。此外,基于蛋白质结构能量预测的方法也有很多成功的例子[25-27],能量最低化对于稳定蛋白性质及提高产物得率也是一个很好的方法。本研究丰富了蔗糖磷酸化酶资源的性质数据,获得了部分性质具有改善的突变酶,为进一步对于蔗糖磷酸化酶的分子改造提供了宝贵经验。
