融合型原肌球蛋白MBP-CTB-TM 构建及其口服致敏性评价
2019-10-29傅玲琳黄健健谢梦华王彦波
傅玲琳,黄健健,谢梦华,王 翀,王彦波*
(浙江工商大学食品与生物工程学院,浙江食品质量安全工程研究院,浙江 杭州 310018)
近几年来,食物过敏现象频发,有研究表明,过敏人群在逐渐增加,全球大约有8%的儿童和4%的成人有过敏症状,研究认为这与抗生素等药物使用以及环境等因素有关[1]。食物过敏是一种对食物蛋白质(即过敏原)产生的不良反应,主要有3 种介导方式,分为由免疫球蛋白E(immunoglobulin E,IgE)介导、非IgE介导以及IgE和非IgE混合介导,其中以IgE介导的食物过敏反应最为严重,其在短时间内会引发各类症状[2]。在食物过敏发生的过程中,T细胞十分重要,初始CD4+T淋巴细胞受抗原刺激后能够分化成Th1、Th2、Th9和Th17等几种细胞亚型,分化的细胞类型受抗原类型、抗原递呈细胞表以及细胞因子等共同作用,从而调节免疫过程[3]。Th17型细胞主要参与机体的自身免疫疾病与炎症的发生,其分泌的细胞因子IL-17A能诱导IL-6等炎症细胞因子聚集在炎症部位,从而导致组织破坏[4-5]。
目前,小鼠、大鼠、豚鼠、犬和幼猪等多种动物都被用于食物过敏实验研究,其中小鼠应用最广泛。常用的动物模型有腹腔注射过敏原模型与经口灌胃过敏原模型,后者能更好地反映生理状况,研究结果更加可靠。但由于口服食物蛋白易使机体产生耐受[6],故一般需要利用大剂量过敏原及黏膜佐剂。因此,部分研究者尝试采用原核表达过敏原代替天然蛋白用于食物过敏相关研究[7-10]。但在构建经口致敏模型时仍需要大量过敏原刺激且仍需依赖黏膜佐剂,因此并未解决根本问题。早期研究发现将黏膜佐剂与抗原进行化学偶联能够增强抗原的免疫原性[11-13],进一步将黏膜佐剂与抗原共同原核表达,也能够增强抗原的免疫原性,降低抗原使用剂量[14-15]。然而关于将黏膜佐剂与食物过敏原蛋白重组从而应用于构建动物致敏模型的研究却鲜有报道。因此,本研究拟通过原核重组表达技术,将黏膜佐剂与过敏原形成融合蛋白,应用于食物过敏动物模型的构建,并探索其优越性。
霍乱毒素(cholera toxin,CT)是口服致敏模型中最常使用的黏膜佐剂,能够增强小鼠Th2型免疫应答。CT是由霍乱弧菌所产生的毒素,由1 个A亚基(CTA)和5 个B亚基(CTB)组成AB5形式[14],其中CTB以五聚体形式存在,通过与肠上皮细胞表面GM1神经节苷脂结合而进入体内[16]。由于CT的毒性,导致其应用受到限制且中国海关限制进口,开发更安全的CT替代品将会大幅促进食物过敏研究。已有研究表明CT的两个亚基均能增强黏膜免疫,可单独作为黏膜佐剂使用,其中CTB由于无毒而应用性更为广泛[17-18]。例如在原核表达黏膜佐剂时,鉴于CT结构的复杂性及毒性,常选择单独表达无毒的CTB作为黏膜佐剂。但由于CTB的聚集性,单独表达CTB易形成包涵体而大大降低产量,故而有学者通过CTB与大肠杆菌周质中的分子伴侣——SKP蛋白共表达,促进CTB在原核表达时的溶解性[19]。
鉴于此,本研究采用原核表达中常用的促溶蛋白——麦芽糖结合蛋白(maltose-binding protein,MBP)[20-21]促进CTB的可溶性表达。利用E. coliStbl3工程菌进行分子克隆能有效降低错误重组,E. coliBL21菌株进行蛋白表达能够有效避免目的蛋白的降解。进一步用高效转染的HEK293T细胞系对融合蛋白的表达以及跨膜能力进行验证。基于此,本研究利用同源重组,将MBP、CTB以及增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)重组为融合蛋白MBP-CTB-EGFP,荧光探究MBP-CTB-EGFP能否跨越细胞膜,从而具有作为黏膜佐剂的潜力。此外用水产品中主要过敏原原肌球蛋白(tropomyosin,TM)构建MBP-CTB-TM,并将其从大肠杆菌原核表达获得的融合蛋白应用于动物致敏实验,探究融合蛋白的致敏性及其对小鼠食物过敏相关免疫反应的影响,探索其是否能降低过敏原使用剂量,从而替代天然蛋白进行TM相关的食物过敏研究。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
南美白对虾购买于杭州萧山养殖场;SPF级Balb/c小鼠采购并饲养于杭州师范大学实验动物中心,雌性,6~8 周龄,体质量为(20±2)g,共80 只,随机分组,每组10 只。
E. coliStbl3、E. coliBL21、HEK293T细胞均为本实验室保存菌株或细胞;pEX-4T-1-malE-egfp-10His、pEX-4T-1-malE-tm-10His均由本实验保存或构建,携带N-端malE促溶标签和10×His亲和纯化标签,malE、egfp和tm基因分别表达MBP、EGFP和TM蛋白,其中,tm基因由课题组前期研究根据南美白对虾基因组序列人工合成,并通过常规分子克隆替换pEX-4T-1-malE-egfp-10His中的egfp片段获得[22];pUC57-ctxB质粒由通用生物系统(安徽)有限公司合成,其中,ctxB为CTB蛋白的基因;聚合酶链式反应(polymerase chain reaction,PCR)涉及的所有引物由生工生物工程(上海)股份有限公司合成。
1.1.2 试剂
FastDigestNotI 美国Thermo Scientific公司;氨苄青霉素(ampicillin,Amp)、质粒提取试剂盒、Ni-NTA亲和柱、磷酸盐缓冲液(phosphate buffer saline,PBS)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)相关用品 生工生物工程(上海)股份有限公司;高保真PCR试剂盒(Phanta®Super-Fidelity DNA Polymerase)、同源重组试剂盒(Clon Express®II One Step Cloning Kit) 南京诺唯赞生物技术有限公司;50×TAE缓冲液 北京诺博莱德科技有限公司;喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒 江苏凯基生物技术股份有限公司;Goat Anti-Mouse IgG1-HRP、Goat Anti-Mouse IgG2a-HRP、Goat Anti-Mouse IgE-HRP 美国Southern Biotech公司;3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)美国eBioscience公司;RPMI-1640培养基 美国BD公司;胎牛血清FBS 美国Gbico公司;聚乙烯亚胺(polyethylenimine,PEI) 美国Polysciences公司;Bio-Plex ProTM小鼠细胞因子试剂盒 美国Bio-Rad公司;其他普通化学试剂均为分析纯。
1.2 仪器与设备
Mini protein III垂直板电泳仪 美国Bio-Rad公司;Alpha化学发光凝胶成像仪(配有ALPHAVIEW SA电泳图像分析软件) 美国Proteinsimple公司;VersaMax型酶标仪 美国Molecular Devices公司;台式冷冻高速离心机 美国Beckman Coulter公司;MLS-3750全自动高压灭菌锅 日本Sanyo公司;琼脂糖电泳仪 中国北京六一艾科仪器公司;普通PCR仪 美国Thermo Scientific公司。
1.3 方法
1.3.1 MBP-CTB-EGFP及MBP-CTB-EGFP融合蛋白的原核重组表达
1.3.1.1 高保真PCR扩增目的基因ctxB序列(含目的质粒NotI酶切位点同源序列)
根据高保真PCR试剂盒扩增pUC57-ctxB质粒中的ctxB序列(含目的质粒插入点同源序列)。反应体系:25 μL 2×Phanta Max Buffer(含Mg2+),1 μL dNTP Mix(10 mmol/L each),1 μL(约10 ng)模板DNA,上下游引物(10 μmol/L)各2 μL,1 μL Phanta Max Super-Fidelity DNA Polymerase(1 U/μL),18 μL ddH2O。上游引物:5’-ACAAGGACGACGATGACAAG-3’;下游引物:5’-TCCATTGCGCCGGCGCCTGC-3’。PCR程序:95 ℃、30 s预变性;95 ℃、15 s变性,61 ℃、15 s退火,72 ℃、45 s延伸,30 个循环;72 ℃、5 min。取部分扩增产物进行1%的琼脂糖电泳以检验扩增效果。
1.3.1.2 目的载体质粒线性化
根据FastDigestNotI试剂盒说明书配制反应体系:15 μL无核酸酶水,2 μL 10×FastDigest Buffer,2 μL(约1 μg)质粒DNA,1 μL FastDigestNotI。反应管放置到PCR仪中,37 ℃孵育30 min使环状质粒充分线性化,之后80 ℃加热5 min使酶失活。
1.3.1.3 PCR扩增产物和目的载体的同源重组
根据同源重组试剂盒说明书设计及配制反应体系:4 μL 5×CE II Buffer,3 μL线性化克隆载体,1 μLctxB扩增产物(含目的质粒插入点同源序列),2 μL Exnase®II,10 μL ddH2O。将反应管置于PCR仪中,设置37 ℃、30 min,再永久4 ℃保存,取出前保证反应液在4 ℃放置5 min以上。
同源重组反应产物转化、涂板:取5 μL冷却反应液,加入到50 μLE. coliStbl3感受态细胞中,弹管壁数下混匀,在冰上放置30 min。42 ℃热激45~55 s,冰水浴孵育2 min。加入1 mL LB培养基(无抗生素),37 ℃摇床孵育1 h,充分复苏。取100 μL菌液均匀涂布LB琼脂(含1‰ Amp)平板上。将平板倒置,于37 ℃培养16 h。培养后,从平板上挑取分散良好的单菌落接种到5 mL的LB肉汤(含1‰ Amp),于37 ℃培养16 h,再进行菌液PCR鉴定。挑选PCR正确的菌液送擎科生物有限公司测序,并对测序结果进行比对,选择最匹配的菌液按照质粒提取试剂盒说明书提取质粒pEX-4T-1-malE-ctxB-egfp-10His、pEX-4T-1-malE-ctxB-tm-10His并保存。
1.3.1.4 融合蛋白在E. coliBL21中的表达
将质粒pEX-4T-1-malE-ctxB-egfp-10His及pEX-4T-1-malE-ctxB-tm-10His分别转化到E. coliBL21菌液,并进行涂板,具体步骤同1.3.1.3节。挑取单菌落,转移至5 mL的LB肉汤(含1‰ Amp)中,37 ℃摇床培养16 h,获得原核表达工程菌。
按照工程菌液:新鲜LB肉汤(含1‰ Amp)为1∶100接入工程菌液,于37 ℃、200 r/min培养至OD600nm为0.6~1.0(约3 h)。在超净台中加入IPTG(终浓度为0.1 mmol/L),立即放置于16 ℃或37 ℃(MBP-CTBEGFP为16 ℃,MBP-CTB-TM为37 ℃),200 r/min培养16~24 h。然后将菌液在室温条件下4 000 r/min离心20 min,收集菌体,称质量。按照菌体湿质量与酶解液(含0.2 mg/mL溶菌酶,20 μg/mL DNase,1 mmol/L MgCl2,1 mmol/L PMSF)1∶30的比例加入酶解液,吹打使菌体悬浮,然后置于4 ℃裂解30 min;在冰浴、超声2 s-间歇5 s条件下,用超声破碎机将裂解液超声5 min,至液体颜色均一、无黏稠团聚物质。20 000×g离心20 min,收集上清液。沉淀重新加入酶解液重悬后再次20 000×g离心20 min,收集上清液,合并两次上清液,并用0.45 μm滤膜过滤。之后按照Ni-NTA亲和柱试剂盒说明书采用离心法对融合蛋白进行纯化,并将洗脱液置于PBS中透析24 h,中间更换3 次PBS。随后进行SDS-PAGE:配制12%的分离胶与5%的浓缩胶,厚度为1.0 mm。将溶于PBS的TM取出少量,与4×蛋白质SDSPAGE上样缓冲液混匀,置于沸水浴中加热5 min后取7 μL上样。浓缩胶电压120 V、10 min后,分离胶电压180 V、40 min。
1.3.1.5 MBP-CTB-EGFP重组蛋白细胞膜穿透能力验证
对照组将1 μg质粒、3 μL PEI和100 μL无血清DMEM培养基混合均匀,静置30 min后,均匀加入细胞,作用5 h后用显微镜观察。实验组取对数生长期的HEK293T细胞用胰酶消化后加入新鲜培养基,以每孔0.5 mL接种于24 孔板,培养1 d后,直接加入过0.22 μm滤膜的目的蛋白,终浓度为4 μmol/L,作用5 h后,用无菌PBS洗涤3 次,直接用荧光显微镜观察细胞。
1.3.2 Balb/c小鼠致敏模型
1.3.2.1 动物致敏实验方案
将小鼠饲养于温度(23±3)℃、湿度(50±10)%的无菌饲养间,喂食小鼠基础日粮。致敏处理开始前一周,按照标准实验动物普通饮食饲养方法饲养,小鼠自由进食饮水,每日下午更换饲料。CTB-TM致敏组每周连续3 d灌胃600 μg溶于200 μL PBS的MBP-CTBTM,连续3 周,使小鼠致敏。第5周采用更高剂量(1 500 μg)进行激发灌胃,1 周2 次,间隔4 d。PBS组每次灌胃与实验组等体积的PBS,CTB组每次灌胃与实验组等体积的含有CTB(250 μg)的PBS,TM组每次灌胃与实验组等体积的含有TM的PBS,免疫方案如图1所示。第2次激发后对小鼠采用内眦静脉丛采血,血液于37 ℃孵育1 h,再3 000 r/min、4 ℃离心10 min,取血清于新的EP管中,-80 ℃保存。取血后将小鼠处死,浸泡于75%乙醇溶液中,并在无菌超净工作台内解剖,取其脾脏。
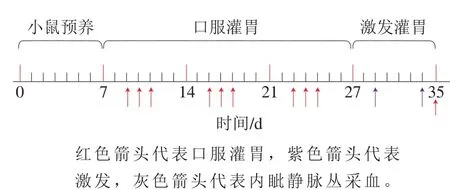
图1 小鼠免疫方案Fig. 1 Mouse immunization protocol
1.3.2.2 血清TM特异性抗体IgE、IgG2a、IgG1的测定
小鼠血清TM特异性抗体IgE、IgG2a、IgG1抗体反应均采用双抗体夹心间接ELISA法检测。EIA/RIA 96 孔板包被100 μL含10 μg/mL从天然虾中提取纯化的TM(具体提取方法参考傅玲琳等[23]),4 ℃孵育过夜;用PBS+0.05%吐温20洗涤3 次后,加入200 μL封闭液,37 ℃孵育1 h;洗涤3 次后加入100 μL稀释后小鼠血清样品(IgE 1∶6,IgG2a 1∶200,IgG1 1∶200),37 ℃孵育2 h;洗涤5 次后加入100 μL辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗(羊抗鼠IgG1-HRP、羊抗鼠IgG2a-HRP、羊抗鼠IgE-HRP),37 ℃孵育1 h;洗涤5 次后加入100 μL TMB底物,37 ℃避光孵育20 min后加入50 μL终止液,在450 nm波长测定各孔的OD值。
1.3.2.3 脾脏共培养上清液细胞因子的测定
无菌条件下取出脾脏后置于200 目筛上,加入少量PBS,用无菌注射器轻轻研磨脾脏,使细胞过目筛,然后再加入少量PBS洗涤目筛,收集所有滤液于15 mL无菌离心管中,经过红细胞裂解,PBS洗涤2 次后,用RPMI-1640培养基(含10%胎牛血清,1%青霉素及链霉素双抗)重悬细胞至106~107/mL。取1 mL加入12 孔板中,再加入已过0.22 μm滤膜的从虾肉中提取的天然蛋白TM(终质量浓度100 μg/mL),于37 ℃、5% CO2细胞培养箱中培养72 h,然后离心收集细胞上清液。细胞因子采用Bio-Plex ProTM小鼠细胞因子试剂盒进行检测,按照说明书进行操作。
2 结果与分析
2.1 pEX-4T-1-malE-ctxB-egfp-10His质粒构建
构建质粒pEX-4T-1-malE-ctxB-egfp-10His(图2A),利用荧光探究MBP-CTB-EGFP是否能跨越细胞膜,从而具有作为黏膜佐剂的潜力。如图2B所示,目的基因CTB片段克隆成功,条带单一整齐,无杂条带,效果较好。由图2C可知,菌落PCR克隆成功,条带位置单一,无杂条带,位置在1 000~1 500 bp,靠近1 000 bp,与ctxB-egfp(约1 100 bp)的大小符合,表明pEX-4T-1-malE-ctxB-egfp-10His成功构建。


图2 质粒pEX-4T-1-malE-ctxB-egfp-10His构建Fig. 2 Construction of plasmid pEX-4T-1-malE-ctxB-egfp-10His
2.2 pEX-4T-1-malE-ctxB-tm-10His质粒构建
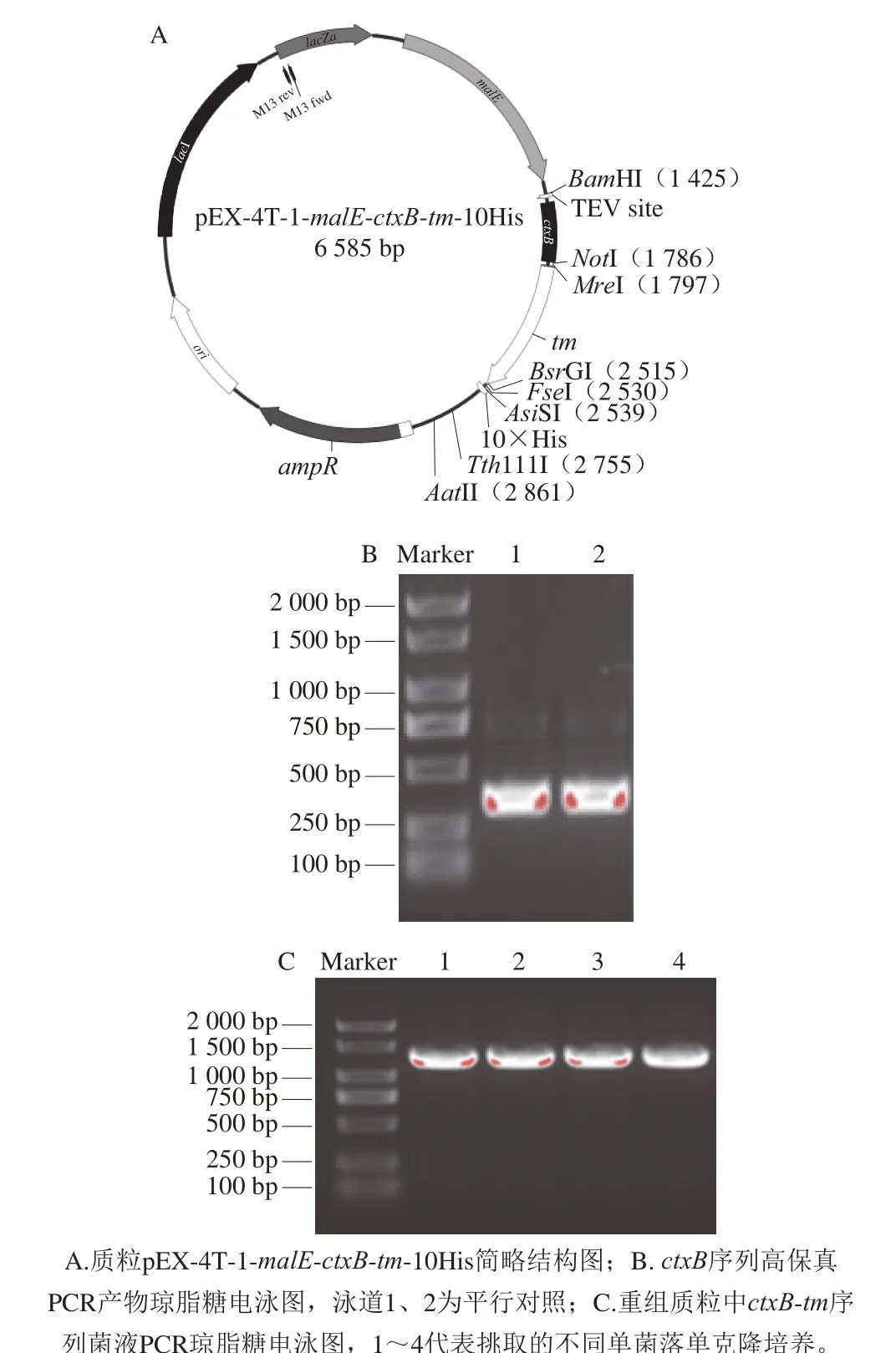
图3 质粒pEX-4T-1-malE-ctxB-tm-10His构建Fig. 3 Construction of plasmid pEX-4T-1-malE-ctxB-tm-10His
利用同源重组,将MBP、CTB以及水产品中主要过敏原TM重组为融合蛋白MBP-CTB-TM(图3A),并进行大肠杆菌原核表达获得大量目的蛋白以为后续动物模型构建奠定基础。由图3B可知,目的基因ctxB片段成功克隆,条带单一整齐,无杂条带,效果较好。由图3C可知,ctxB-tm片段菌落PCR克隆成功,条带位置单一,无杂条带,位置在1 000~1 500 bp,也与ctxB-tm(约1 200 bp)的大小符合。
2.3 重组蛋白MBP-CTB-EGFP及MBP-CTB-TM表达及纯化

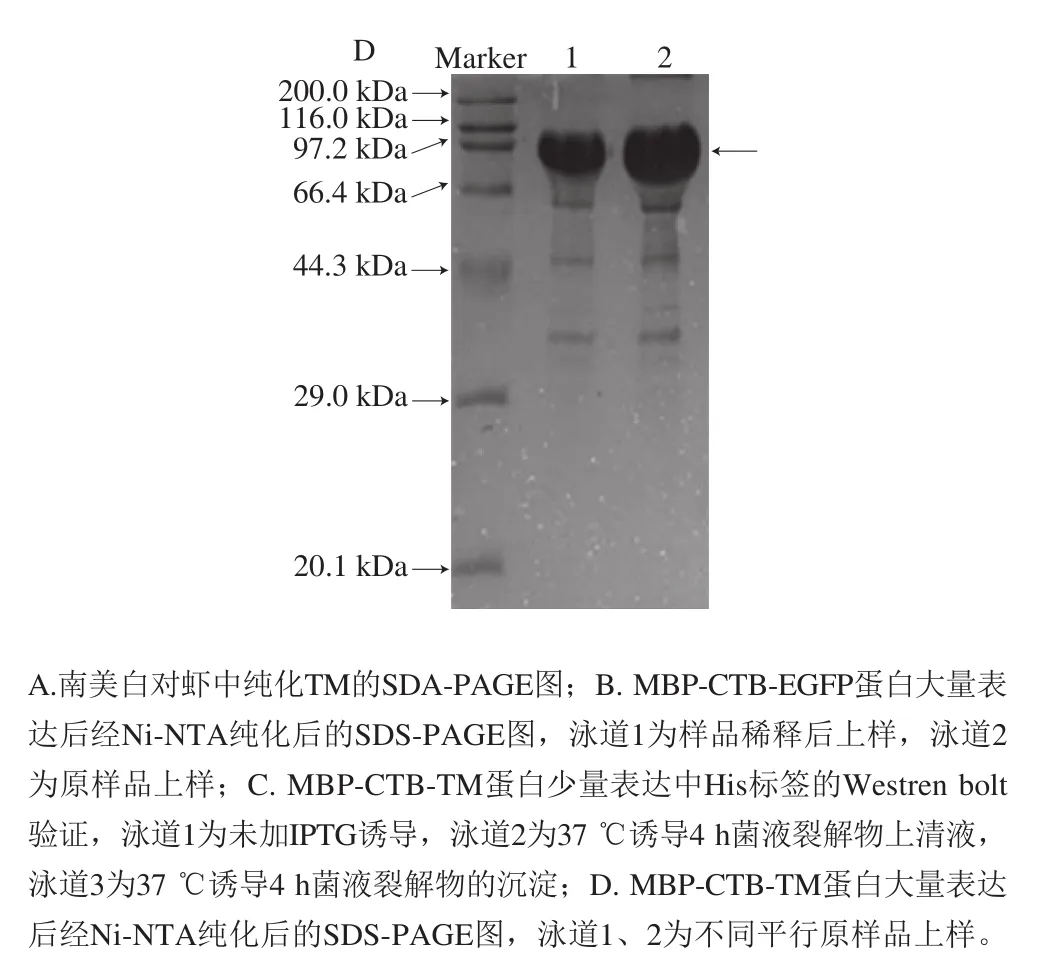
图4 融合蛋白MBP-CTB-EGFP与MBP-CTB-TM在E. coli BL21中的表达及纯化Fig. 4 Expression in E. coli BL21and purification of fusion proteins MBP-CTB-EGFP and MBP-CTB-TM
从南美白对虾中纯化天然TM作为对照,SDA-PAGE结果如图4A所示。利用大肠杆菌重组表达融合蛋白,由图4B可知,Ni-NTA纯化后MBP-CTB-EGFP融合蛋白纯度较高,杂蛋白较少,SDS-PAGE图只在上样量非常大时才显示有杂条带。由图4C、D的Western bolt和SDSPAGE结果可知,MBP-CTB-TM融合蛋白可在E. coliBL21中大量表达,且Ni-NTA纯化后可得高浓度且纯度较高的融合蛋白MBP-CTB-TM。经过蛋白含量测定,MBP-CTB-EGFP和MBP-CTB-TM在大肠杆菌的表达量在50~80 mg/L培养液。且原核表达获得的融合蛋白较从虾肉中提取天然蛋白TM的方法,实验操作耗时短,毒性低,蛋白得率更高[24]。
2.4 MBP-CTB-EGFP重组蛋白细胞膜穿透能力验证
将融合蛋白与细胞共同孵育,利用EGFP的荧光效果,使用荧光显微镜观察融合蛋白MBP-CTB-EFGP能否进入细胞,因此验证其是否具有作为黏膜佐剂的潜力。如图5可知,MBP-CTB-EGFP融合蛋白确实可穿过HEK293T细胞的细胞膜进入到细胞内,说明MBP-CTBEGFP在原核表达后仍具有作为黏膜佐剂的能力,从而促进外源蛋白进入细胞内。此外,通过与MBP-CTB-EGFP基因利用转染进入细胞相比,MBP-CTB-EGFP融合蛋白携带外源蛋白进入细胞的效率更高。
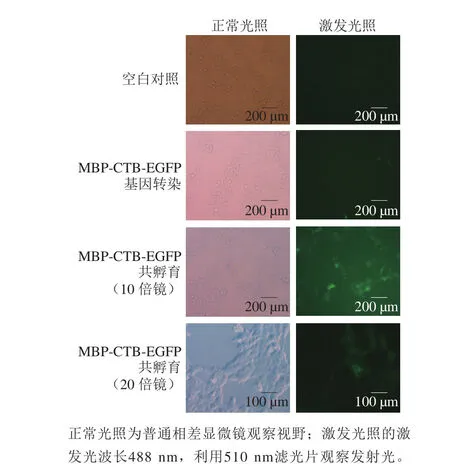
图5 MBP-CTB-EGFP融合蛋白跨越细胞膜能力验证Fig. 5 Verification of the ability of MBP-CTB-EGFP fusion protein to cross cell membrane
2.5 融合蛋白MBP-CTB-TM对小鼠血清中TM特异性抗体的影响

图6 小鼠血清中TM特异性IgE(A)、IgG1(B)、IgG2a(C)含量变化Fig. 6 Levels of TM-specific IgE, IgG1 and IgG2a in serum samples of mouse model
食物过敏主要由IgE介导,致敏机体摄入过敏原后,过敏原会迅速与致敏肥大细胞或嗜碱性粒细胞表面的特异性IgE结合,使肥大细胞或嗜碱性粒细胞脱颗粒,释放组胺、白三烯、IL-4等炎症因子,从而产生过敏反应组织特异性症状[25]。此外,大量研究表明,食物过敏的发生与体内Th1/Th2细胞平衡偏向于Th2细胞反应相关[26],其中Th2型细胞因子促进IgG1、IgE的分泌,而Th1型细胞因子则促进IgG2a的分泌[27-28]。由图6可知,融合蛋白MBP-CTB-TM免疫小鼠后,血清中均能检测到高水平的TM特异性IgE、IgG1、IgG2a,初步表明融合蛋白MBP-CTB-TM确实可替代蛋白使小鼠产生TM特异性的抗体反应。由图6A可知,天然蛋白TM组与对照组IgE相比无明显差异,但能诱导IgG产生,说明此剂量的蛋白引起口服免疫耐受而无法引起小鼠的过敏反应,若引起过敏反应需要更高剂量的TM。融合蛋白MBP-CTB-TM免疫小鼠,TM特异性IgE的相对含量(OD450nm)达到0.4,与实验室前期用天然蛋白获免疫小鼠后的0.05相比[22]增加近8 倍,表明融合蛋白MBP-CTB-TM致敏效果更好,有可能达到降低过敏原用量的效果。此外,由IgG1和IgG2a的相对含量(OD450nm)可知,虽然两者融合蛋白MBP-CTB-TM组相对于对照组而言均显著提高,但IgG1水平明显高于IgG2a,表明融合蛋白提高整体炎症水平并导致体内Th1/Th2免疫反应不平衡。而MBP-CTB-TM组与TM组性比IgG1相对含量(OD450nm)无较大差别,且MBP-CTB-TM组IgG2a略低于TM组,说明融合蛋白在致敏后的抗体反应中偏向于Th2型反应。
2.6 融合蛋白MBP-CTB-TM对小鼠脾脏细胞培养上清中细胞因子质量浓度的影响
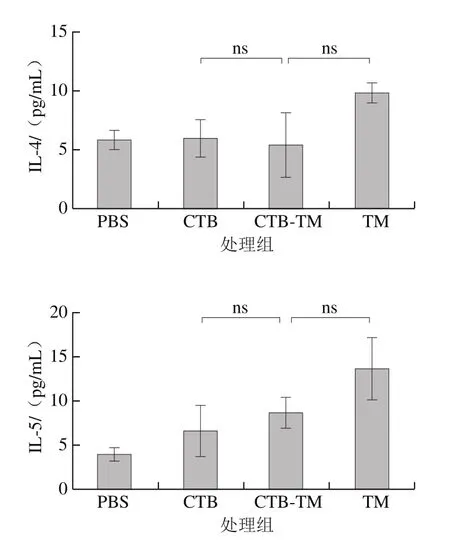
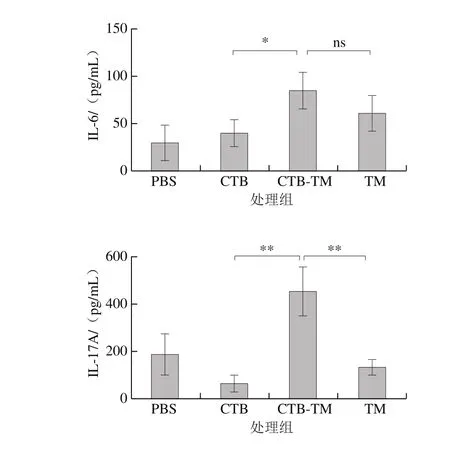
图7 小鼠脾脏细胞培养上清中细胞因子的质量浓度Fig. 7 Cytokines concentrations in culture supernatant of spleen cells of two Balb/c mouse models
研究证实食物过敏的发生与体内Th1/Th2细胞平衡偏向于Th2细胞反应相关。也有研究表明,Th17型细胞反应主要与自身免疫疾病有关,与食物过敏的发生也存在相关性,当食物过敏反应发生时,机体会诱导产生强烈的Th17型免疫应答并释放大量IL-17、IL-6和IL-23等炎性细胞因子[29-30]。由2.5节IgE、IgG1、IgG2a水平变化,可以初步看出致敏小鼠体内Th1/Th2免疫反应偏向Th2,但是,由图7可知,MBP-CTB-TM组中小鼠脾脏细胞培养上清中Th2型细胞因子IL-4、IL-5并没有显著上升且都低于TM组,而Th17型细胞因子IL-6、IL-17A显著上升且都高于TM组,且IL-17A的质量浓度比TM组显著增加,说明融合蛋白MBP-CTB-TM比天然蛋白TM更易于促进Th17型反应的发生,这表明融合蛋白MBP-CTB-TM虽可减低过敏原剂量且致敏小鼠,并使其产生TM特异性的抗体反应,但其致敏机理可能与天然蛋白存在差异,将其代替天然蛋白应用于食物过敏相关研究仍需谨慎,需根据实验目的慎重选择。
3 结 论
近年来,随着生活水平的提高,人们对甲壳类水产品例如虾的消费也逐渐增加,相关食物过敏问题的报道逐渐增加[31-32]。但大多数相关研究利用从虾中直接提取纯化得到TM作为过敏原开展实验,此过程实验耗时长,蛋白得率低,结果不稳定。本研究将MBP-CTB-EGFP、MBP-CTB-TM两个重组蛋白在E. coli BL21中表达,重组蛋白表达量高,易于提取,不受季节影响,为后续采用重组蛋白构建食物过敏动物模型的研究提供了实验材料,有望减少抗原的使用量,缩短口服致敏模型构建及机理研究的前期准备时间。然而值得注意的是,原核重组表达的融合蛋白与多数真核过敏原相比,其致敏机理可能存在差异,故重组蛋白是否具有黏膜佐剂和过敏蛋白的作用,并产生1+1>2的效果仍是未知,需进一步验证。此外,本研究发现重组蛋白能导致Th17型细胞因子IL-6、IL-17A显著上升,因此推测,其可能能够作为研究Th17型疾病的有力工具。
