脂质体水凝胶结构变化与形成机理
2019-10-29刘玮琳孔有余许贤康郑凌艺柳叶霏韩剑众
刘玮琳,孔有余,许贤康,郑凌艺,柳叶霏,韩剑众*
(浙江工商大学食品与生物工程学院,浙江 杭州 310018)
脂质体是由双亲性分子自组装形成的运载体系,具有高稳定性[1]、靶向性[2]、生物相容性[3]和缓释性[4]等优点,已在食品、生物、医学、农学等领域有广泛应用[5-7]。近年来,脂质体逐渐在食品领域崭露头角,用以保护敏感性功能成分的稳定性或提高生物利用率[8-10]。水凝胶是介于固体与液体间的一种半固体结构体系,具有高分子网络状结构[11-12]。其中,互穿聚合物网络结构(interpenetrating polymer network,IPN)[13]作为水凝胶的一种,存在化学交联点使其在大部分溶剂中只能溶胀而不溶解,不发生蠕变和流动,从而有更好的黏接力[14-15]。水凝胶既可以作为一种食品,又可利用其缓释性作为一种营养强化剂[16]。
脂质体水凝胶是一种通过物理或化学交联的方式将脂质体与凝胶结合,从而提高脂质体包封能力和缓释作用的新型运载体系。Ditiaio等[17]在20世纪90年代开始了脂质体水凝胶的研究,在医用硅胶中植入抗生素的脂质体水凝胶减少术后恢复的细菌感染率,与Gao Weiwei等[18]将包埋抗菌药物的脂质体水凝胶能抵抗金黄色葡萄球菌感染相验证。但是,当前脂质体水凝胶的应用主要集中在药学和材料学领域,而在食品中仅见如包埋白藜芦醇以提高其释放效率的报道[19],脂质体水凝胶运输其他活性成分及在消化道的降解研究鲜见。
综上所述,本实验采用涂层法制备脂质体与IPN胶交联构建脂质体水凝胶并表征其物化性质(粒径、质构、微观形貌);以膨胀系数、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)、差热分析和交联率探求两者间的交联机理和脂质体在水凝胶的包埋方式,为脂质体水凝胶应用到食品领域提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
卵磷脂、壳聚糖 美国Sigma公司;明胶、Hepes、氯化钠 上海阿拉丁生化科技股份有限公司;转谷氨酰胺酶(microbial transglutaminase,mTG) 泰兴市一鸣生物制品有限公司;磷测试盒 南京建成生物工程研究所。
1.2 仪器与设备
D11971型超纯水系统、Multiskan Spectrum全波长酶标仪 美国Thermo Scientific公司;Sorvall BiofugePrimo R型高速冷冻离心机 美国Kendro公司;TA.XT Plus型组织分析仪 德国IKA公司;SW22型振荡水浴槽 德国Julabo公司;pH计 梅特勒-托利多仪器(上海)有限公司;MS3000型激光粒度分析仪 英国Malvern公司;Nicolet FTIR成像系统美国热电公司;DTA-800差热分析仪 上海研锦科学技术有限公司。
1.3 方法
1.3.1 脂质体的制备
采用涂层法[20],将高质量浓度的磷脂溶液均匀涂在聚四氟乙烯板上,并放置在培养皿中,在55 ℃条件下用Hepes(0.05 mol/L、pH 5.5)溶液进行浸没洗膜,避光密封处理,获得磷脂质量浓度为50 mg/mL的脂质体。
1.3.2 脂质体物化性质的测定
采用动态激光粒度仪测量脂质体的平均粒径和表面电位。取1 mL脂质体用纯水稀释至10 mL,混匀后取样放入样品池中进行测定,测定条件为20 ℃,磷脂和分散介质的折射率的比值为1.120。每个样品至少平行测定3 次。
通过透射电子显微镜表征脂质体微观形貌。用蒸馏水将脂质体稀释至1 mg/mL,将样品滴加到铜网,而后用醋酸双氧铀溶液(2%)染色4 min,用滤纸吸去多余的液体后,在室温条件下晾干,用透射电子显微镜表征其微观结构。
1.3.3 脂质体水凝胶的制备和物化性质分析
1.3.3.1 水凝胶的制备
明胶在55 ℃条件下用超纯水溶解(6 g/100 mL),壳聚糖用1%的冰乙酸溶液溶解(3 g/100 mL)。分别将明胶与壳聚糖的质量比按1∶4、1∶2、1∶1、2∶1、4∶1进行混合,与55 ℃恒温振荡混匀,30 min后分别加入质量浓度为0、0.1、5、10、50 mg/mL的mTG,继续55 ℃恒温振荡60 min,取出冰浴快速冷却至出现固体的凝胶,于KCl(0.01 mol/L、pH 5.5)溶液浸没2 h,取出4 ℃静置过夜。
1.3.3.2 脂质体水凝胶的制备
水凝胶的制备按1.3.3.1节方法进行,其中在mTG之后再迅速加入脂质体溶液,使脂质体在凝胶中的最终质量浓度为12.5 mg/mL。
1.3.3.3 脂质体水凝胶的外观形貌
对不同配方脂质体水凝胶进行外观拍照。
1.3.3.4 脂质体水凝胶的质构分析
将不同配方的脂质体水凝胶低温(4 ℃)保存过夜后进行硬度、黏性及回复力等质构特性测定,选择质地剖面分析(texture profile analysis,TPA)模式,具体参数为:探头P/25,压缩比30%,测前、测中和测后速率均1 mm/s,测定停留时间5 s,触发力5 g,每组样品做多次平行实验[21-22]。脂质体水凝胶的TPA2采用硬度、弹性和咀嚼性表征,其中,硬度指的是第1次压缩样品时的最大压力峰值,感官上代表了用牙齿咬断样品时所需的力;弹性指两次穿刺样品高度的比值,反映了除去外力后样品形变的恢复量;回复力指两次穿刺后抵抗外界破坏所需的能力。
1.3.4 脂质体水凝胶结构的形成机理
1.3.4.1 脂质体水凝胶的膨胀系数
采用Cui Li等[13]的方法。将脂质体水凝胶平均切成15 mm×15 mm×10 mm长宽高的比例,切好的小块凝胶静置在Hepes溶液中(0.05 mol/L、pH 5.5、37 ℃),在不同时间间隔取出凝胶样品,用干燥滤纸吸干外表面的水珠,称质量。膨胀系数计算如式(1)所示:
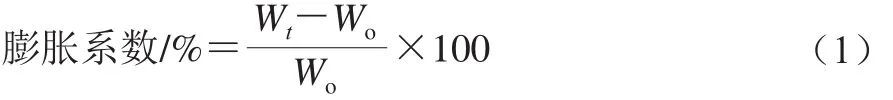
式中:Wt为在t时间点的吸水膨胀的样品质量;Wo为初始样品的质量。
1.3.4.2 脂质体水凝胶FTIR分析
称取经过冻干处理后的脂质体、空白水凝胶(不加脂质体)和脂质体水凝胶样品,与干燥处理过的KBr粉末按照1∶100的比例在研钵中充分研磨压片,以空气为背景采集FTIR谱图,设置扫描次数为64 次,在4 000~400 cm-1波数范围内全波段扫描分析。
1.3.4.3 脂质体水凝胶的差热分析
每个铝盘里封装2~6 mg的经过冻干处理后的脂质体、空白水凝胶和脂质体水凝胶样品,使用DTA-800差热分析仪进行分析,装有脂质体的铝盘作为空白对照组。所有的铝盘都需要放在密室中,在30 ℃保持5 min,以10 ℃/min的速率从30~400 ℃快速升温,氮吹的速率为20 mL/min。
1.3.4.4 脂质体水凝胶的交联率
采用Cui Li等[13]的方法进行测量。所需溶液配制如下:溶液I:将1.05 g的柠檬酸溶解在10 mL(0.1 mol/L)的NaOH溶液中,再混合0.04 g的SnCl2·H2O,用去离子水稀释到25 mL;溶液II:1 g的尼京平溶解在25 mL乙二醇溶液;标溶液III:将溶液I与溶液II进行混合,磁力搅拌45 min并存于暗室。凝胶前处理需冷冻干燥24 h。测量前,1.5 mg的冻干样品混合2 mL的溶液III在100 ℃水浴加热20 min,快速冷却至室温,用15 mL的50%异丙醇溶液稀释,分光光度计在570 nm波长处记录其吸光度。凝胶交联率的计算如式(2)所示:
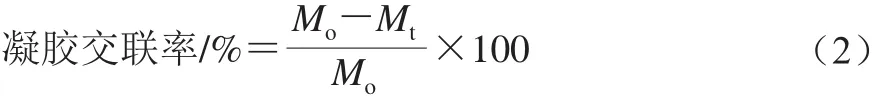
式中:Mo为未交联样品中自由氨基酸的摩尔分数;Mt为交联样品中自由氨基酸的摩尔分数。
1.4 统计分析
每项指标均至少重复测量3 个平行样品,并设置相应的对照组。采用Microsoft Office Excel 2007和Origin 8.5软件进行数据整理和分析。
2 结果与分析
2.1 脂质体的物化性质
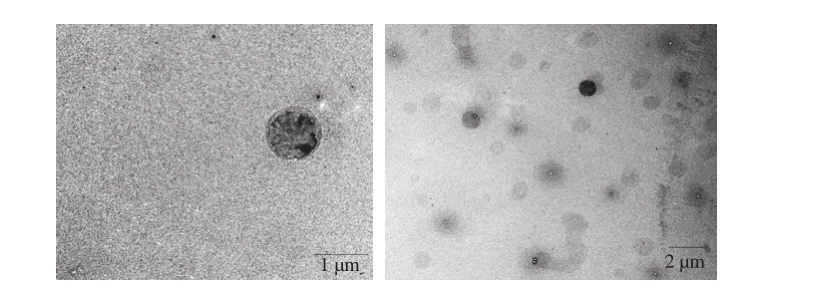
图1 脂质体在电子显微镜下的微观“囊泡状”结构Fig. 1 Transmission electron micrographs of liposomes
由图1可知,脂质体形状规整,呈囊泡状结构,分布较均匀,颗粒间彼此分散、独立。通过动态激光粒径电位仪测得脂质体平均粒径为(1 353±141.0)nm,表面电位为(-0.72±0.49)mV。由于本实验采用涂板薄膜分散制备脂质体,属于自发膨胀的自组装而成,未进行二次高压力或者高剪切处理,其形状结构完整、粒径较大;且该脂质体带电荷少,电位偏中性。粒度仪测量所得粒径值与透射电子显微镜观察结果基本相符。
2.2 脂质体水凝胶物化性质
2.2.1 脂质体水凝胶的外观形貌

图2 脂质体水凝胶的形态图Fig. 2 Visual appearance of lips-in-gels
判断凝胶的形成采取最直观的倒置分析法,如图2所示。对于能稳定成胶的样品,其物理结构会形成稳定的固体或半固体形态,能够保持基本的“站立”状态,所以在进行倒置时,胶体不容易坍塌或流动。图2A中,明胶与壳聚糖比例为4∶1和2∶1形成的胶,倒置状态下均保持非常稳定的固体状态,Cui Li等[13]认为二者可能是通过共价键结合在一起。在1∶1和1∶2的比例中,其胶的结构发生了坍塌,有一定的流动性,而1∶4比例则明显不具备胶的半固体状态,基本不能成胶,图2B、C分别为不同质量浓度的mTG制备的水凝胶(明胶与壳聚糖的比例为4∶1)和加入了脂质体的水凝胶与空白水凝胶的对比,其中mTG是一种良好的交联剂。图2B中5 种水凝胶均可以保持稳定的“站立”状态,均呈现胶的基本结构,图2C水凝胶中添加了脂质体之后同样也很好地保持了胶的固体形状。
2.2.2 脂质体水凝胶的质构分析
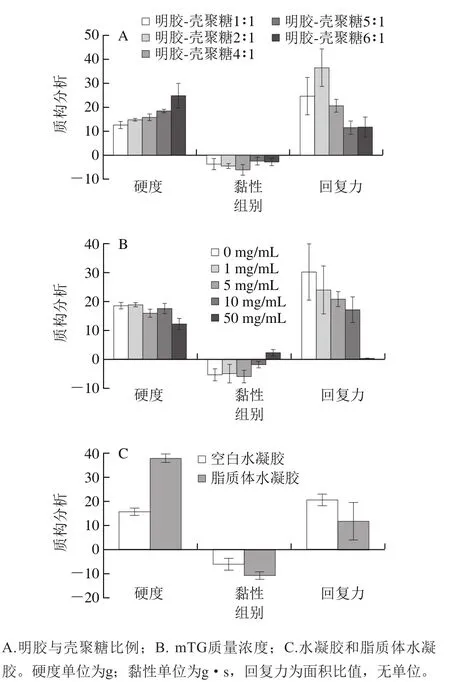
图3 水凝胶的硬度、黏性和回复力质构指标Fig. 3 Hardness, adhesiveness and resilience of hydrogels
由图3A得出,随着明胶比例增高,水凝胶的硬度也逐渐增大;在壳聚糖比例大于明胶时,无法成胶,故不计算其质构系数。当明胶与壳聚糖比例为4∶1时,脂质体水凝胶的耐咀嚼性为最优。回复力在整个体系中呈现抛物线形态,在明胶与壳聚糖比为2∶1时出现峰值。综合各质构结果,采取明胶与壳聚糖比4∶1为后期实验的制胶比例。从图3B可以看出,当mTG质量浓度为10 mg/mL时,其成胶稳定性最好,硬度重复性最强,硬度达到了18.68 g;当mTG质量浓度高于10 mg/mL时,4 ℃过夜贮存出现大量脱水的现象,因此本研究选择mTG质量浓度为10 mg/mL。图3C为脂质体水凝胶与空白水凝胶的质构对比,脂质体水凝胶的硬度和黏弹性相较未添加脂质体的水凝胶有很大的提升,可能是因为凝胶内部充斥着大粒径的脂质体囊泡,使其胶的空间结构得到支撑,从而提高了胶的硬度[23]。
2.3 凝胶结构的形成机理
2.3.1 脂质体水凝胶的膨胀系数
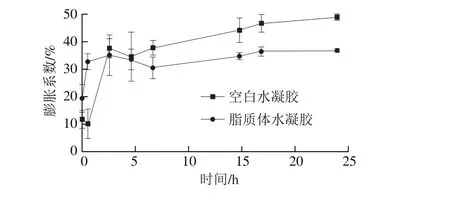
图4 空白水凝胶和脂质体水凝胶在KCl溶液(pH 5.5、0.01 mol/L)中的膨胀系数Fig. 4 Swelling behaviors of hydrogels and lips-in-gels in KCl solution(pH 5.5, 0.01 mol/L)
由图4可知,脂质体水凝胶和空白水凝胶的膨胀系数都是呈上升趋势,与之前文献报道水凝胶浸没于相同pH值条件下的离子溶液中都是出现了吸胀的属性相符[24]。在0~3 h之间,两者都是极快吸水膨胀,3 h后两者都出现轻微的脱水;但在7~24 h之间,空白水凝胶和脂质体水凝胶又呈现稳定的膨胀过程,但是此吸水能力相较之前的快速吸水发涨能力略有下降,说明两种胶之间的网状空洞结构基本都被水分子填满,特别是脂质体水凝胶在18 h之后,质量基本保持平稳不变。但是,空白水凝胶的膨胀能力比脂质体水凝胶更强,可能是在这段时间里空白水凝胶仍具备一定能力的吸水膨胀,而脂质体水凝胶中的网状结构已经被脂质体的囊泡结构所填满,其空间结构已经基本接近饱和,无法携带更多的水分子。
2.3.2 脂质体水凝胶FTIR分析
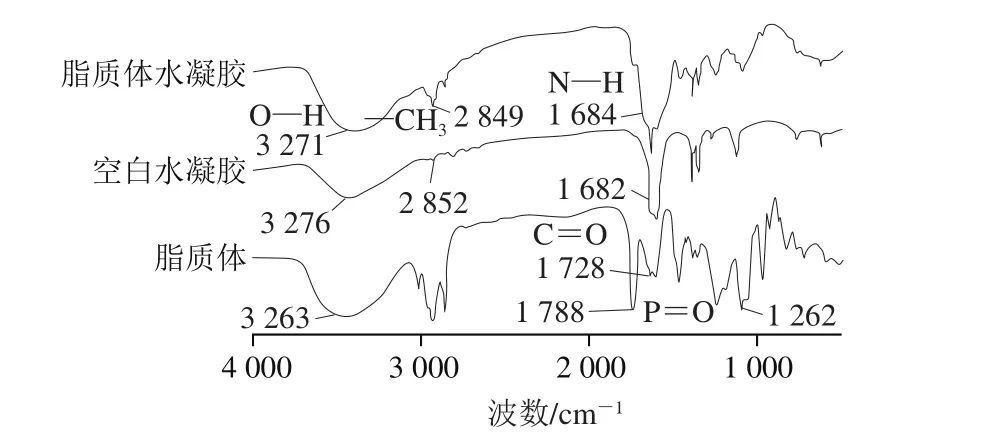
图5 脂质体、空白水凝胶和脂质体水凝胶的FTIR图Fig. 5 FTIR spectra of liposomes, hydrogels and lips-in-gels
由图5可知,壳聚糖与明胶构成的空白水凝胶的FTIR图谱在3 276 cm-1处形成了明显的—O—H伸缩振动吸收宽锋,在1 682 cm-1处出现了壳聚糖酰胺N—H伸缩振动吸收峰,这两个特征峰都同时在脂质体水凝胶中出现相同的峰位置,说明相应的功能基团都在脂质体水凝胶中出现。脂质体水凝胶中在2 849 cm-1出现了较大吸收峰,但空白水凝胶在此未明显观察到吸收峰,主要因为脂质体壁材中的磷脂CH2基团的对称和非对称吸收峰的介入。磷脂结构中的C—C—N+、C=O、P=O和P—O—C的伸缩振动吸收峰分别是960、1 740、1 220、1 090 cm-1,相比于脂质体,脂质体水凝胶中C=O吸收峰缺失,可能是由于水凝胶中mTG的氨与其交联形成胺基所致[25-26]。在这之后脂质体的相关特征吸收峰在水凝胶上形成峰位移,可能是由于明胶和壳聚糖中的杂环与磷酯通过氧激进诱导聚合和脱氢形成了杂环交联化合物[27]。在整个由溶液状的脂质体与水凝胶混合冷却形成的固态脂质体水凝胶过程中,是形成了一系列复杂的化学交联反应,脂质体还可能通过氢键的关系与之联结[27]。
2.3.3 脂质体水凝胶的差热分析
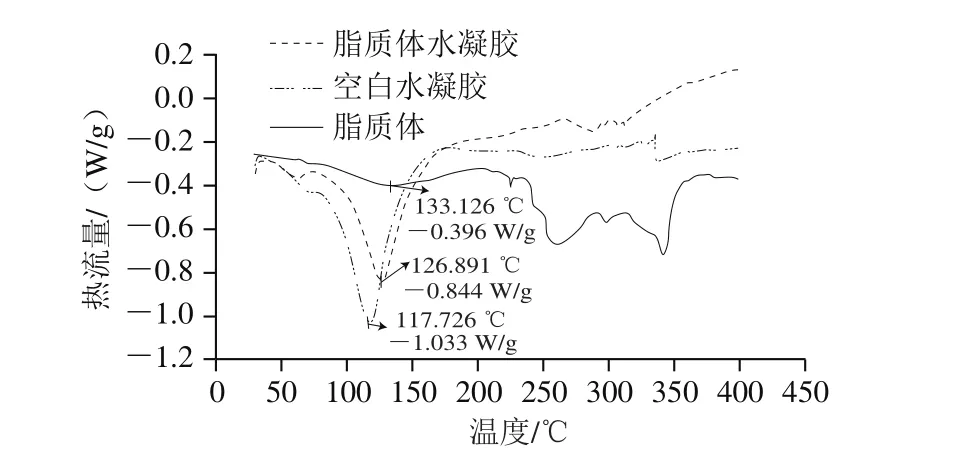
图6 脂质体、空白水凝胶和脂质体水凝胶的差热分析Fig. 6 DSC spectra of liposomes, hydrogels and lips-in-gels
从图6可知,脂质体、空白水凝胶和脂质体水凝胶在高温下均为吸热反应,且最大的吸热峰均在不同位置,分别对应的是133.126、117.726 ℃和126.891 ℃。脂质体本身由磷脂组成,水凝胶的形成为蛋白和多糖通过mTG交联,若为物理交联的胶,其本身没有重新产生化学键而是通过静电吸附形成;而脂质体水凝胶应出现两个吸热峰,各自对应磷脂和蛋白多糖交联的部分;但从图6可以看到,脂质体水凝胶只出现1 个大吸热峰,说明两者已经产生了一定程度的化学交联,推测可能是mTG中的氨与C=O形成了胺基,杂环与磷酯键通过复杂的交叉反应诱导聚合,以及出现了氢键的原因[28]。脂质体水凝胶在250 ℃后出现了2 个小峰,而脂质体差热曲线也均含有这2 个峰,但空白水凝胶却没有此现象,这也从另一个角度证实了水凝胶确实包埋了脂质体。
2.3.4 脂质体水凝胶的交联率
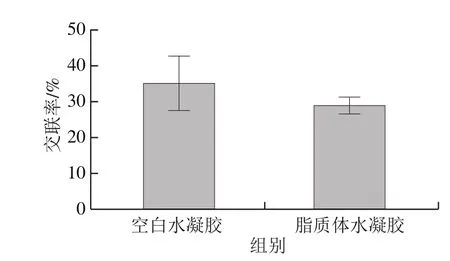
图7 空白水凝胶和脂质体水凝胶的交联率Fig. 7 Cross-linking degrees of hydrogels and lips-in-gels
交联率根据其中存在的自由氨基酸的比值进行计算[13]。空白水凝胶和脂质体水凝胶有蛋白和多糖的结构,而脂质体由磷脂组成。由图7可以分析,空白水凝胶和脂质体水凝胶均检测出自由氨基酸含量,且脂质体水凝胶的交联率比空白水凝胶低。本研究使用的水凝胶由壳聚糖和明胶通过mTG交联形成,一部分的羰基和氨基形成胺基,杂环上的不稳定二价键通过共价破坏与磷酯形成交叉反应,所以整个水凝胶的自由氨基酸比例有所降低,交联率也随之降低,该结果与前面实验所得对应。
3 结 论
本实验通过研究不同条件形成的水凝胶的物化性质及包埋了脂质体的水凝胶性质,选择最优配方的同时,阐析了脂质体与水凝胶的相互交联机制。实验最终选取明胶与壳聚糖比4∶1、mTG质量浓度10 mg/mL为最优条件,此配方下质构表现最优。相较空白水凝胶,脂质体水凝胶的膨胀系数更小,是由于脂质体水凝胶中的网状结构已经被脂质体的囊泡结构所填满,其空间结构已经基本接近饱和;同时,FTIR和差热分析显示脂质体中的C=O、P=O键与空白水凝胶中的氨和杂环形成胺基和其他复杂结构,而交联率也同时证明了脂质体与水凝胶之间的交联是通过化学交联的方式,破坏了一系列的官能团产生了复杂的共价键和氢键。本研究为脂质体水凝胶应用于食品消化和营养因子的缓释作用提供了理论参考,也可为开发脂质体水凝胶的营养食品提供技术参考。
