硫氧还蛋白促进人胰岛素样生长因子-1在大肠杆菌中高效可溶表达
2019-10-29万爱妮徐栋生蔡燕飞李华钟
万爱妮,徐栋生,蔡燕飞,陈 蕴,金 坚,李华钟*
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 药学院,江苏 无锡 214122)
胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)是含有70个氨基酸的碱性多肽,也被称为生长激素介质/促生长因子(somatomedins C),是一种结构上与胰岛素类似的活性多肽[1],主要由肝脏产生和分泌[2]。IGF-1参与多种细胞生物效应,是细胞的重要增殖调控因子,对生长和分化有重要作用,并影响蛋白质、碳水化合物和脂质代谢[3]。IGF-1还具有胰岛素代谢效应[4],能增加组织对胰岛素敏感性[5],可作为胰岛素抵抗糖尿病治疗的有效替代药物。对治疗1型、2型糖尿病有重要作用。研究发现,IGF-1在生长迟缓、神经损伤、糖尿病等疾病的治疗中有广阔的应用前景[6]。
血液中IGF-1主要以无活性的复合物形式存在(>95%),有活性的游离IGF-1含量很低,所以无法从血清中大量提取天然IGF-1,从而限制了其研究和治疗的应用[7]。应用基因工程技术,可以获得大量的有生物活性的外源蛋白,为基础研究和临床应用提供新途径。国内外已有很多通过哺乳动物细胞[8-9]、毕赤酵母[10]及大肠杆菌[11-13]等表达系统获得IGF-1的研究,哺乳动物细胞和酵母表达系统,具有较强的翻译后修饰功能,适合真核生物基因表达,但存在发酵成本高、表达量低、分离纯化困难等问题。
IGF-1相对分子质量较小、不稳定,在大肠杆菌中表达时,易被蛋白酶降解,且表达产物大多以包涵体形式存在,生物活性严重受损。研究表明,载体标签蛋白部分对IGF-1的原核表达起主要作用[14-15],选择合适的载体对表达外源基因并获得有生物活性的目的蛋白具有重要意义。我们探究了多种原核表达载体对IGF-1在大肠杆菌中表达的影响,构建9 种重组载体,分别转入 BL21(DE3)、Rosetta(DE3)和C43(DE3)等3种表达菌株中。IPTG诱导表达结果表明,IGF-1在携带标签蛋白Trx的pET32a载体上高效可溶表达(C43),在其他载体中一部分不表达(如pET20b-IGF-1),一部分则以包涵体形式表达(如 pET30a-IGF-1)。
为探究标签蛋白Trx对外源蛋白IGF-1在大肠杆菌中表达的影响,我们应用融合PCR技术获得Trx-IGF-1融合基因,构建重组载体pET30-Trx-IGF-1并转化大肠杆菌C43(DE3),以期实现具有生物活性的IGF-1的高效可溶表达,进而探究标签蛋白Trx对IGF-1生物活性的影响,为其他外源蛋白的可溶表达策略提供借鉴。
1 材料与方法
1.1 材料
1.1.1 菌株、载体及细胞 IGF-1基因,购自Origene;大肠杆菌菌株 DH5α、BL21(DE3),购自天根生化科技有限公司;载体及大肠杆菌菌株Rosetta(DE3)、C43(DE3)以及NIH3T3 细胞由本实验室保存。
1.1.2 试剂 引物由上海生物工程有限公司合成;PrimeSTAR mix,购自TaKaRa公司;限制性内切酶(KpnⅠ、SalⅠ等)、T4DNA 连接酶、DNA marker、蛋白marker,购自Fermentas公司;质粒小提试剂盒、胶回收试剂盒、卡那霉素、IPTG,购自上海生物工程有限公司;山羊抗人IGF-1多抗,购自Abcam公司;HRP标记驴抗山羊IgG,购自碧云天生物技术研究所;Ni离子金属亲和层析填料,购自美国GE公司;IGF-1标准品,购自R&D公司;DMEM和FBS,购自Gibco 公司;CellTiter-Blue Cell Viability Assay,购自Promega 公司;Propidium Iodide/碘化丙啶(PI),购自碧云天生物技术研究所。
1.2 方法
1.2.1 重组表达载体的构建 以IGF-1基因,设计引物,引入双酶切位点,分别与9种带不同标签的载体连接,构建重组载体。
1.2.2 IGF-1在大肠杆菌中的诱导表达 挑取阳性克隆,接种于含100 μg/mL抗生素的LB液体培养基里,37℃,200 r/min培养过夜,后以1%接种体积分数转接到新鲜含100 μg/mL抗生素的LB液体培养基中,37℃培养至 OD600值为 0.4~0.6时加入IGTG(终浓度 1 mmol/L),低温、低转速(30 ℃,100 r/min)诱导6 h。SDS-PAGE检测诱导前后菌液表达情况。
1.2.3 重组表达载体pET30a-Trx-IGF-1的构建以人igf-1基因为模板,采用PCR方法扩增igf-1基因。以pET32a为模板,用PCR方法扩增trx基因。胶回收试剂盒纯化PCR产物trx-igf-1融合基因,用KpnⅠ和SalⅠ双酶切,并将酶切产物割胶回收,与同样酶切并回收纯化的pET30a载体用T4DNA酶连接,16℃连接过夜。连接产物转化到大肠杆菌DH5α感受态中,卡那霉素抗性筛选,提取质粒,进行菌液PCR、KpnⅠ和SalⅠ双酶切及测序鉴定,筛选阳性克隆,将其质粒转化至大肠杆菌C43(DE3)菌株中。
1.2.4 融合蛋白诱导表达 挑取阳性克隆,接种于含卡那霉素100 μg/mL的LB液体培养基里,37℃,200 r/min培养过夜,然后以1%接种量转接到新鲜含卡那霉素100 μg/mL的LB液体培养基中,37℃培养至OD600值为0.6时加入IGTG,探索不同诱导温度(20、25、30、37 ℃)、诱导时间(2、3、4、5、6、7 h)及 IPTG 浓度(0.1、0.25、0.5、0.75、1、1.5、2、2.5 mmol/L)对表达的影响,确定可溶表达的最优条件。诱导表达结束后,离心收集菌体,按1/5加入PBS重悬菌体,经超声破碎后离心,收集上清和沉淀,SDSPAGE检测可溶性。
1.2.5 融合蛋白纯化 发酵表达600 mL,离心收集菌体,按1/5加入平衡缓冲液20 mmol/L PB、100 mmol/L NaCl、25 mmol/L 咪唑(pH 7.2)重悬,超声破碎,离心取上清备用。Ni离子亲和层析柱先用平衡缓冲液平衡,上样结束,分别用20 mmol/L PB、100 mmol/L NaCl、257.5 mmol/L 咪唑(pH 7.2)和20 mmol/L PB、100 mmol/L NaCl、800 mmol/L 咪 唑(pH 7.2)洗脱杂蛋白质和目的蛋白质,收集洗脱峰,进行SDS-PAGE检测。
1.2.6 纯化产物的Western blot检测 纯化蛋白经SDS-PAGE分离后,电转移至硝酸纤维素膜(NC膜)上,经5 g/dL脱脂奶粉封闭2 h,以山羊抗人IGF-1多抗为一抗,室温孵育3 h,TBST洗涤3次后,以HRP标记的驴抗山羊为二抗,室温孵育1.5 h,TBST洗涤3次,ECL显色分析结果。
1.2.7 融合蛋白Trx-IGF-1促NIH3T3增殖活性NIH3T3细胞用DMEM培养基(含体积分数10%FSB)配成5×104mL细胞悬液,接种于96孔板,100 μL/孔,培养24 h。0.4%血清饥饿处理12 h后,向96孔板中分别添加不同浓度的IGF-1标准品和Trx-IGF-1(100、75、50、25、12.5、6.5、3.25、0 nmol/L),每组6个复孔。作用24h后,每孔加CellTiter-Blue试剂10 μL,37℃孵育2 h,酶标仪检测样品在560Ex/590Em波长处的荧光值。
1.2.8 流式细胞仪检测对NIH3T3细胞周期的影响取对数生长期的NIH3T3细胞,2×106孔接种于6孔板,分为IGF-1阳性组、Trx-IGF-1实验组和对照组,3孔/组。培养24 h后,更换0.4%FBS/DMEM饥饿处理 12 h,IGF-1 阳性组加入 IGF-1(30 nmol/L),Trx-IGF-1实验组加入 Trx-IGF-1(30 nmol/L),加药处理24 h后,以1000 r/min离心5 min收集细胞,弃培养基,用4℃预冷的PBS洗细胞2次,离心去PBS,加入 4℃预冷的70%的乙醇 -30℃固定过夜,离心弃去固定液,用 4℃预冷PBS洗细胞2次,加入 500 μL RNase(50 μg/mL)37 ℃孵育 30 min,离心弃上清液,加入 200 μL PI(50 μg/mL),4 ℃避光30 min。采用流式细胞仪检测细胞周期。
2 结果与讨论
2.1 IGF-1在大肠杆菌中的诱导表达
将igl-1基因分别与质粒 pET28a、pET20b、pET356、pET32a、pET30b、pEZZ18a、pGEX4T-1、pColdⅡ、pMAL2X连接,构建9种重组表达载体,分别转入 BL21(DE3)、Rosetta(DE3)和 C43(DE3)等 3种表达菌株中,诱导结果显示,pET28a-IGF-1、pET35b-IGF-1、pET32a-IGF-1、pET30a-IGF-1、pColdII-IGF-1、pMAL-2X-IGF-1重组载体在大肠杆菌中有不同程度的表达,但只有pET32a-IGF-1可溶表达,且在C43(DE3)菌株中表达量最高(图1),而pET30a-IGF-1虽然大量表达,但表达产物以包涵体形式存在(图2)。
2.2 重组表达载体pET30a-Trx-IGF-1在C43(DE3)中的表达
将PCR获得的trx-igf-1融合基因插入pET30a表达载体,并转化至DH5α感受态细胞,筛选阳性克隆并进行测序鉴定。重组表达载体pET30a-Trx-IGF-1转化C43(DE3)细胞,挑取阳性克隆,过夜活化后,按1/100转接至10 mL LB/Amp+培养基中,37℃培养至对数生长期OD600值为0.4~0.6时,加入IGTG诱导表达4 h。离心收集菌体,经超声破碎,离心分别取上清和沉淀进行SDS-PAGE(图3),结果显示在相对分子质量约25×103处可见目的条带,与理论值一致,而未诱导组未见此带。目的蛋白主要存在于上清中,表明重组融合蛋白主要以可溶形式表达。

图1 pET32a-MIGF-1在大肠杆菌中表达产物的SDSPAGEFig.1 SDS-PAGE analysis of pET32a-IGF-1 expression in E.coli
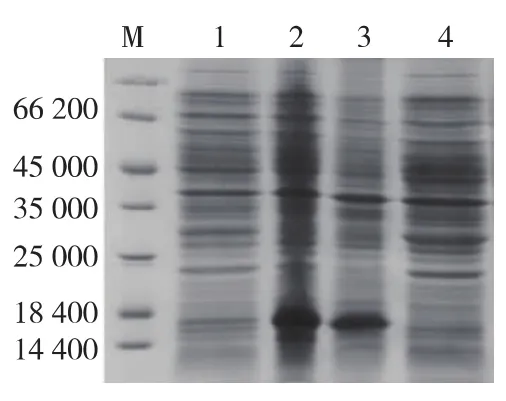
图2 pET30a-MIGF-1在C43(DE3)中表达产物的 SDSPAGE分析Fig.2 SDS-PAGE analysis of pET30a-IGF-1 expression in C43(DE3)
2.3 融合蛋白诱导表达条件优化
为确定最优表达条件,提高可溶目的蛋白表达量,我们比较了不同诱导温度(20、25、30、37 ℃)、诱导时间(2、3、4、5、6、7 h) 及 IPTG 浓度(0.1、0.25、0.5、0.75、1、1.5、2、2.5 mmol/L)对表达的影响,确定可溶表达的最优条件。结果表明,30℃条件下,1 mmol/L IPTG诱导5 h,可溶性目的蛋白表达量最高(图4),用Image J软件分析结果显示,融合蛋白表达量约占菌体总蛋白的50%。
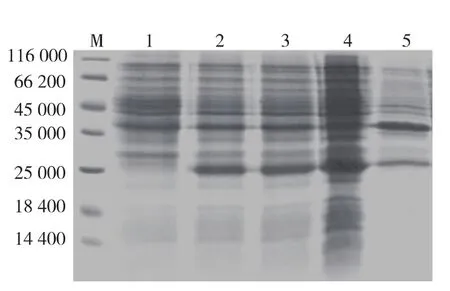
图3 pET30a-Trx-IGF1重组载体在C43(DE3)中表达的SDS-PAGE分析Fig.3 SDS-PAGE analysis of pET30a-Trx-IGF-1 expression in C43(DE3)
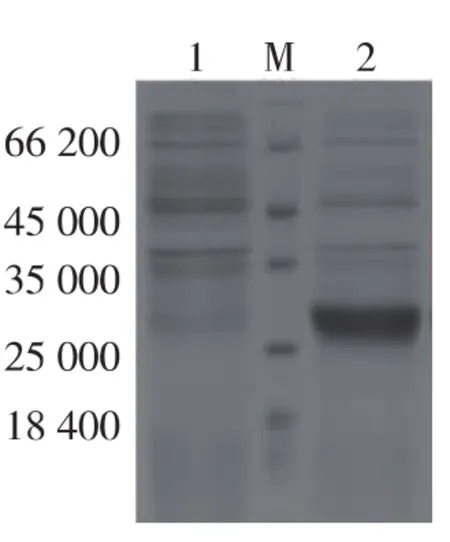
图4 pET30a-Trx-IGF-1在C43(DE3)中优化表达的SDS-PAGEFig.4 SDS-PAGE analysis of optimizing pET30a-Trx-IGF-1 expression in C43(DE3)
2.4 融合蛋白的纯化及Western blot分析
超声破碎上清经过Ni柱吸附后,以20 mmol/L PB、100 mmol/L NaCl、257.5 mmol/L 咪唑洗脱杂蛋白,20 mmol/L PB、100 mmol/L NaCl、800 mmol/L 咪唑洗脱目的融合蛋白(图5(a)),经Ni离子亲和层析柱纯化后,目的蛋白Trx-IGF-1的纯度达90%以上。纯化获得的目的蛋白经SDS-PAGE后,用anti-IGF-1 抗体进行 Western blot鉴定(图5(b)),结果显示,在相对分子质量约25×103处可见蛋白杂交带,说明获得的重组融合蛋白具有IGF-1抗原活性。
2.5 融合蛋白Trx-IGF-1促NIH3T3增殖活性
Cell-Titer Blue试剂盒检测Trx-IGf-1对NIH3T3细胞增殖的影响,结果(图 6)显示,在 5、10、20、40、80 nmol/L 的浓度范围内, 与对照组(0 nmol/L)相比,Trx-IGF-1融合蛋白具有明显的促NIH3T3细胞增殖活性,且呈剂量依赖关系,IGF-1标准品最高增殖率达到(218.59±11.22)%,Trx-IGF-1融合蛋白最高增值率为(192.79±11.39)%。
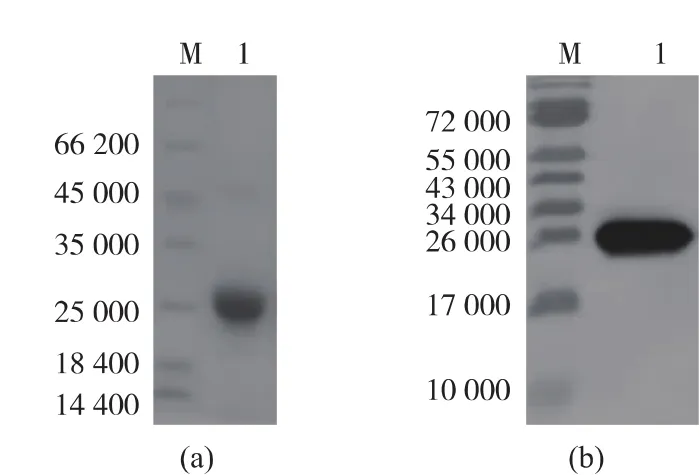
图5 Trx-IGF-1蛋白纯化产物的SDS-PAGE与Western Blot分析Fig.5 SDS-PAGE and Western Blot analysis of purified Trx-IGF-1

图6 Trx-IGF-1融合蛋白对NIH3T3细胞增殖的影响Fig.6 Effect of Trx-IGF-1 on NIH3T3 cells proliferation
2.6 流式细胞仪检测对NIH3T3细胞周期的影响
细胞周期分析结果(图7)表明,对照组NIH3T3细胞大多处于G0/G1期,细胞增殖指数PI为12.88%。IGF-1阳性组和Trx-IGF-1实验组处理NIH3T3细胞后,与对照组相比,G0/G1期的细胞百分率明显降低,S期和G2/M期细胞百分比明显增高,增殖指数(分别为32.89%、29.51%,表1),表明融合蛋白能明显促进NIH3T3细胞周期进展。
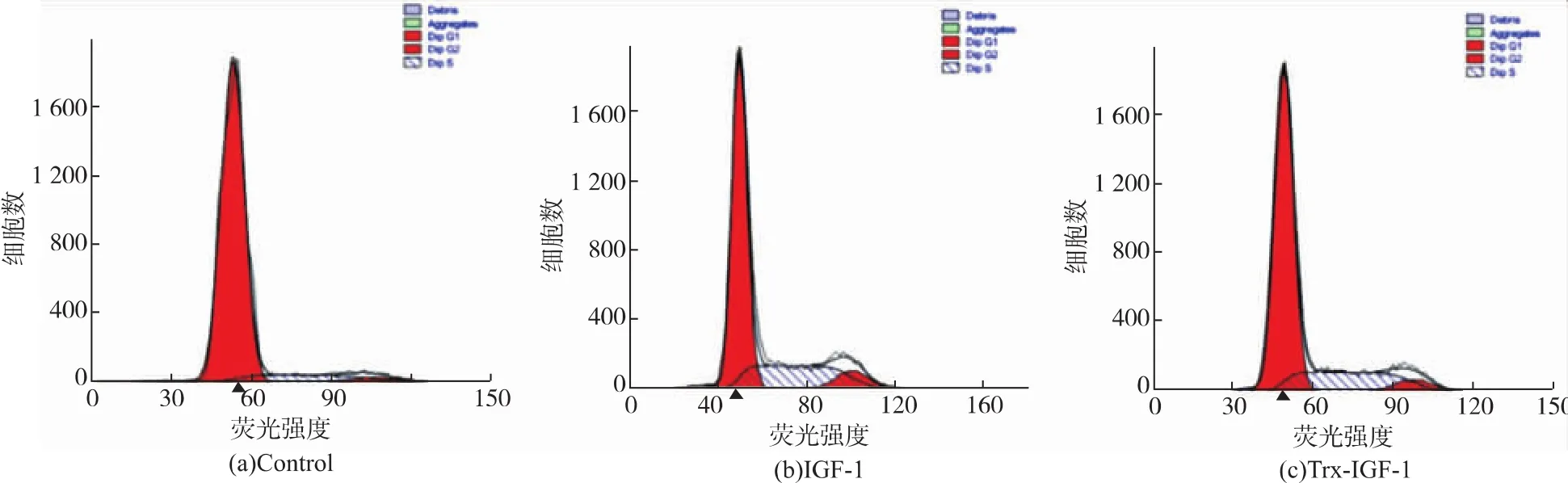
图7 IGF-1或Trx-IGF-1对NIH3T3细胞周期进展的影响Fig.7 Effect of IGF-1 or Trx-IGF-1 on NIH3T3 cell cycle progression
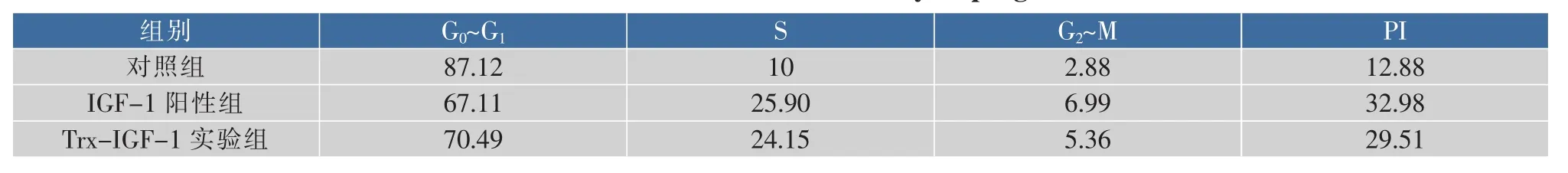
表1 IGF-1和Trx-IGF-1对NIH3T3细胞周期的影响Table1 Effects of IGF-1 and Trx-IGF-1 on cell cycle progression of NIH3T3 cells %
3 结 语
IGF-1是人体内一种重要的生长因子,与胰岛素结构相似,通过内分泌、自分泌和旁分泌形式调节细胞分化和增殖,参与合成代谢,在神经细胞生长和分化[16]、软骨发育[17]及骨质疏松重建过程中[18]有重要的作用。然而,从血液中获得IGF-1难度大,得率低,限制了早期人们对IGF-1纯品深入研究和临床应用推广。随着基因工程技术的发展,国内外学者应用基因重组技术在细菌、酵母和动物细胞中表达IGF-1。
大肠杆菌表达系统是目前获得重组蛋白最简单经济的方法,现阶段关于大肠杆菌表达IGF-1重组蛋白的研究,国内外都有许多报道。但该系统缺乏真核生物蛋白质翻译后修饰系统,不能有效表达过长或过短的外源蛋白,二硫键形成能力有限,易错误折叠形成包涵体[19],严重影响了外源蛋白的高表达和高活性。
选择适宜的表达菌株,是外源蛋白高效表达的重要步骤。菌体内含有大量内源蛋白酶,易造成外源表达产物的降解。而大肠杆菌C43(DE3)是蛋白酶缺陷型菌株,可以有效避免外源蛋白被蛋白酶降解,保持其稳定性[20]。同时,C43(DE3)基因组含有参与毒性蛋白表达时细胞死亡途径的突变,可以高效表达毒性蛋白或疏水性蛋白[21]。一些在BL21(DE3)中低表达的蛋白,甚至对宿主细胞有毒性的蛋白,如球蛋白和膜蛋白,均能在C43(DE3)中高效且低毒性表达[22-24]。C43(DE3)是优于 BL21(DE3)的高效表达外源蛋白的理想宿主[25]。
蛋白正确的空间折叠和二硫键配对,是保证其生物活性的基本要求。表达载体是外源基因在大肠杆菌中可溶表达的一个重要影响因素。IGF-1相对分子质量较小,且含有二硫键,为获得正确立体结构的活性蛋白,需与可溶高表达的蛋白标签融合,进行可溶表达[26-29]。原核表达载体主要包括pET系列载体、pGEX载体和pMAL载体等,载体上含有各种融合标签,与外源基因形成融合蛋白[30]。pGEX-4T-1载体含有GST标签,具有对宿主菌无选择性,纯化条件温和简便等优点,但对目的蛋白分子量、电性及氨基酸种类要求严格,蛋白易形成包涵体[31]。pMAL-2x载体含有BMP标签,由于胞质中蛋白水解酶对融合蛋白的降解作用,表达的融合蛋白通常低于理论分子量,且融合蛋白易错误折叠形成包涵体,不能正常分泌[32]。
pET系列载体是目前应用最广泛的原核表达载体,本实验结果表明,各种融合载体蛋白系统中,pET32a的硫氧还蛋白标签,能帮助外源基因高效可溶表达。硫氧还蛋白Trx是一种常见的氧化还原小分子蛋白(相对分子质量为12×103),其保守的活性位点结构为-Trp-Cys-Gly-Pro-Cys-,具备氧化还原活性,可编码硫氧还蛋白,催化蛋白质二硫键还原,帮助蛋白质正确折叠[33]。同时,Trx作为大肠杆菌自身蛋白,在菌体中易折叠,应用Trx融合表达,可在大肠杆菌中获得高产量的可溶性融合蛋白[34-36]。HARTWIGA等[37]应用Trx融合及真核序列密码子优化,实现广藿香醇合成酶在大肠杆菌中的可溶表达,表达量提高42%,且融合蛋白仍保持酶活。
pET30a-IGF-1在大肠杆菌中主要以包涵体形式表达,我们通过构建融合表达载体pET30a-Trx-IGF1,转化至大肠杆菌 C43(DE3)中,经 30℃诱导表达,实现融合蛋白的高效可溶表达,目的蛋白约占菌体总蛋白的50%。利用融合蛋白N端His-tag标签,经Ni离子亲和色谱柱纯化,获得纯度较高且具有IGF-1免疫源性的融合蛋白。在IGF-1的N端融合Trx有助于IGF-1的正确折叠,获得大量可溶的Trx-IGF-1融合蛋白。生物学活性测定实验证明,融合蛋白具有明显的促NIH3T3细胞增殖及细胞周期进展的生物活性。与阳性对照相比,Trx-IGF-1融合蛋白促NIH3T3相比增殖活性有些许降低(约12%),可能是由于融合蛋白分子量变大,Trx通过空间位阻影响IGF-1与其受体结合,但未影响IGF-1信号传导。本实验表明,硫氧还蛋白促进IGF-1在大肠杆菌中的高效可溶表达,为IGF-1生产工艺及药学研究等奠定基础,同时为包涵体蛋白在大肠杆菌中的可溶表达提供一定的借鉴。
