幕上神经胶质瘤相关性癫痫发作模式的危险因素分析
2019-10-29吴建兵杜春富张德明高晋健王嗣松
张 杰, 吴建兵, 杜春富, 张德明, 高晋健, 冯 文, 王嗣松, 张 桓
1. 雅安市人民医院神经外科,雅安 625000 2. 西南医科大学附属成都市西区医院神经外科,成都 610036 3. 西南医科大学附属成都三六三医院神经外科,成都 610041
目前肿瘤相关性癫痫(tumor-associated epilepsy, TAE)术后癫痫控制模式及患者对抗癫痫药物(antiepileptic drugs, AEDs)的反应尚无定论。既往研究倾向于将结果分为无癫痫发作和不受控制的癫痫发作[1]。但TAE病情受多重因素影响且呈现高度动态变化。目前对TAE的发病率、缓解持续时间和复发时间鲜有研究。TAE中AEDs的管理方法来自于非肿瘤性癫痫数据,而来自TAE患者的证据较少[2]。TAE的治疗反应模式对于制定合理的AEDs治疗策略至关重要,并能为TAE的神经生物学机制提供新的见解。本研究回顾分析了234例幕上神经胶质瘤患者的术后癫痫控制情况和治疗反应,分析可预测不同癫痫发作模式的临床病理学和治疗等因素。
1 资料与方法
1.1 一般资料 回顾分析2014年1月至2018年1月在雅安市人民医院接受开颅手术的胶质瘤相关性癫痫患者278例,影像学诊断为幕上胶质瘤患者234例。其中,男性113例,女性121例,年龄11~75岁,平均(54.7±16.9)岁,中位年龄48岁。所有患者经历了术前癫痫发作或至少1次术后癫痫发作,被诊断为TAE;术后病理诊断为胶质瘤。患者中位随访时间为16.8(9.9~58.7)个月;Ⅱ级胶质瘤患者随访64.1(39.6~94.6)个月;Ⅲ级胶质瘤患者随访45.9(14.4~97. 6)个月;Ⅳ级胶质瘤患者随访11.6(5.3~16.8)个月。
1.2 排除标准 排除仅进行组织活检,以及切除后仅术后1个月内的癫痫发作(包括生存期<30 d)患者。根据上述标准排除29例,其中13例仅有术后30 d内的随访数据;15例仅在术后第1周癫痫发作。
1.3 药物使用情况 AEDs包括丙戊酸钠、左乙拉西坦、卡马西平、奥卡西平、加巴喷丁、拉莫三嗪、苯妥英钠、托吡酯等。根据发作类型选择相应的抗癫痫药物,兼顾药物使用禁忌证、不良反应、药物间的相互作用、对化疗药物的潜在影响及患者经济条件等综合考虑。应用AEDs后记录癫痫控制情况。起始接受单一AED治疗,根据癫痫控制情况和临床不良反应,进行剂量调整和更换药物,可使用单一AED或2种或多种AEDs的组合。患者经过2种或2种以上AEDs充分治疗后,术后癫痫仍持续发作时,被视为耐药性癫痫。预防性应用AEDs的患者通常在术后3~6个月无癫痫发作时停药。
1.4 临床病理诊断 临床病理诊断包括性别、年龄、组织病理学特征。治疗包括手术、化疗和(或)放疗。通过术后磁共振成像确定切除范围,分为肉眼全切除、次全切除(50%~95%肿瘤切除)、部分切除(<50%肿瘤切除)。记录再次切除的组织学特征。234例患者中,Ⅰ级胶质瘤(神经节细胞瘤)仅1例,术后无癫痫发作,因数量太少,与Ⅱ级胶质瘤合并。术后27例患者停用AEDs,其中8例随后癫痫发作,该8例术前均有癫痫发作史。
1.5 发作模式 记录术后12个月内的癫痫发作情况、无癫痫发作的持续时间和12个月后癫痫复发情况。根据癫痫发作情况,分为4种模式:术后无癫痫发作(N=119);癫痫发作仅发生在术后前6个月内,此后无癫痫发作,为早期发作(N=29);癫痫呈波动性发作(N=56);从未获得无癫痫发作,即术后24个月内至少每月癫痫发作3次,此后至少每年癫痫发作1次,为持续发作(N=30)。
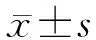
2 结 果
2.1 癫痫发作及控制情况 234例患者中,术前癫痫发作158例(67.5%),无术前发作76例(32.5%);无癫痫发作119例(50.9%)、早期发作29例(12.4%)、波动性发作(23.9%)、持续发作30例(12.8%)。 其中,119例无癫痫发作患者中,12个月后12例(10.1%)出现癫痫发作;经历12个月的无发作后,至少出现1次发作的患者中,胶质瘤Ⅳ级19例(15.6%,19/122)、胶质瘤Ⅲ级26例(63.4%,26/41)、胶质瘤Ⅱ级28例(39.4%,28/71)。234例患者中,157例(67.1%)接受单一AEDs治疗后癫痫得到有效控制;46例(19.7%)患者联合2种AEDs治疗,31例(13.2%)患者联合2种以上AEDs,癫痫均控制不良。
2.2 癫痫发作临床病理因素的单因素分析 (表1)表明:4种发作模式中,患者胶质瘤病理分级,切除程度,术前癫痫发作、再次手术、组织进展、放疗和化疗患者所占比例等差异有统计学意义(P<0.05)。Ⅱ级和Ⅲ级神经胶质瘤患者具有相似的癫痫发作模式,均以波动性发作最常见;Ⅳ级胶质瘤患者中,62.2%术后无发作,在其余3种发作模式中分布相似。
2.3 癫痫发作临床病理因素的多因素分析 将无发作模式作为对照,多因素logistic回归结果(表2)表明:术后早期癫痫发作可能与胶质瘤组织学进展相关(P=0.049);癫痫波动性发作可能与胶质瘤等级、术前癫痫发作和组织学进展相关(P<0.05);持续发作可能与术前癫痫发作、肿瘤切除不足、组织学进展相关(P<0.05)。
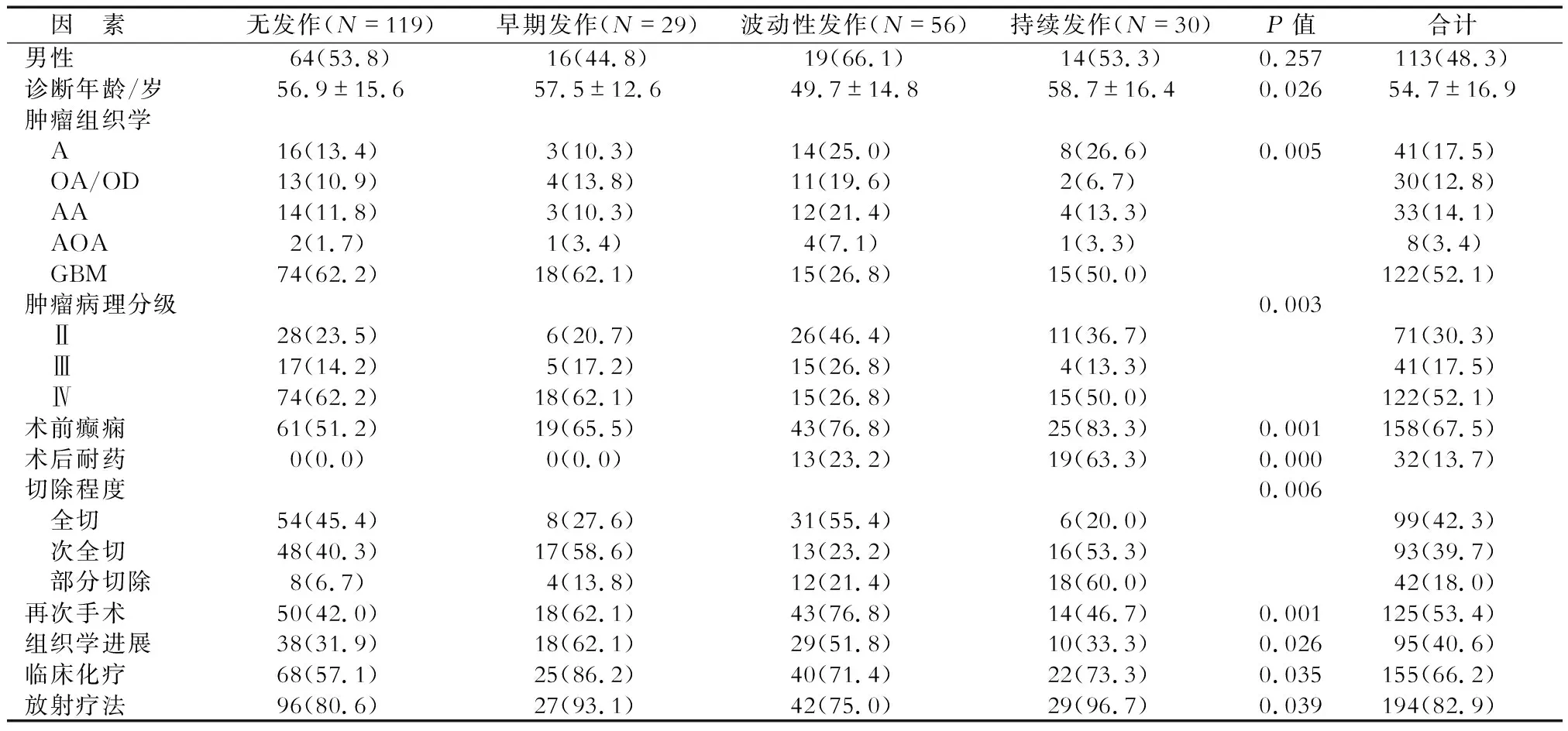
表1 癫痫发作模式相关临床病理学因素的单因素分析 n(%)
A:星形细胞瘤;OA/OD:少突细胞瘤/少突神经胶质瘤;AA:间变性星形细胞瘤;AOA:间变性少突胶质细胞瘤;GBM:胶质母细胞瘤
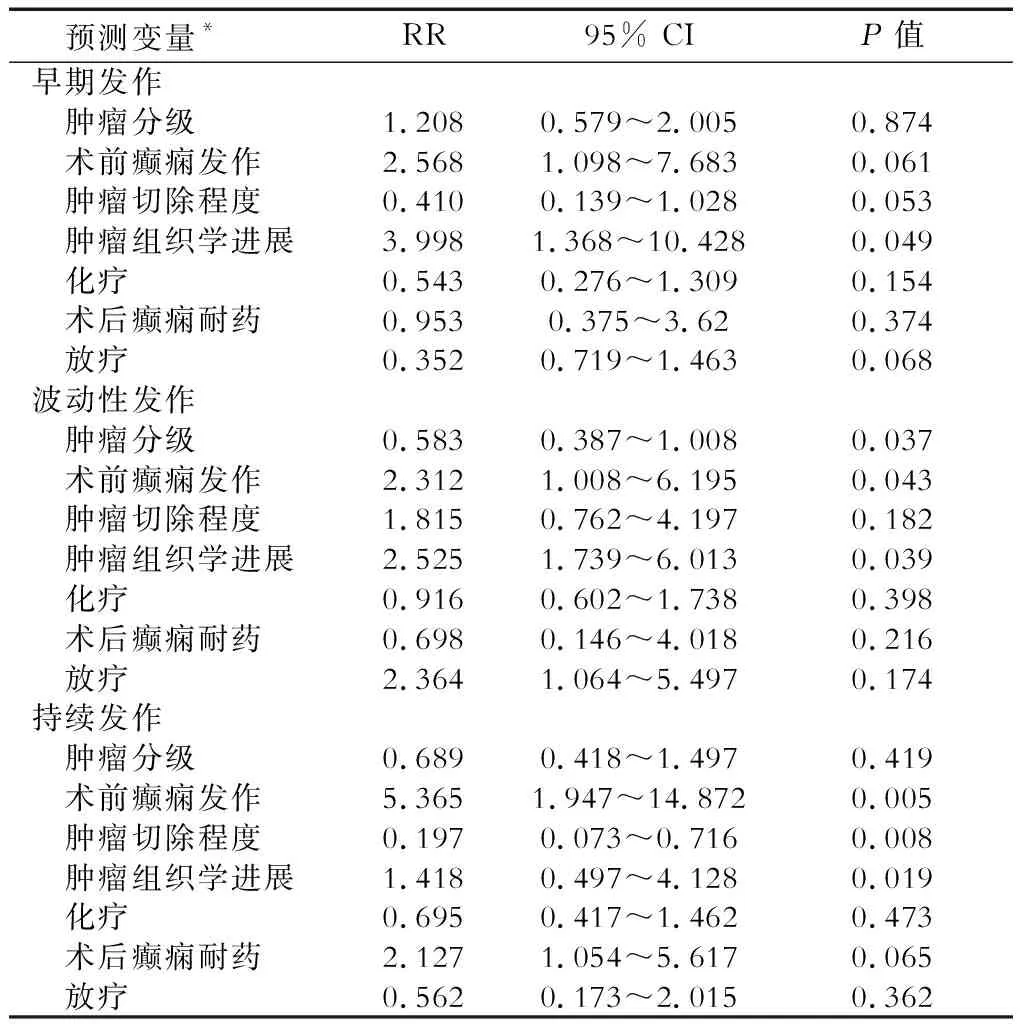
表2 癫痫发作模式相关临床病理因素的多因素分析
*与无发作模式相比
3 讨 论
3.1 术后癫痫复发情况 目前对TAE这种复杂的脑肿瘤合并症的临床管理,基本依赖非肿瘤性癫痫的管理数据及经验,缺乏相应的指南及专家共识。而对于病情高度变化的胶质瘤患者,术后癫痫控制模式及其对AEDs反应的相关研究更少。本研究对WHO Ⅱ~Ⅳ级胶质瘤患者的术后癫痫发作情况进行了纵向研究。结果表明:胶质瘤TAE存在明显的术后发作控制模式,具有相应的危险因素;Ⅱ~Ⅲ级胶质瘤患者常获得12个月的无癫痫发作,但随后呈高风险复发;随着时间的延长,患者对连续AEDs的反应呈明显的下降趋势,经历12个月的无发作后,15.6%的Ⅳ级、63.4%的Ⅲ级及39.4%的Ⅱ级胶质瘤患者出现癫痫复发。这与在新诊断癫痫患者中的研究结果[3]相似。
3.2 癫痫发作与病理分级关系 本研究中,67.5%和32.5%的患者经历了术前和术后癫痫发作。胶质瘤病理分级与大型回顾性系列研究[4]一致。本研究中,122例WHO Ⅳ级胶质瘤患者中,92例(75.4%)术后癫痫控制满意,而在71例及41例WHO Ⅱ级及Ⅲ级患者中,术后分别为34例(47.9%)及22例(53.6%)癫痫控制满意。结果提示,癫痫发作率与胶质瘤病理分级之间存在明显负相关。其原因可能包括:低级别肿瘤患者的预期寿命延长可能导致癫痫发作率升高;快速生长的肿瘤由于显著缩短了患者的生存时间,癫痫发生所必需的时间不足;缓慢生长的肿瘤细胞可能具有内在的致癫痫特性。由于胶质瘤的生物学特征,其TAE具有独特的发作特点。例如,术后无癫痫发作的患者更可能患有Ⅳ级胶质瘤,而Ⅱ、Ⅲ级胶质瘤癫痫发作模式均呈散在分布。虽然术前无癫痫发作、全切和无组织学进展是术后获得无癫痫发作的预测因子[1],但是癫痫并非Ⅳ级胶质瘤患者预后的主要因素[5];Ⅳ级胶质瘤患者生存期的延长主要得益于完整肿瘤切除联合替莫唑胺同步放化疗[5]。本研究中,术后癫痫发作控制在6个月内与再次切除时的组织学进展相关,这种模式多发生在Ⅱ、Ⅲ级胶质瘤患者中,可能与再次手术时考虑到肿瘤进展或浸润生长模式,多采取最大范围的完全切除方式,从而消除了癫痫发作起始区有关。
3.3 癫痫发作模式与肿瘤病理分级关系 波动性发作是TAE患者最常见的模式,其中最常见于Ⅱ级和Ⅲ级胶质瘤患者,这是由于Ⅱ级和Ⅲ级胶质瘤患病率更高、病情呈缓慢进展,同时致癫痫作用强于Ⅳ级胶质瘤[1]。本研究中,这一模式患者的患病年龄明显小于其他模式,这可能与较小年龄患者Ⅳ级胶质瘤发生率较低,更有机会获得疾病发展波动的过程有关,说明肿瘤进展可驱动癫痫的发作,同时说明再次手术最大安全范围的切除有助于消除癫痫发作起始区,从而延长无癫痫发作期,与研究[6]结果相似。TAE通常遵循肿瘤复发、进展引起癫痫发作,辅助化疗及放疗有助于缓解癫痫发作的规律。此外,最近的一项研究[7]发现,癫痫发作可能在MRI检测到胶质瘤复发前出现,提示在随访期间癫痫发作应被视为肿瘤可能复发的预警信号。本组数据提示,TAE术后发作控制良好多发生在高级别胶质瘤患者中,但既往研究[8]表明其主要发生在Ⅱ级胶质瘤中。出现上述差异的具体机制尚不清楚,需进一步研究。
3.4 术前发作、肿瘤切除程度与癫痫预后 术前癫痫发作及肿瘤残留是预测癫痫控制不良的强预测因素。虽然肿瘤本身是癫痫发作的来源,但肿瘤周围区域目前被认为是造成癫痫发生的关键区域。Ⅰ~Ⅲ级胶质瘤和耐药性癫痫患者的脑电图提示,癫痫发作区多位于包括位于离肿瘤边缘1.5 cm以外的组织[9]。本课题组以往研究[10]发现,16.1%的脑膜瘤TAE 患者术前脑电图检查提示异常放电区域位于肿瘤的远隔部位,多位于肿瘤周围3 cm以内。这也间接为胶质瘤手术采取最大安全切除范围提供了理论依据[11],但是否对所有脑肿瘤患者进行扩大切除术仍然存在争议。本研究结果表明,如果患者术前出现癫痫发作,术中未能全切肿瘤,术后存在癫痫控制不良高风险时,术后应及时进行AEDs治疗并进行血药浓度监测。如果癫痫持续存在,则应考虑术后顽固性癫痫可能。结合肿瘤的状态和位置,考虑是否对患者进行再次切除或全面的癫痫评估,以确定和消除发作起始区。但这一抉择对患者特别是Ⅳ级胶质瘤患者来说是困难的。因此,对TAE的评估尚需要进一步完善,在考虑肿瘤切除的同时,必须判断癫痫的原发因素是否来自肿瘤、是否存在独立的发作起始区或存在远隔的发作起始区。本研究中,术后23.9%的患者出现癫痫波动性发作,12.8%的患者术后癫痫控制不良。如果实施扩大切除肿瘤,但术后癫痫控制不良,就说明术前评估不完整,遗漏了癫痫发作起始区,而且该类癫痫可能不能归为TAE。
本研究中,30例(12.8%)术后癫痫持续发作患者的胶质瘤病理分级无明显的倾向性,但这些患者存在共同的特点:由于受到局部解剖的限制,未能全切肿瘤。这些残余瘤体对局部脑组织的刺激仍然存在,或术后随着肿瘤的进展导致新的致痫灶形成。此外,当术中发现癫痫发作起始区位于功能区时,实施皮层内切除的患者术后神经功能缺损的风险较高[12]。此时术中可能选择软膜下横切术或低功率电灼等姑息性手术。但这些术式存在一定程度的缺陷:这些术式多与切除性手术联合运用,不能明确术后疗效归因于姑息性手术还是病灶切除性手术,其疗效难以评价;在临床操作中不易精准地阻断所有癫痫灶的传导途径,而这可能是癫痫发作的原因。上述结果说明,促成术后难治性癫痫原因是多方面的,解决这一难题还需进一步探索。
此外,再次手术获得组织学进展依据是判断肿瘤进展的金标准。然而,部分有确切肿瘤进展的患者不适合进行手术;同时,国际上目前尚缺乏胶质瘤假性进展的专家共识,使肿瘤复发与假性进展的鉴别较为困难。因此,组织学进展与癫痫发作之间的关系也须进一步探索。
3.5 术后抗癫痫治疗 对于Ⅱ~Ⅲ级胶质瘤患者,长期无癫痫发作后可能发生癫痫复发。因此,虽然部分非肿瘤的顽固性癫痫患者尝试早期停药后并癫痫无复发[13],但胶质瘤患者 ,特别是术后6个月以上出现癫痫发作时,必须谨慎停用AEDs。本组患者中,27例停用AEDs后,8例随后出现发作。而且,本研究提示,如果有肿瘤进展的证据,更不应停用AEDs。本研究提示,AEDs治疗成功率低的原因可能是药物治疗不足,仅63.3%的“从未获得无发作”者达到耐药性癫痫诊断标准。随访中发现患者AEDs治疗方案没有升级,而指南中目前也缺乏高效准确识别顽固性癫痫的方法[14]。而且,TAE的影响因素复杂,评估患者是否耐药受到更多局限。
综上所述,本研究分析了胶质瘤相关性癫痫术后癫痫的发作模式,初步探索术后癫痫相关危险因素,为对该病的进一步认识提供了一定的理论依据。胶质瘤相关性癫痫患者病情受到手术切除程度、组织病理分级、肿瘤复发进展、术后放化疗等多重因素的影响,使得这一疾病处于高度变化中,病程中癫痫发作模式各异。因此,对于胶质瘤相关癫痫患者,应进行个体化评估与治疗。此外,由于高级别胶质瘤术后患者生存时间有限,缺乏癫痫的自然发展过程,故本研究的结论还须进一步研究证实。
