我国主要潮间带沉积物中磷的含量、形态及释放
2019-10-28陈杰王东启李杨杰俞琳陈振楼许世远
陈杰 王东启 李杨杰 俞琳 陈振楼 许世远


摘要:本研究分析了我国12个潮间带表层及柱状样的总磷(TP)含量,发现浙江慈溪以北样品,辽宁辽河口表层样(0.046%±0.013%)及柱样(0.047%±0.015%)和山东青岛的表层样(0.047%±0.009%)及柱样(0.055%±0.008%)为低值区,其余天津汉沽、东营黄河口、江苏盐城、上海崇明东滩和浙江慈溪等北部5地区TP均值在0.063%~0.074%,为沿海12个潮间带中的高值区.慈溪以南,除厦门九龙江口和珠江的表层样和柱样高外(0.051%~0.070%),福州闽江口、广西英罗湾和海南东寨港较低(0.019%~0.041%).北部滩地高值区与沉积物来源以高通量的河流悬浮质输送有关.磷酸钙盐(Ca-P)的含量高值点也出现在北部5地区(4.16~9.56 μmol g-1).本研究柱样的铁结合态无机磷酸盐(Fe-P)含量低于表层样.Fe-P的高值点位于汉沽、青岛和九龙江口的表层样.通过两次连续和非连续加水培养,发现连续培养中,同一区域TP的释放速率有增有降,九龙江口(0.927±0.312 μmol kg-1h-1)释放率远高于其他区域.非连续培养,除了辽河口,其他11个区域TP释放速率显著增加(P<0.01),汉沽释放速率(1.437±0.325 μmol kg-1h-1)最高.
关键词:总磷;磷形态; 磷内源释放
中图分类号:P76
文献标志码:A
DOI: 10.3969/j.issn.1000-5641.2019.04.018
0 引言
在濱海湿地,磷通常来自本地岩石风化或上游河流悬浮颗粒物的搬运沉积,本地动植物残体也是重要的有机或无机态磷的来源,无机P以磷酸盐为主,其吸附或再生于无机和有机态固态颗粒中[1-2].潮间带湿地沉积物颗粒和动植物残体中磷储量最大,远超生物活体或孔隙水中磷酸盐含量[3-6].沉积物中磷元素有时起限制性作用,影响生物光合作用,进而对C02和N元素的循环产生互相影响,如由于海平面下降导致部分大陆架出露,P释放增加,第四纪冰期海水中的P比间冰期高[7]从而影响初级生产力.磷的形态影响其吸附解吸和最终被动植物利用[8].无机磷酸盐形态定义常用基于提取剂的定名方法,如NaOH-P和HCl-P分别认为Fe、Al态磷和Ca磷[9].Fe-P或Al-P,在厌氧和还原环境的配合下,矿化产生的磷酸盐易于解吸释放,从而被生物利用[10],而沉积物中自生磷灰石和残留态磷灰石被认为不易被生物所利用[11-13],也有观点认为在适当条件下(pH及粒径的变化),磷灰石能转化成游离无机态,从而被生物利用[14-15].对于沉积物磷酸盐的释放或解吸的观测可通过水下罩箱法进行[16-17],也可通过采集短柱样,室内模拟的方式进行[18-22].但上述文献的研究方式多为缺氧或强化厌氧条件下模拟磷的释放或吸附,而潮间带潮起潮落,好氧、缺氧交替,目前缺乏模拟此条件下磷动态变化的研究.本研究通过间歇加水和出水,观察磷的释放速率,并结合无机磷的形态,探析其变化成因.
通常沉积物中无机磷释放入上覆水体中,加上陆源河流输入和洋流输送,导致水体中磷含量的升高.目前我国潮滩近岸水体中,活性磷酸盐的点位超标率已连续两年稳定在14.6%,东海近岸达40%左右,仅次于无机氮[23-24].因滩涂是接纳岸上水体和污染排放口的载体,其磷的含量、形态和解吸释放对海洋生态系统磷的循环有重要意义.另外,国内潮间带滩涂往往受人工海防设施影响,滨海湿地日渐减少,其植被趋向稀疏,种类单一,磷的吸附解吸平衡受土质、潮流、盐度和人工活动,如围垦、养殖等多重干扰影响[25-27].本研究通过集中采集潮间带滩涂沉积物样品,分析其全磷含量、可交换离散态磷、FeP、Ca-P,并通过模拟实验分析沉积物自身作为磷源的释放情形,可对研究沿海沉积物水体P的解吸和循环有一定的启发.
1 研究方法
1.1 地点及采样方法
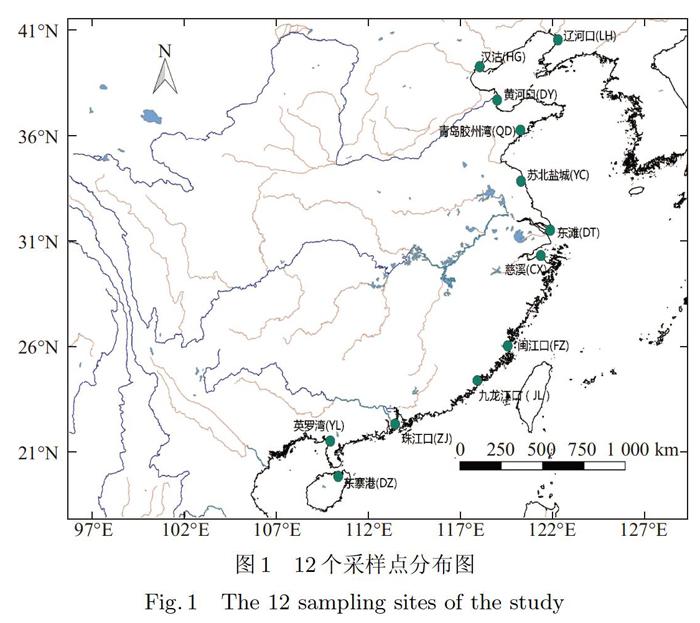
选取国内12个主要的入海河流潮间带滩涂或湿地作为研究对象.自北向南依次为:辽宁辽河口(LH)、天津汉沽沿岸(HG)、东营黄河口(DY)、青岛胶州湾滩涂(QD)、江苏苏北盐城沿岸(YC)、上海崇明东滩(DT)、浙江慈溪沿岸(CX)、福州闽江口(FZ)、厦门九龙江口(JL)、广东珠江口(ZJ)、广西英罗湾(YL)和海南东寨港(DZ),见图1.
于2014年9月至11月采集柱样. 分别于2014年12月至2015年2月和2015年6月至8月采集表层样品,作为枯季和洪季样.采用捶击法采集柱样并记录压缩深度,柱样所用有机玻璃管内径10 cm,长120 cm.以上12采样区域,每区域至少采集2根柱样,其中辽河口和盐城潮滩采集了3根柱样,共26根柱样.洪季采样中,将12个采集区域分15个断面,每断面依次布高中低潮滩3采样点,用不锈钢铲采集020 cm表层样,共得540样.枯季样则为5个断面,布置高中低潮滩3点,样品数量为洪季的1/3,鉴于洪季样有数量多和空间分布广的优势,本研究采用洪季样.秋季柱样采集后于两日内转移至4℃的恒温地下储藏室.夏季表层样品当日采集上岸后置于带冷藏功能的车载冰箱上(4℃),运回后冷冻于-18 ℃冰柜中.柱样在采集后两个月内按2 cm分层并装袋冷冻.
1.2 实验分析测试方案
全磷的测定方法简述如下.取少量沉积物样品置于40℃炉内烘24h,过60目筛,称取0.25 g样品,用少量去离子水湿润,先后加3 mL硫酸和10滴高氯酸,置调温电炉上消煮,再转移至100 mL容量瓶,用钼锑抗法测定磷含量[28].标准物质GBW07309的加标回收率稳定在95%.
为选择适合的无机磷形态测定方法,先抽12个采样区部分样品,用0.5 mol.L-1NH4F提取Al-P,发现多数样品Al-P含量很低.前期测试发现慈溪以北采样区样品碳酸钙含量高,添加NH4F,形成CaF2,与P反应生成沉淀,干扰Al-P的测定.而闭蓄态磷酸盐测试中,使用Na3C6H507.H20-Na2S204-NaHC03(CDB)溶液浸提,其分析受硫化物的干扰严重且闭蓄态磷只在强烈还原条件下才被生物利用.故最终本研究提取磷的三种形态,即可溶离散P、Fe-P和Ca-P,每个区域随机选10个表层样和一根柱的其中5个样(平均20 cm分层),共180样,具体采用如下方法进行磷的分级测定[29].称取1.0g土样于100 mL离心管,加1 mol.L-1氯化铵50 mL,连续恒温震荡th(20。C),离心后,倒出上清液,取适量体积液体,用钼锑抗法测定可溶离散磷,即无机态活性磷.上述离心管加入50 mL的0.1 mol.L-1NaOH+1 mol.L-1NaCl,连续恒温震荡17 h(20℃),离心后,倒出上清液,加25 mL近饱和氯化钠溶液(350 9 L-1)混匀并离心,倒出上清液,再加25 mL上述氯化钠溶液,混匀离心,取适量清液进行测定,此为Fe-P.加0.5 mol.L-1HCl 50 mL于以上离心管中,连续恒温震荡1h(20℃),倒出上清液,再重复两次加近饱和氯化钠溶液,混匀、离心并倒出,加以测定,为Ca-P.
为测定沉积物内源P的释放,进行两次模拟培养实验,培养温度为24~28。C.取12个采样区表层样,先后进行两次:第一次培养于6月至7月进行,称6月培养:第二次培养于8月至9月进行,称8月培养.12个潮间带区域,每区域随机选4个样品进行6月培养,共48个,8月培养取3个,共36个.平均每个湿样全重65 g,放入500 mL棕色蓝盖试剂瓶,按1g(干土当量):1.5 mL,加相应盐度的人工海水[30],各地具体盐度取近岸平均值[3l].加水过12 h后倒出,隔12 h再加海水,6月和8月培养初期连续重复4次,后期逐渐拉大加水间隔期.6月培养后期两次加水间隔48 h至96 h,进行了6次,8月培养后期则间隔96至192 h,进行了5次.水样用过硫酸钾消解后,测定其总磷[32].
对数据进行汇总分析,并进行单因素方差检验(ANOVA)、t检验和Kruskal-Wallis非参数检验,主要运用IBM SPSS 23、Excel 2016和Origin 9.0软件.
2 结 果
2.1 沉积物柱样总磷
各柱样按2 cm分层,其总磷含量(TPVo)垂直分布见图2,除了LH01和QD03外,其他柱样整体上无明显的递增或递减趋势.珠江口(ZJ)和厦门九龙江口(JL)表层020 cm的TP含量较高,青岛(QD)和崇明东滩(DT)柱样垂向差异较小.辽河口(LH)、天津汉沽(HG)、青岛胶州湾(QD)、苏北盐城(YC)、慈溪(CX)、厦门九龙江口(JL)和海南东寨港(DZ)的各地所采集的2或3根柱样间有显著差异(P<0.01).黄河口(DY)、崇明东滩(DT)、福州闽江口(FZ)、珠江口(ZJ)和广西英罗湾(YL)潮间带(DY,P-0.508,ANOVA; DT, P=0.168, Kruskal-Wallisj; FZ, P=0.994, Kruskal-Wallisj; ZJ, P=0.134,ANOVA; YL,P-0.083,Kruskal-Wallisj)两柱样间无显著差异.具体数值比较见图3,DZ和YL柱样平均值较低,分别为0.025%±0.034%和0.022%土0.006%,高值出现在HG、DT和CX,分别为0.069%±0.014%、0.072%土0.006%和0.067%±0.090%,其他柱样均值分布在0.051%~0.064%之间.
2.2 表层样总磷
表层样品中(见图3), DY(0.071%±0.008%). DT(0.074%±0.007%). CX(0.072%±0.006%)、JL(0.07%±0.019%)和ZJ(0.070%±0.019%)的含量较高,YL(0.019%±O.010%)及D2(0.030%±0.024%)的含量为表层样的最低值.北方样品中(慈溪以北),低值点位于LH(0.046%±0.013%)和QD(0.047%±O.010%),其他区域在0.063%以上.南部样品,除了上述高值区域(JL和ZJ),其他区域小于0.04%.除了JL和ZJ外,表层样的中位数值与柱样较接近.
2.3 磷的形态
所有柱样和表层样品中的可溶态或游离态的磷含量极少(见图4和图5).多数样品的可溶游离态磷含量范围在0.1~0.2 μmol g-1.表层样中,CX(0.30±0.06 μmol g-1)、JL(0.33±0.09μmol g-1)含量相对较高,HG(0.33±0.08μmol g-1)和JL(0.32土0.08μmol g-1)的柱樣含量高. 表层样品的Fe-P含量高于柱样,DY(1.70±0.27 μmol g-1)、YC(1.46+0.90μmol g-1)、D2(1.52±0.54 μmol g-1)和YL(0.94±0.50 Umol g-1)为12个潮间带低值区域,HG(4.48±0.48LLmol g-1)和JL(5.80±1.53 μmol g-1)为最高的两地,其他表层样品Fe-P含量在2.2~4.1μmol g-1.而柱样中,除QD(2.07+0.53 μmol g-1)外,Fe-P含量都低于1.7 μmol g-1. 除QD、YL和DZ,其他表层样品Ca-P高于柱样.Ca-P的高值出现在DY(7.97±1.15μmol g-1)、YC(9.56±2.29μmol g-1)、DT(8.73±0.64 μmol g-11)和CX(7.97+0.78 μmol g-1)的表层样中.慈溪以南表层样或柱样Ca-P都低于北部除LH和QD外的样品.柱样中(见图5),QD、JL、DT和FZ的Fe-P随深度呈递减的趋势,LH、QD及FZ的Fe-P和Ca-P相差较小,DY是唯一可溶离散P都大于Fe-P的样点,HG、QD、JL和ZJ的柱样断面则表现为Fe-P皆大于可溶P.
2.4 沉积物内源磷的释放
6月和8月培养,前4次为间隔24 h的连续加水培养,后6次和5次为非连续性长时间间隔培养,其沉积物内源TP解吸释放速率趋势和统计结果分别见图6和表1.现对前4次连续加水培养,12个采样区域各自不同采样点间进行比较,在辽河口(LH,P=0.314,ANOVA),黄河口(DY,P=0.508,ANOVA)、苏北盐城(YC, P=0.069, ANOVA),崇明东滩(DT,P=0.080,Kruskal-Wallisj)、慈溪(CX,P=0.465, ANOVA)、闽江口(FZ, P=0.238, Kruskal-Wallisj)、珠江口(ZJ,P=0.161,Kruskal-Wallisj)潮间带,采样点间差异不显著.而天津汉沽(HG)、青岛(QD)、厦门九龙江口(JL)、广西英罗湾(YL)和海南东寨港(DZ)差异显著(P值均小于0.01).对12个潮间带各自不同采样点非连续加水培养进行比较,LH采样点之间无显著差异(P=0.118,Kruskal-Wallisj),其余11个采样区各点间差异显著(P<0.01).比较单个区域前后连续和非连续加水培养P的释放速率(对非连续,比较前4次),发现LH、HG、QD、JL有显著差异(P<0.01),其他样点无显著差异(P>0.05).具体数值方面见表1,6月培养在连续培养期(1-4),JL释放率最高(0.877±0.256 μmol kg-1h-1),其次为HG (0.692±0.358 μmolkg-1h-1),F2(0.233土0.120 μmol kg-1h-1)和DZ (0.293±0.173 μmol kg-1h-1)为最低两区域.6月培荞的非连续培养期(5-10),除了DT、JL、DZ和YL,其他多数区域TP的释放速率大于连续培养期.HG非连续期平均值在12个区域中最高,为1.056±0.632 μmol kg-1h-1,且与连续培养值(0.692±0.358 μmol kg-1h-1)相差大,JL释放率其次(0.8640.692±0.293 μmolkg-1h-1),D2(0.278±0.135μmol kg-1h-1)为最低.8月连续培养期,JL(0.927±0.312μmolkg-1h-1)值最高,其次为HG(0.760±0.262 μmol kg-1h-1),总体上随连续培养时间增加,递增或递减,表现不一(见图6).但非连续期,除DY和FZ外,各样点TP的释放速率是各时期最高的,尤其HG(1.437±0.325 μmol kg-1h-1)、QD(1.058±0.172μmol kg-1h-1)和JL(1.133±0.508 μmol kg-1h-1),F2(0.310±0.116μmol kg-1h-l)和D2(0.297±0.140 μmol kg-lh-1)较低,其他样点均值在0.4~0.8 μmol kg-1h-1间,低释放速率发生在FZ,DZ部分点位,其低值在0.12~0.17μmol kg-1h-1间(见图6).总体上,6月和8月两次培养,LH、HG、QD和JL在非连续培养期其P释放率显著增加(P<0.01).
3 讨论
3.1 潮间带总磷的特点和磷的形态变化
和N元素不同,几乎无气态P参与海陆间P的循环.自然界中除去海水和上覆生物残体沉积为最大的P通量外[33-34].其次为河流中P的输入通量[35-36],其中绝大多数为颗粒态p[2].慈溪以北沉积物的来源与历史上黄河或其支流的故道悬浮颗粒物输送有关[37-3 8].具体来看,不同采样区域中,渤海湾北部总磷较低,如位于辽河口的表层样及柱样,而渤海西部及黄海南部黄河故道入海口的数值较高,与先前研究结论相近[39-40].渤海沿岸潮间带中,天津汉沽柱样TP最高,除了Ca-P的因素外,历史上受天津北部河流排污影响[41],营养盐含量高,同时其又为淤泥质滩涂,易吸附积累P,其Fe-P含量也较高,可能会有较高释放风险.北部样品中,汉沽、东营黄河口、苏北盐城、崇明东滩和慈溪Ca-P含量比其他采样区域高,平均值为6.57μmol g-1.因粘土矿物可追溯沉积物来源[42],对同一样品的粘土矿物分析可知(见表2),汉沽和黄河口的蒙脱石/伊利石接近,东滩和慈溪的值也相近,可知其沉积物组分来源一致,即汉沽和黄河口的Ca-P受黄河输沙带来的悬浮质磷灰石的影响,东滩和慈溪的Ca-P来自长江输送物.而盐城的蒙脱石含量居于上述四地之中,反映其受先前黄河改道影响[38],同时盐城近岸沙流浑浊带水动力复杂,最终会受到黄河和长江沉积物的双重影响[43].慈溪以北的辽河口和青岛胶州湾,其沉积物来源于本地上游河流输送,同时胶州湾较封闭的海湾水体交换环境使其粘粒状沉积物受黄河输沙影响较小[44],从而造成Ca-P和总磷含量低于北部其他样点.对于易被生物直接利用的Fe-P,其含量在黄河口和苏北盐城偏低,与其粉砂质粘土或粘土质粉砂沉积物有关[42,45】.青岛胶州湾的Fe-P含量与汉沽相近,两地同属于泥质滩涂,同时又受陆源的影响[46—48],铁结合态磷酸盐含量较高.在慈溪以南,Ca_P含量都低于北部潮间带(除LH和QD).南部温热气候和酸性土壤形成的河口沉积物土壤分化强烈,其标志是强烈分化的产物高岭石含量3倍或4倍于北部潮间带(见表2),沉积物Ca的淋失较多,Ca-P含量相对而言较少.Fe-P的高值位于福州、九龙江口和珠江口,其中九龙江口表层样Fe-P的含量最高,后续的培养实验证实了高Fe—P的沉积物,其磷的釋放速率较高.珠江口表层样品Fe—P在沿海潮间带中并不高,相关研究也表明其水域表现出磷限制性营养特征[49],最南部的英罗湾和东寨港,总磷含量最低.红树林滩涂缺磷的主要机制是该区域的沉积物受植物根际分泌的低分子质量有机酸的影响[50],此类有机酸通过与铝的螯合和配位体的交换反应[51],将铝结合态的磷释放入水体中[52],并同时将钙磷溶解[50].本研究的红树林滩涂又处于全日潮地带,有利于酸性物质的积累,最终形成了低磷的沉积环境.子与Fe2+竞争性结合,从而最终降低Fe-P值[6].12个潮间带除了3种形态的P外,其余P可能是有机态或闭蓄态P,先前野外勘察表明绝大多数滩地植被稀少且盐度高,应以无活性、不被生物利用的闭蓄态P为主,
对于北部潮间带沉积物中高含量Ca-P(主要为自生磷灰石或碎屑状磷灰石),通常认为其不可被生物所利用,属于无效磷,然而Smith发现[14-15],磷灰石也能被生物所利用,其中pH的下降是关键因子.Yamada通过强化厌氧实验(加蔗糖)[17],也发现Ca-P的降低并伴随pH的下降.但在目前,还未在非模拟的自然场景中出现,随着海洋的酸化[53-54],其后果是否会引起沉积物中Ca-P的变化还需观察.
3.2 释放培养实验的分析
前4次连续加水培养期间,天津汉沽(HG)、青岛胶州湾(QD)、厦门九龙江口(JL)、广西英罗湾(YL)和海南东寨港(DZ)各自采样区域内不同点差异显著(P<0.01),表明5地点表层P在不同点位差异大.在实际采样中,英罗湾和东寨港的表层样品位于光滩或近临植被区,形成点位差异明显的P释放速率,即部分点位较高,部分较低.从P的形态看,HG、QD和JL的表层样品Fe-P含量较高,因Fe2+/Fe3+在潮滩淹水退水中转化,对P的吸附解吸影响较大,造成点位之间差异显著.非连续培养期间,各地除LH外,12个采样区各自不同点位均差异显著.若在实际情形中,非连续培养可类比高潮滩,通常淹水期短且受风浪影响大,不规律.其P释放速率,除DY,其他样点在6月和8月两次培养试验中,都有一次或两次大于连续培养期,尤其LH、HG、QD和JL差异明显.相关研究也证实,不易受淹的滩涂湿地P的积累速率高于经常受淹区域[55-56].连续性培养相当于滩涂受潮汐作用,会输出P03- [57],造成底质P含量的降低.另外,培养温度在24-_28℃,8月培养的温度稍高(现场室温记录),更利于P的矿化和输出.有研究表明[58],P03-于夏季温暖时节会成倍增加输出.
在培养试验中,发现天津汉沽(HG)、青岛胶州湾(QD)和位于厦门的九龙江口(JL),P的释放速率高于其他区域.结合沉积物TP含量和形态看,HG、QD和JL表层样品中铁结合态的磷酸盐占总磷含量分别为21%、24%和27%.此3处潮间带是沿海潮间带中Fe-P占比最高的,其中九龙江口的高含量Fe-P会随潮汐运动释放并补充入水体中,造成溶解性无机磷增加[59].结合近岸水体的水质情况[23-24],可知历年的磷酸盐含量中东海最高,而DT和CX整体培养释放速率却不高,但个别点位较高.东海近岸磷以河流输入为主[60-61],推测总体上沉积物底质对P的释放影响有限,但局部有P的释放高值点.近岸水体中,厦门海域水体多年P的含量为0.02 mg L-1,高于天津近岸水体约1倍[23-24],推断滩涂P会对上覆水体磷酸盐浓度产生重要的贡献.胶州湾表层样品集中于湾内沿岸,磷酸盐来源于河流输送或养殖污染[25,62],导致河口及北部区域水中磷酸盐含量高[63-64],连续模拟培养实验表明其沉积物P释放率中等,其对水体可能有一定的影响.
3.3 潮间带自源P释放的因素和通量的估算
通常P释放与植被覆盖,气温或水温,潮位大小有关.潮间带植物在生长季通过光合作用会吸收磷酸盐,而其凋落代謝会释放磷酸盐[65-66].有研究表明,由于植物本身的同化吸收和其根部能输送氧分子,导致磷酸盐在植被区吸附能力大于光滩2~4倍[6],即植被和光滩皆为磷源,但植被区会减少约50%的P输入.而本研究采样区植被稀少,近于无,可推断滩地是净P源.潮差小于Im,滩地P的输入与输出会达到平衡(6].本研究的滩地潮位差除东营黄河口(DY)为1m,珠江口(ZJ)和东寨港(DZ)在1.5m左右,其余都在2m以上[67],多数情形下应以P输出为主,温度越高,P的释放也越高,尤其是铁结合态的无机磷对其敏感[68]. 12个采样区年均温除了辽河口(LH)为9.5℃,其余大于10℃,从东滩(DT)开始,大于16℃,九龙江(JL)样点开始并往南,均温都大于20℃[69],同时天津汉沽(HG)、青岛(QD)和厦门九龙江口(JL)的Fe-P含量高,3地的P受氧化还原环境变化的影响显著.综合以上外部环境要素表明,我国潮间带P多数情况下以释放为主.结合当场和后续测得的容重,通过计算,得到潮间带TP的平均释放通量见表3.除了YL,12个样点前后两次几乎不同试样的连续加水模拟实验差别不大.而多数样点非连续培养几乎都大于连续期,原因在上节中已分析.多数P的内源研究集中在长期淹水的河流和湖泊[70-72],对比少数滩涂沉积物内源P的研究发现,潮间带湿地P释放量在52~228 μmol m-2d-1[66,73],以超过100 μmol m-2d-1常见.而本研究数据表明在反复的淹水退水条件下,除了JL和YL外,多数样点P释放率不高,间歇性淹水会形成P释放通量的高值,尤其在高Fe-P含量的区域(HG、QD和JL),这种情形可能在高潮滩出现,加上高潮滩富集细颗粒粘土的特征[74],造成其可能是潮间带P内源释放的重要源,以上为内源P的释放,但潮间带还受人为因素影响,对样点周边河流、养殖、城市排污输入的外源P的地球化学行为还需要观察和实测.
4 总结
本研究通过分析我国12个典型潮间带P的含量和形态,并对样品内源释放入水体的总磷进行了研究,得出以下结果.
(1)潮间带总磷和Ca-P的含量与沉积物来源的母质有关.浙江慈溪以北潮间带(即慈溪、上海崇明东滩、江苏苏北盐城、山东黄河口和天津汉沽),除了辽河口和青岛胶州湾外,其P含量受黄河和长江输送物质影响,带有自生或碎屑状磷灰石,导致TP含量高,Ca-P的占比较大.而辽河口和青岛胶州湾则属于相对低含量区.总磷和Ca-P的含量最低点出现在南部的广西英罗湾和海南东寨港潮间带.
(2)天津汉沽、青岛胶州湾和厦门九龙江口Fe-P占总磷含量在21%~27%间,为12个潮间带中最高,因Fe-P的变化受控于沉积物水界面的氧化还原状况,其无机态磷酸盐的释放风险较高.柱样的Fe-P含量低于表层样品,青岛、九龙江口、上海崇明东滩和福州闽江口Fe-P随柱样深度而递减.
(3)培养实验表明,模拟每日潮汐影响的连续培养期间,两次培养发现除天津汉沽、青岛胶州湾、厦门九龙江口、海南东寨港和广西英罗湾外,其他潮间带各自不同点位差异不显著,天津汉沽、青岛胶州湾、厦门九龙江口P的释放速率远高于其他区域,厦门九龙江口P的释放速率最高,联系相关上覆水体P含量变化可推测其沉积物是重要的P释放源,致谢感谢为促成本研究工作,在采样中通力协作的中国科学院烟台海岸带研究所、青岛海洋地质研究所、国家海洋局第一海洋研究所的各位老师和技术人员.
[参考文献]
[1]PAYTAN A,MCLAUGHLIN K.The oceanic phosphorus Cycle [J]. Chemical Reviews, 2007, 107(2): 563-576.
[2]RUTTENBERG K c The Global phosphorus cycle[M]//Holland H D,TUREKIAN K K.Treatise on Geo-chemistry (Second Edition). Oxford: Elsevier, 2014: 499-558.
[3]SUNDARESHWAR P V,MORRIS J T.Phosphorus sorption characteristics of intertidal marsh sediments alongan estuarine salinity gradient [J]Limnology and Oceanography, 1999, 44(7): 1693-1701.
[4]TOBIAS c R,MACKO s A,ANDERSON I c,et al.Tracking the fate of a high concentration groundwaternitrate plume through a fringing marsh:A combined groundwater tracer and in situ isotope enrichment study[J]. Limnology and Oceanography, 2001, 46(8): 1977-1989.
[5]ZHOU J,WU Y,KANG Q,et al.Spatial variations of carbon, nitrogen, phosphorous and sulphur in the saltmarsh sediments of the Yangtze Estuary in China[J]Estuarine Coastal and Shelf Science, 2007, 71(1/2): 47-59
[6]TOBIAS c R,NEUBAUER s c.Salt marsh biogeochemistry-an overview[M],/PERILLO G M E,WOLANSKIE, CAHOON D R,et al Coastal Wetlands: An Integrated Ecosystem Approach. Amsterdam: Elsevier, 2009:445-492.
[7]TAMBURINI F,FOLLMI K B.Phosphorus burial in the ocean over glacial-interglacial time scales[J1 Biogeo-sciences, 2008, 6(4): 501-513
[8] BECK M A,SANCHEZ P A Soil phosphorus fraction dynamics during 18 years of cultivation on a typicpaleudult [J]. Soil Science Society of America Journal, 1994, 58(5): 1424-1431
[9]NAIR V D,REDDY K R Phosphorus sorption and desorption in wetland soils [M]//DELAUNE R D,REDDYK R, RICHARDSON C J,et al.Methods in Biogeochemistry of Wetlands. Madison: SSSA, 2013: 667-681.
[10] BRADFORD M E,PETERS R H The relationship between chemically analysed phosphorus fractions andbioavailable phosphorus [J]. Limnology and Oceanography, 1987, 32(5): 1124-1137.
[11] WILLIAMS J D H,JAQUET J,THOMAS R L.Forms of Phosphorus in the Surficial Sediments of Lake Erie[J]. Journal of the Fisheries Board of Canada, 1976, 33(3): 413-429
[12]SONZOGNI w c,CHAPRA s c,ARMSTRONG D E,et al Bioavailability of Phosphorus Inputs to Lakesl [J].Journal of Environmental Quality, 1982, 11(4): 555-563
[13] 侯立軍,陆健健,刘敏,等,长江口沙洲表层沉积物磷的赋存形态及生物有效性[J].环境科学学报,2006, 26(3): 488-494
[14]SMITH E A,MAYFIELD c I,WONG P T s.Effects of phosphorus from apatite on development of freshwatercnunities [J]. Journal of the Fisheries Board of Canada, 1977, 34(12): 2405-2409.
[15] SMITH E A. Naturally occurring apatite as a source of orthophosphate for growth of bacteria and algae [J]Microbial Ecology, 1977, 4(2): 105-117
[16]SONZOGNI w C, LARSEN D P,MALUEG K W, ET AL. Use of large subruerged chambers to measure sedimentwater interactions [J]. Water Research, 1977, 11(5): 461-464.
[17]YAMADA H, KAYAMA M. Distribution and dissolution of several forms of phosphorus in coastal marine sedi.ments [J]. Oceanologica Acta. 1987, 10(3): 311-321
[18] HOLDREN G C, ARMSTRONG D E. Factors affecting phosphorus release from intact lake sediment cores[J]Environmental Science& Technology, 1980, 14(1): 79-87
[19] NURNBERG G K. Prediction of Phosphorus Release Rates from Total and Reductant-Soluble Phosphorus irAnoxic Lake Sediments [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1988, 45(3): 453-462
[20] KIM L H, CHOI E, STENSTROM M K. Sediment characteristics, phosphorus types and phosphorus releasfrates between river and lake sediments [J]. Chemosphere, 2003, 50(1): 53-61
[21]LAI D Y, LAM K C. Phosphorus sorption by sediments in a subtropical constructed wetland receiving stormwateirunoff [J]. Ecological Engineering, 2009, 35(5): 735-743.
[22]DEJONGE V N. ENGELKES M M, BAKKER J F. Bioavailability of Phosphorus in Sediments of the WesterrDutch Wadden Sea [Jl Hydrobiologia, 1993, 253(1): 151-163
[23] 中华人民共和国环境保护部.2014年近岸海域环境质量公报[R]北京:环保部,2015
[24] 中华人民共和国环境保护部.2015年近岸海域环境质量公报[R].:北京:环保部,2016
[25] 过锋,赵俊,陈聚法,等胶州湾贝类养殖区氮、磷污染现状及动态变化[J].漁业科学进展,2012, 33(5): 116-122.
[26]cui J, LIU C, LI z,et al. Long-term changes in topsoil chemical properties under centuries of cultivation afte]reclamation of coastal wetlands in the Yangtze Estuary, China [J]. Soil and Tillage Research, 2012, 123: 50-60.
[27] MA z,MELVILLE D s,LIU J, et al. Rethinking China's new great wall [Jl. Science, 2014, 346: 912-914.
[28] 鲁如坤,土壤农业化学分析方法[M].北京:中国农业科技出版社,1999
[29] KUO s.Phosphorus[M]//SPARKS D L,PAGE A L,HELMKE P A, et al. Methods of soil analysis. Part:Chemical Methods. Madison: ASA and SSSA, 1996: 881-884
[30] KESTER D R, DUEDALL l W. CONNORS D N, et al. Preparation of artificial seawater [J]. Limnology ancoceanography, 1967, 12(1): 176-179.
[31] 苏纪兰,袁业立.中国近海水文[M].北京:海洋出版社,2005
[32] 国家环境保护总局.水和废水监测分析方法[M].北京:中国环境科学出版社,2002: 243-247
[33]MACKENZIE F T, VER L M, SABINE c L,et, al. C, N,P,s Global biogeochemical cycles and modelling oglobal change [M]//WOLLAST R, MACKENZIE F T. CHOU L.Interactions of C, N,P and S BiogeochemicaCycles and Global Change. Berlin: Springer-Verlag, 1993: 1-61.
[34]RICHEY J E. The phosphorus cycle [M]//BOLIN B, COOK R B. The Major Biogeochemical Cycles and Thei]Interactions. Chichester: John Wiley and Sons, 1983: 51-56
[35] MEYBECK M. Carbon, nitrogen, and phosphorus transport by world rivers [Jl American Journal of Science1982, 282: 401-450.
[36]LERMAN A, MACKENZIE F T. GARRELS R M. Modelling of geochemical cycles: Phosphorus as an exampk[J]. Geological Society of America Memoir. 1975, 142: 205-217.
[37]WANG Y. The Mudflat System of China [Jl. Canadian Journal of Fisheries and Aquatic Sciences, 1983, 40(sl)160-171.
[38]MILLIMAN J D, QIN Y s,REN M E. et al. Man's influence on the erosion and transport of sediment by Asiarrivers: The Yellow River (Huanghe) example [J]. The Journal of Geology, 1987, 95(6): 751-762.
[39] 李延,朱校斌,胡兆彬渤海湾底质间隙水的地球化学特征及其污染状况[J]海洋与湖沼,1982, 13(5):414-423.
[40] 秦延文,孟伟,郑丙辉,等.渤海湾水环境氮、磷营养盐分布特点[J].海洋学报,2005, 27(2): 172-176.
[41] 尹翠玲,张秋丰,阚文静,等天津近岸海域营养盐变化特征及富营养化概况分析[J].天津科技大学学报.2015, 30(1): 56-61.
[42] 杨作升,黄河、长江、珠江沉积物中粘土的矿物组合、化学特征及其与物源区气候环境的关系[J].海洋与湖沼,1988, 19(4)336-346.
[43] 任美锷.江苏省海岸带与海涂资源综合调查报告[R]北京:海洋出版社,1986.
[44]LIU z,WEI H, LIU G, et al. Simulation of water exchange in Jiaozhou Bay by average residence time approacl[J]. Estuarine Coastal and Shelf Science, 2004, 61(1): 25-35.
[45] 山东省科学技术委员会.山东省海岸带与海涂资源综合调查报告[R].北京:中国科学技术出版社,1990
[46] 戴纪翠,宋金明,李学刚,等胶州湾沉积物中的磷及其环境指示意义[J].环境科学,2006, 27(10): 1953-1962
[47] 李学刚,宋金明,李宁,等.胶州湾沉积物中氮与磷的来源及其生物地球化学特征[J].海洋与湖沼,2005, 36(6): 562-571.
[48] 王晓宇,杨红生,孙金生,等天津近岸海域氮磷营养盐分布及富营养化评价[J].海洋科学,2011, 35(9): 56-61.
[49] 岳维忠,黄小平,孙翠慈.珠江口表层沉积物中氮、磷的形态分布特征及污染评价[J].海洋与湖沼,2007, 38(2): 111-117.
[50] VAZQUEZ P,HOLGUIN G, PUENTE M E. et al. Phosphate-solubilizing microorganisms associated with therhiSDhere of mangroves in a semiarid coastal laloon[J]. BioloEv and Fertilitv of Soils. 2000. 30(5/61: 460-468
[51] FOX T R, COMERFORD N B, MCFEE w W, et al. Phosphorus and aluminum release from a spodic horizonmediated by organic acids [J]. Soil Science Society of America Journal, 1990, 54(6): 1763-1767.
[52]HESSE P R. Phosphorus fixation in mangrove swamp muds [J]. Nature, 1962, 193(4812): 295-296
[53] FABRY V J,SEIBEL B A, FEELY R A, et al. Impacts of ocean acidification on marine fauna and ecosystemprocesses [J]. Trends in Ecology& Evolution, 2013, 28(3): 178-186.
[54]ORR J C. FABRY V J,AUMONT 0, et al. Anthropogenic ocean acidification over the twenty-first century andits impact on calcifying organisrus[J]. Nature, 2005, 437(7059): 681-686.
[55] CRAFT c B, BROOME s W, SENECA E D. Nitrogen, phosphorus and organic carbon pools in natural andtransplanted marsh soils [J]. Estuaries. 1988, 11(4): 272-280
[56]SUNDARESHWAR P V, MORRIS J T. Phosphorus sorption characteristics of intertidal marsh sediments alongan estuarine salinity gradient [Jl Limnology and Oceanography, 1999, 44(7): 1693-1701.
[57]CHILDERS D L Fifteen years of marsh flumes:A review of marsh-water core interactions in southeastern USAestuaries[M],/MITSCH W J.Global wetlands. Amsterdam: Elsevier Science, 1994: 277-293.
[58] LILLEBO A I,NETO J M. FLINDT M. et al. Phosphorous dynamics in a temperate intertidal estuary [Jl.Estuarine Coastal and Shelf Science. 2004. 61(1): 101-109.
[59] 陳水土,阮五崎九龙江口、厦门西海域磷的生物地球化学研究:II表层沉积物中磷形态的分布及在再悬浮过程中的转化[J]海洋学报,1993, 15(6): 47-54.
[60] 傅瑞標,沈焕庭长江河口淡水端溶解态无机氮磷的通量[J].海洋学报,2002, 24(4): 34-43.
[61] 刘成,王兆印,何耘,等.上海污水排放口水域水质和底质分析[J].中国水利水电科学研究院学报,2003, 1(4):275-280.
[62] 马晓波,尹则高,孙寓姣,等.大沽河河口区氮磷营养盐输移转化行为研究[J]中国海洋大学学报(自然科学版)自然科学版,2015, 45 (11):100-108.
[63] 孙优善,孙鹤鲲,王学昌,等.胶州湾近岸海域水质状况调查与评价[J].海洋湖沼通报,2007(4): 93-97.
[64] 陈晨,杨桂朋,高先池,等胶州湾微表层和次表层海水中营养盐的分布特征及富营养化研究[J].环境科学学报,2012, 32(8):1856-1865
[65] LILLEBCi A I,NETO J M. FLINDT M. et al. Phosphorous dynamics in a temperate intertidal estuary [J].Estuarine Coastal and Shelf Science. 2004. 61(1): 101-109.
[66] LILLEBO A I,COELHO J P,FLINDT M R, et al. Spartina maritima, influence on the dynamics of thephosphorus sedimentary cycle in a warm temperate estuary (Mondego estuary, Portugal) [J]. Hydrobiologia,2007, 587(1): 195-204.
[67] 国家海洋信息中心.2014潮汐表[M]北京:海洋出版社,2013.
[68]SONDERGAARD, MARTIN, JENSEN J P,JEPPESEN E. Role of sediment and internal loading of phosphorusin shallow lakes [Jl Hydrobiologia, 2003, 506-509(1-3): 135-145
[69] NOAA National Centers for Environmental information. Global summary of the year [EB/OL]. (2015-09-20)[2018-05-25]. https://www.ncdc.noaa.gov/cdo-web.
[70]NURNBERG G K. Assessing internal phosphorus load: Problems to be solved [Jl Lake and Reservoir Manage-ment, 2009, 25(4): 419-432
[71]SPEARS B M, CARVALHO L,PERKINS R G, et al. Long-term variation and regulation of internal phosphorusloading in Loch Leven [J]. Hydrobiologia, 2012, 681(1): 23-33
[72]STEINMAN A, CHU X. OGDAHL M. Spatial and temporal variability of internal and external phosphorus loadsin Mona Lake, Michigan [Jl. Aquatic Ecology, 2009, 43(1): 1-18
[73] FEUILLETGIRARD M. GOULEAU D, BLANCHARD G F, et al. Nutrient fluxes on an intertidal mudflat inMarennes-Oleron Bay, and influence of the emersion period [J]. Aquatic Living Resources, 1997, 10(1): 49-58
[74] ALONGI D M. Coastal Ecosystem Processes [M]. Florida, Boca Raton: CRC Press. 1997.
