一株Fusarium oxysporum f. sp. niveum拮抗菌的筛选、鉴定及其抑菌特性
2019-10-28王恒煦徐伟慧杨友财王志刚刘泽平王可昕
王恒煦,徐伟慧,*,杨友财,王志刚,刘泽平,王可昕
(1.齐齐哈尔大学 生命科学与农林学院,黑龙江 齐齐哈尔 161006; 2.黑龙江理工生物科技有限公司,黑龙江 哈尔滨 150000)
西瓜是世界上分布最广的水果作物之一[1],由西瓜专化型尖孢镰刀菌(Fusariumoxysporumf.sp.niveum,Fon)引起的西瓜枯萎病已成为制约西瓜生产的主要因素之一[2]。近年来,随着我国设施栽培面积不断扩大,连作栽培导致西瓜枯萎病的危害加重[3],发病率可达80%以上,甚至致西瓜绝产绝收[4]。该病菌从西瓜植株根部伤口或根毛顶端细胞间侵入,在维管束导管内生长发育[5],阻塞导管并且影响水分运输,引起植株萎蔫并分泌毒素干扰寄主代谢功能,使寄主植物中毒死亡[6]。西瓜枯萎病的防治问题引起了国内外学者的广泛关注,并分别从化学杀菌剂[7]、植物抗性[8]、间混套作[9]、嫁接[10]等方面展开了一系列的防治研究,但这些防治措施各有利弊。化学防治污染环境,农药残留危害人畜健康;抗病育种周期长,成本高;间混套作防效慢,效果滞后;嫁接防治需要大量的人力和物力且使果实的口感变劣[6]。所以,寻找绿色、环保、高效和安全的微生物制剂已成为近年来防治西瓜枯萎病的重要手段[11]。本研究以齐齐哈尔青昕蔬菜基地作物根际土样和Fon为试材,在室内筛选能高效抑制Fon的拮抗菌株,通过盆栽试验验证其抑制西瓜枯萎病能力并对其抑菌特性进行初步研究,为进一步的大规模田间试验提供基础理论支持,并为西瓜枯萎病生防制剂的开发与应用奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 供试土样、幼苗和菌株
土样、西瓜幼苗均选自黑龙江省齐齐哈尔市青昕蔬菜基地;Fusariumoxyxporumf. sp.Niveum,race 2分离于青昕蔬菜基地西瓜枯萎病病株,由齐齐哈尔大学微生物生态实验室提供。
1.1.2 试验培养基
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,自然pH,定容至1 000 mL。121 ℃灭菌 30 min,用于Fon菌株平板培养与活化。
NA培养基:蛋白胨10 g,牛肉膏3 g,NaCl 10 g,琼脂20 g,调节pH至7,定容至1 000 mL。121 ℃灭菌30 min,用于WD菌株平板培养与活化。
NB培养基:在NA培养基的基础上去掉琼脂,用于WD菌株的菌液培养。
1.2 试验方法
1.2.1 拮抗菌株的筛选与鉴定
将10 g混合土样置于含有玻璃珠和90 mL水的锥形瓶中,充分振荡20 min,取1 mL土壤悬浮液加入盛有9 mL无菌水的试管中,混合均匀得到10-1稀释液,通过梯度稀释法依次得到10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9的土壤悬浮液[12];从10-7、10-8、10-9的试管中分别取0.2 mL于NA培养基中进行稀释涂布,最后将平板倒置于30 ℃恒温培养箱培养3 d,每个稀释度重复3次。将筛选出的菌株通过平板划线法接种到NA培养基,置于30 ℃恒温箱培养3 d,利用平板对峙法筛选Fon的拮抗菌株。将筛选出的拮抗菌株采用平板划线法在NA培养基30 ℃恒温培养24 h, 观察其菌落形态;用革兰氏染色法对菌体染色并用光学显微镜观察其形态[13]。
将具有拮抗性的菌株接种至NA培养基,30 ℃恒温培养3 d。3 d后用接菌环从生长良好的平板上挑取拮抗菌株,将其接种到NB培养液中,于30 ℃、180 r·min-1条件下振荡培养24 h。活菌送往上海美吉生物医药科技有限公司进行16S rDNA、gyrA、gyrB测序分析。16S rDNA引物为27F(5′-AGAGTTTATCCTGGCTCAG-3′)和1492R(5′-TACCTTGTTACGACTT-3′),PCR反应体系(50.0 μL):DNA模板2 μL,10×ExTaqbuffer 5.0 μL,正向引物(27F)1.0 μL,反向引物(1492R)1.0 μL,2.5 mmol·L-1dNTP 4.0 μL,5 U ExTaq酶0.5 μL,ddH2O 36.5 μL。PCR反应程序为:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min 30 s,30个循环;72 ℃ 10 min,4.0 ℃终止反应。gyrA引物为42F(5′-CAGTCAGGAAATGCGTACGTCCTT-3′)和1066R(5′-CAAGGTAATGCTCCAGGCATTGCT-3′),gyrB引物为UP1(5′-GAAGTCATCATGAC CGTTCTGCAYGCNGGNGGNAARTTYGA-3′)和(5′-UP2RAGCAGGGTACGGATGTGCG AGCCRTCNACR TCNGCRTCNGTCAT-3′),PCR反应体系(50.0 μL):DNA模板2 μL,10×ExTaqbuffer 5.0 μL,正向引物(42F/UP1)2.0 μL,反向引物(1066R/UP2R)2.0 μL,2.5 mmol·L-1dNTP Mix 4.0 μL,5 U ExTaq酶0.5 μL,ddH2O 34.5 μL。PCR反应程序为:94 ℃ 3 min;94 ℃ 30 s,51/57 ℃ 30 s,72 ℃ 1 min 30 s,24个循环。测序结果在NCBI的GenBank数据库中进行Blast比对,采用MEGA 5.0软件进行多序列同源性分析,并构建系统发育树。
1.2.2 拮抗菌株生长曲线测定
将拮抗菌株接种于NB培养液中,于30 ℃、120 r·min-1条件下振荡培养,每隔2 h在波长600 nm处测定其吸光度D600,测至76 h,绘制生长曲线。
1.2.3 拮抗菌株的生防试验
试验设3个处理:WD、CK1和CK2。西瓜两叶一心时(8 cm×8 cm营养钵,150 g自然土),WD处理每株苗均浇灌22 mL菌悬液(D600=1.0),培养3 d后再接入Fon孢子悬液16.5 mL(106mL-1);CK2处理每株苗均浇灌无菌NB培养基,3 d后再接入相同量的Fon孢子悬液;CK1处理每株苗均不浇WD菌悬液和Fon孢子悬液,浇灌相同体积的无菌水。每个处理3组重复,每个重复8株[14]。将西瓜幼苗置于人工气候箱中培养(30 ℃ 光照12 h,18 ℃ 黑暗12 h,相对湿度60%),试验期间正常管理,待植株发生西瓜枯萎病时,记录并分析其发病率[15]。
发病率(%)=发病植株数/总植株数×100。
抑制率(%)=(CK2发病率-WD处理组发病率)/CK2发病率×100。
1.2.4 拮抗菌株不同生长时期无菌发酵滤液的抑菌效果
根据拮抗菌株的生长曲线,取其对数生长期、平稳期、衰亡期3个时间点,并将各时间点的菌液离心10 min(7 104g, 4 ℃)[16]并收集上清液,再用0.22 μm滤膜过滤得到无菌发酵滤液,将其与已灭菌且未完全凝固的PDA培养基按体积比2∶1混合摇匀,以NB培养基无菌滤液与已灭菌且未完全凝固的PDA培养基相同比例混合作为对照,混合液倒入平板(直径90 mm),待培养基凝固后在平板中央接入Fon菌碟(直径8 mm),30 ℃培养5 d,用十字交叉法测量Fon菌落直径,每组试验3个重复,根据下面公式计算拮抗菌株不同时期无菌滤液的抑菌率[17]。
抑菌率/%=(对照菌落直径-处理菌落直径)/对照菌落直径×100。
1.2.5 拮抗菌株衰亡期无菌发酵滤液抑菌活性稳定性
pH和温度对无菌发酵滤液抑菌活性的影响。将无菌发酵滤液分别用1 mol·L-1HCl或0.5 mol·L-1NaOH调节pH至4、6、7、9、12,处理60 min,再将pH调回7。将经不同pH处理的无菌发酵滤液在-20、0、30、60、121 ℃(高压蒸汽灭菌)处理60 min,室温平衡后测定无菌发酵滤液抗Fon的活性。
时间对无菌发酵滤液抑菌活性的影响。将发酵滤液于4 ℃下分别储存1、3、5、10、20、30、45 d,测定抗Fon活性。
紫外线对无菌发酵滤液抑菌活性的影响。将4 mL无菌发酵滤液,紫外照射30、60、120 min,然后放置于暗处15 min。以未处理的无菌发酵滤液作为对照,检测紫外线处理前后无菌发酵滤液抗Fon的活性。
1.2.6 拮抗菌株衰亡期无菌发酵滤液对Fon孢子形态的影响
挑取PDA平板上培养5 d的Fon于无菌水中,经6层纱布过滤去除菌丝,在4 ℃,7 104g离心5 min并收集孢子,加入适量无菌水制成孢子悬浮液,用血球计数板计算孢子悬液的浓度,并将孢子悬液的浓度调至106mL-1。拮抗菌株衰亡期的无菌发酵滤液与Fon孢子悬液按体积比1∶1混合,混合液置于30 ℃黑暗条件下培养12 h,以同等条件下未加WD的NB培养基无菌滤液与Fon孢子悬液按体积比1∶1比例混合作为对照。分别吸取混合液滴在锡箔纸上风干,4 ℃ 2.5%戊二醛溶液固定并保存4 h以上。再用pH 7.2的磷酸缓冲液将其固定,冲洗2次,依次将样品置于体积分数为50%、70%、80%、90%、100%乙醇中脱水置换,每级脱水时间为10~15 min,用100%乙醇置换时需加无水硫酸铜脱水10~15 min,再置于冷冻室固化12 h,每组3个平行试验,样品通过扫描电子显微镜(SEM, S-3400, Hitachi, Japan)观察并分析其形态变化[18]。
1.2.7 拮抗菌株衰亡期无菌发酵滤液对Fon膜完整性的影响
据文献报道,SYTO-9荧光染液可使死细胞和活细胞染色,而碘化丙啶(propidium iodide,PI)只能使膜受损的细胞染色,这2种染料同时出现时会降低SYTO-9的荧光。因此,具有完整细胞膜的细胞排斥PI仅被SYTO-9染色且发出绿色的荧光,而细胞膜受损的细胞被PI染色发出红色荧光[19]。将拮抗菌株衰亡期的无菌发酵滤液与Fon孢子悬液按体积比1∶1比例混合,混合液在30 ℃下培养12 h后离心5 min(7 104g,4 ℃),弃上清液留沉淀。以同等条件未加WD的NB培养基无菌滤液与Fon孢子悬液按体积比1∶1比例混合作为对照。使用LIVE/DEAD BacLightTM试剂盒L7012(MA,USA)进行常温避光染色30 min,然后离心5 min(7 104g,4 ℃),弃上清液留沉淀,加1 mL无菌水重复洗涤3次。再加1 mL无菌水于离心管中,摇晃均匀后取适量溶液于载玻片上制片,自然晾干,通过共聚焦激光扫描显微镜(CLSM, TCS SP8, Leica, Germany)观察并分析其颜色变化。
1.3 数据分析
利用Microsoft Excel 2010、SigmaPlot和SPSS软件对试验数据进行统计与差异性分析。
2 结果与分析
2.1 拮抗菌株的筛选分离与鉴定
如图1所示,平板对峙法表明菌株WD对Fon有拮抗作用(图1-A),WD菌落在NA培养基上呈米白色、不透明、有褶皱分布;光学显微镜下观察菌体为有芽孢的短杆状(图1-B)。根据16S rDNA的测序结果和GenBank中已登录的核苷酸序列进行同源性比较,并采用MEGA5.0软件构建菌株WD的16S rDNA(图1-C)、gyrA(图1-D)和gyrB(图1-E)系统发育树,发现菌株WD与BacillusamyloliquefaciensNDS7(KX871898.1)的相似度为100%,16S rDNA序列分析结果可将菌株WD确定为芽孢杆菌属。以菌株WD的gyrA和gyrB序列与文献报道的模式菌株gyrA和gyrB序列比对结果构建系统发育树,发现菌株WD与Bacillusamyloliquefaciensstrain (CP017953.1)和Bacillusamyloliquefaciensstrain (KP143083.1)亲缘关系最近且遗传距离相似。所以基于菌株的形态学特征和16S rDNA、gyrA和gyrB基因序列分析,鉴定并将菌株命名为BacillusamyloliquefaciensWD。
2.2 Bacillus amyloliquefaciens WD菌液对西瓜枯萎病发病率的影响
幼苗培养45 d后,CK1、CK2、WD处理组植株发病率分别为5.88%、75.00%、31.82%(图2),未加菌的CK1植株长势良好,WD处理组西瓜枯萎病发病率明显低于未经处理的CK2,抑制率达到57.57 %,说明BacillusamyloliquefaciensWD可有效抑制西瓜枯萎病的发生。
2.3 Bacillus amyloliquefaciens WD生长曲线与抑菌效果
以菌株WD的D600为纵坐标,培养时间为横坐标,绘制拮抗菌WD的生长曲线。由图3-A可知,其延滞期为0~4 h,4 h后进入对数生长期,24 h后进入平稳期,52 h后进入衰亡期。在除延滞期以外的3个时期内选取3个时间点:12、36、60 h。如图3-B所示,WD菌株对数生长期(12 h)无菌发酵滤液处理的Fon菌丝生长直径为45.54 mm,其抑菌率为24.59%;WD菌株平稳期(36 h)无菌发酵滤液处理的Fon菌丝生长直径为30.74 mm,其抑菌率为49.24%;衰亡期(60 h)无菌发酵滤液处理的Fon菌丝生长直径为27.32 mm,抑菌率为54.32%。结果表明,BacillusamyloliquefaciensWD在衰亡期时无菌发酵滤液抑菌效果好。
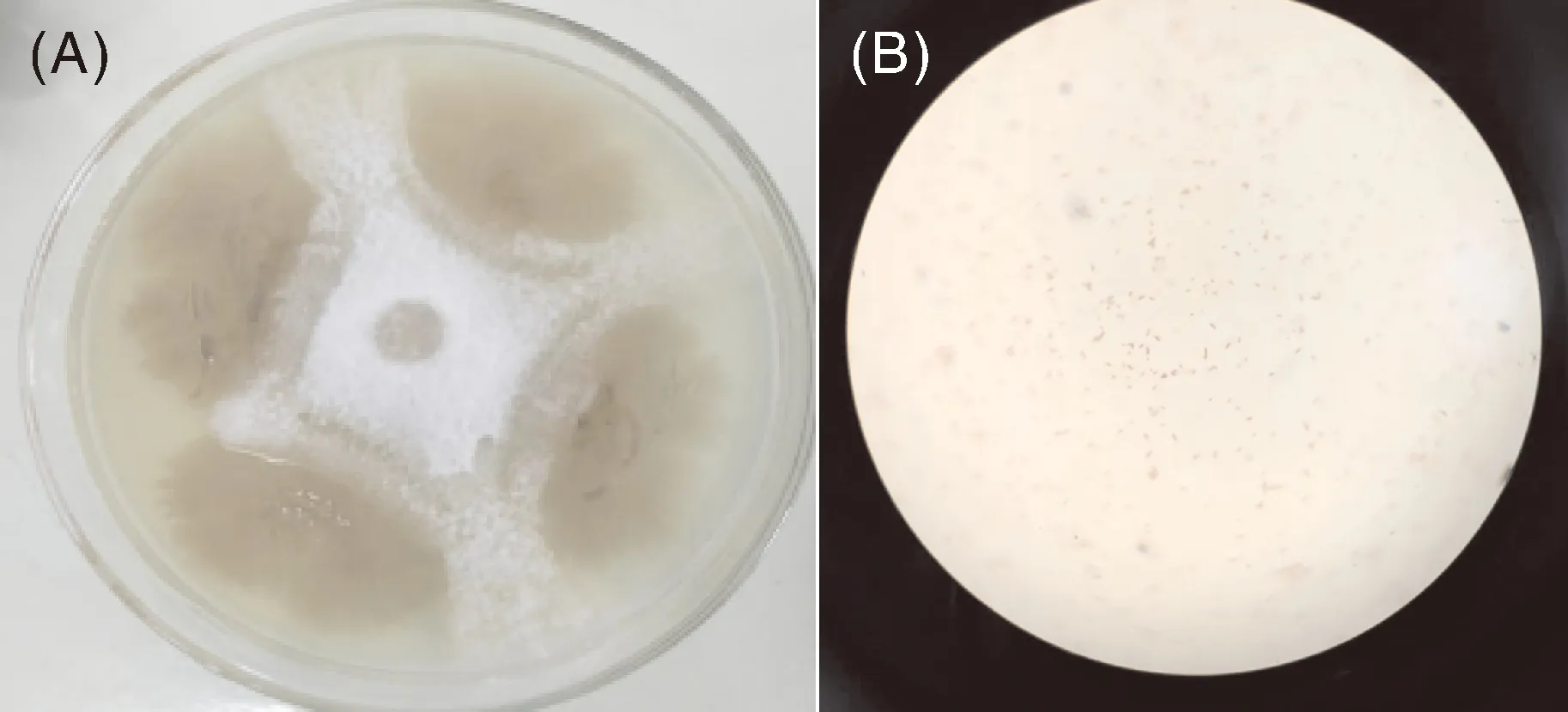

图1 菌株WD对Fon的拮抗性(A)、菌株WD形态学特征(B)和16S rDNA(C)、gyrA(D)、gyrB(E)基因系统发育树
2.4 Bacillus amyloliquefaciens WD衰亡期无菌发酵滤液抗菌稳定性
如图4所示,随温度、pH升高发酵滤液抑菌先增后减的趋势,30 ℃、pH 7时抑菌活性最强,抑菌率可达58.36%(图4-A);除121 ℃、pH 12抑菌率相对较低外,其他抑菌活性均较强,说明WD无菌发酵滤液对温度、酸碱度的耐受稳定性高。发酵滤液在4 ℃保存45 d内抑菌活性变化较小,第1天抑菌率最低(33.04%),第5天抑菌率最高(38.08%)(图4-B),说明发酵滤液的稳定性受贮藏时间影响较小(图4-B)。紫外线照射发酵滤液30、60、120 min后,菌丝直径无显著差异(图4-C),表明紫外光照处理120 min内对WD无菌发酵滤液的抗菌活性没有影响。
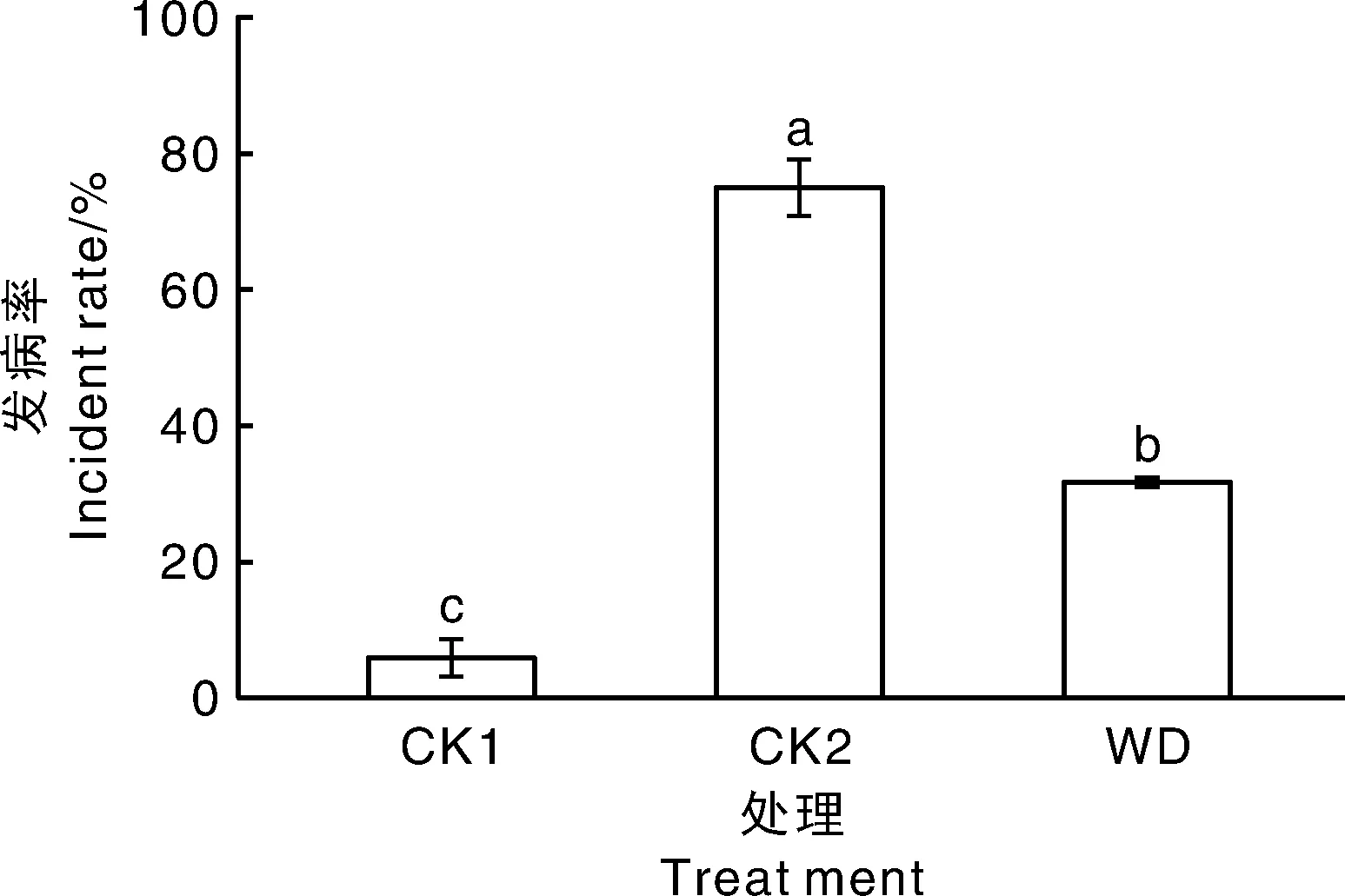
柱子上无相同小写字母表示不同处理差异显著(P<0.05);下同Data on the bars marked without the same lowercase letter indicated significant differences at P<0.05 under different treatments. The same as below.
2.5 Bacillus amyloliquefaciens WD衰亡期无菌发酵滤液对Fon微观形态的影响
如图5所示,通过SEM观察发现,对照中Fon孢子粗细均一,表面光滑(图5-A),无菌发酵滤液处理12 h后,Fon孢子表面粗糙且多处凹陷(图5-B)。说明WD无菌发酵滤液对Fon孢子形态有直接破坏作用,从而抑制Fon的生长。
2.6 Bacillus amyloliquefaciens WD衰亡期无菌发酵滤液对Fon质膜完整性的影响

图3 菌株WD的生长曲线和不同生长时期无菌发酵滤液对Fon菌丝生长的效果
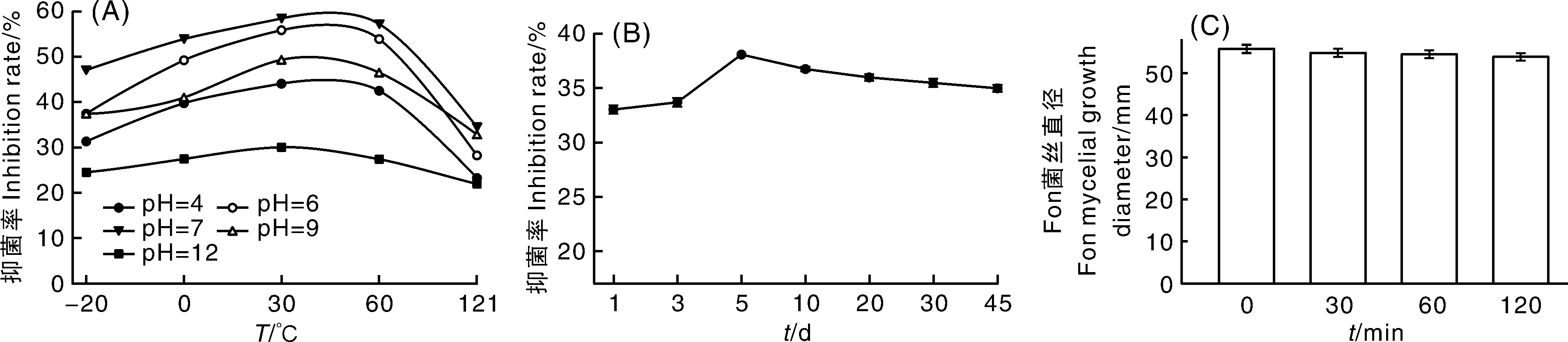
图4 菌株WD无菌发酵滤液抗Fon活性的稳定性

图5 菌株WD无菌发酵滤液对Fon孢子微观形态的影响
如图6所示,通过CLSM观察发现,对照Fon孢子发出绿色荧光(图6-A),WD无菌发酵滤液处理12 h后的Fon孢子(图6-B)部分发出红色荧光和黄色荧光(图6-C),说明WD无菌发酵滤液使一部分Fon细胞膜受到不同程度的损伤甚至引起细胞死亡。


图6 菌株WD无菌发酵滤液对Fon质膜完整性的影响
3 讨论
Bacillusamyloliquefaciens是芽孢杆菌属的重要菌种,它不仅对植物生长有良好的促进作用,而且对植物根部病害具有很好的生物防控效果[20],越来越受到研究人员的关注。生防菌株的防治能力在环境中受多因素影响,经平板对峙法筛选出的高效拮抗菌株不能确保为最优的实用菌株,在植株根部的定殖能力决定其在实际应用中的生防效果[21]。本文经平板对峙和盆栽试验验证发现,B.amyloliquefaciensWD对西瓜枯萎病菌有较强的抑制作用,能显著降低西瓜枯萎病的发生,推测该菌株有较好的定殖能力,且衰亡期的无菌发酵滤液对Fon菌丝生长抑制率高达54.32%,优于B.amyloliquefaciensB6对西瓜枯萎病菌的抑制效果[22]。B.amyloliquefaciens在发酵过程中会产生一些抗菌物质,如环脂肽、表面活性素、芬枯草菌素、聚酮化合物、芽孢霉菌素、地非西丁等,这些物质的活性受环境影响很大[23-24]。本研究中WD发酵滤液对温度、pH的耐受性较强;4 ℃贮存45 d、紫外光照处理120 min对WD发酵滤液的抑菌活性无影响,说明其发酵滤液抑菌物质稳定性较强,且适合长期保存。这一结果为其实际应用和后续功能物质的分离纯化提供了依据。
芽孢杆菌在不同生长时期分泌的抗菌物质或次生代谢物质不同[25],本研究中,WD衰亡期的无菌发酵滤液较对数生长期和平稳期的抑菌活性高,初步推测该菌株主要在衰亡期分泌抗菌物质。张学雯等[26]发现,B.amyloliquefaciensB10-6-1产生的脂肽类抗生素C14 Bacillocnycin D和C15 Bacillocnycin D可以有效抑制黄曲霉。苟艳等[27]研究表明,解淀粉芽孢杆菌MY001分泌的壳聚糖酶和几丁质酶对几丁质的降解和芦笋茎枯病菌有较强的拮抗作用,而WD发酵液中的抑菌功能物质究竟是什么,需下一步借助高效液相色谱、高分辨质谱手段并结合基因组测序明确其功能物质的成分与结构。据报道,多数抗菌物质的靶标是病原菌细胞膜,溶解细胞膜导致病原菌死亡[28],Li等[29]发现抗菌物质直接与病原菌细胞膜作用,增强膜的渗透性引起细胞死亡。本研究SEM与CLSM结果表明,WD无菌发酵滤液可使Fon孢子表面凹陷,破坏细胞膜的完整性,造成细胞死亡。这可能是体外试验中WD抑制Fon生长的原因之一。B.amyloliquefaciens的抑菌机制还包括抑制病原菌线粒体的呼吸链[30]、抑制核酸生物合成[31]和干扰病原菌金属离子的运输[32]等。WD抑制Fon的深层机制,有待进一步研究。综上所述,由青昕蔬菜基地作物根际土壤中筛选到的拮抗菌株BacillusamyloliquefaciensWD及其无菌发酵滤液有较好的抑菌效果,为西瓜枯萎病生防菌剂的开发与应用奠定了基础。
