1 000 MPa级超高强度热镀锌钢板耐腐蚀性能
2019-10-25刘李斌康永林2宋仁伯2蒋光锐滕华湘
刘李斌,康永林2,宋仁伯2,蒋光锐,商 婷,滕华湘
(1. 首钢集团有限公司 技术研究院,北京 100043; 2. 北京科技大学 材料科学与工程学院,北京 100083)
钢铁材料在应用中不可避免地与外界环境接触而产生腐蚀问题,直接影响到产品的外观和使用性能。通过镀锌可以显著提高钢铁材料的耐腐蚀性能,这是因为锌层可以将基体与腐蚀介质隔离,另外锌层破损后也可作为牺牲阳极对基体起到保护作用。镀锌钢板在不同的腐蚀环境中具有不同的腐蚀特点,最常见的是大气环境腐蚀[1-3]。海洋大气环境中由于电解质溶液的存在以及氯离子的加速腐蚀作用,成为镀锌钢板耐腐蚀性能研究的重点领域[4-6]。
镀锌钢板的腐蚀可以被分为三个阶段[7-10]:首先,锌层完整覆盖于基体表面,锌层发生腐蚀;然后,锌层发生破坏,锌及锌的部分腐蚀产物对基体进行保护;最后,锌层基本失效,基体发生腐蚀。FUJITA等[11]通过在实际服役条件和室内加速腐蚀试验条件下锌和锌合金镀层汽车板的腐蚀研究发现,镀层厚度是影响耐腐蚀性能的重要因素;DILER等[12]研究了锌和Zn-Mg-Al镀层钢板在海洋大气中的耐腐蚀性能,发现镀层中添加铝和镁可有效提高其耐蚀性;GRANESE等[13]的研究表明,相对湿度较高的环境中存在的氯离子会加速镀锌钢板的腐蚀;SUN等[14]研究了模拟锈层溶液中氯离子浓度对镀锌钢板腐蚀行为的影响,结果表明镀锌钢板在0.1~0.6 mol/L氯化物浓度范围内更易发生点蚀;CHEN等[15]进行的室内模拟加速试验结果表明,氯离子容易破坏镀锌钢板表面的氧化膜从而加剧局部腐蚀;SVENSSON等[16]的研究表明,在相对湿度较高的环境中存在的氯离子易溶解于金属表面吸附凝结的水膜中,加剧大气环境中锌的腐蚀。但目前研究的镀锌钢板强度普遍较低。随着对钢铁材料的深入研究以及对钢铁材料更高性能的需求,对超高强度镀锌钢板腐蚀性能的研究迫在眉睫。本工作通过中性盐雾试验对1 000 MPa级热镀锌钢板进行了模拟海洋大气环境中的腐蚀加速试验,并通过激光共聚焦显微镜、扫描电镜和电化学测试等手段对不同时间腐蚀试验后的样品进行了腐蚀性能和机理的研究。
1 试验
1.1 试验材料
试验材料为热镀锌钢板,平均抗拉强度达到1 029 MPa。镀锌钢板板厚为1.6 mm,双面镀锌,双面锌层总厚度为140 g/m2。镀层的化学成分(质量分数)为99.8% Zn,0.205% Al,0.006 38% Fe,0.003 1% Pb。
1.2 盐雾试验
将镀锌钢板加工成尺寸为150 mm×70 mm盐雾试验用试样,使用丙酮除油和乙醇清洗试样,并吹干。使用环氧树脂和硅胶封住试样边缘无锌层覆盖的位置。
中性盐雾试验根据 GB/T 10125-2012《人造气氛腐蚀试验 盐雾试验》标准进行,试验仪器为CCX2000盐雾试验箱,喷雾方式为连续喷雾,气氛温度为(35±2) ℃。试样放置角度与垂直方向成(20±5)°。腐蚀介质为质量分数5%的NaCl溶液。总测试时间为120 h。分别在盐雾腐蚀0,6,24,30,48,72,96,120 h后,取出试样。使用数码相机、激光共聚焦显微镜和扫描电镜观察试样宏微观腐蚀形貌,采用扫描电镜附带的能谱仪(EDS)对腐蚀试样表面的元素分布进行面扫描,并使用D8 Advance X射线衍射仪(XRD)对试样表面腐蚀产物进行测定。按照GB/T 16545-2015《金属和合金的腐蚀 腐蚀试样上腐蚀产物的清除》使用三氧化铬溶液清除试样表面腐蚀产物,采用失重法计算腐蚀速率,用激光共聚焦显微镜观察其形貌。
1.3 电化学试验
将盐雾腐蚀不同时间后的镀锌钢板加工成电极试样(工作区域为10 mm×10 mm)用于电化学试验。
电化学测试在Princeton VersaSTAT Multichannel多通道电化学工作站上进行。腐蚀溶液为质量分数3.5%的NaCl溶液。采用三电极体系,以饱和甘汞电极为参比电极,铂电极为辅助电极,镀锌钢板为工作电极。电化学阻抗谱测量频率范围为0.01~10 000 Hz,幅值为10 mV;极化曲线的扫描范围为-0.5~1.0 V(相对于开路电位),扫描速率为0.5 mV/s。所有电化学测试在室温下进行。
2 结果与讨论
2.1 表面形貌
图1显示了经不同时间盐雾腐蚀后镀锌钢板表面的宏观腐蚀形貌。结果表明:盐雾试验前,试样表面完好,具有金属光泽;经过6 h盐雾试验后,镀锌钢板表面失去金属光泽,并且出现许多不连续的白色斑点,锌的腐蚀产物白锈产生;随着盐雾试验时间的延长,白锈面积不断扩大,锈层厚度肉眼可见增加;盐雾试验48 h后,白锈基本完全覆盖试样表面,且很多位置出现较深的沟壑状腐蚀坑;盐雾试验72 h后,试样表面出现零星的红锈斑点,基体开始发生腐蚀,钢的腐蚀产物产生;随后红锈快速产生和发展,盐雾试验96 h后,已有大面积的红锈产生,120 h后腐蚀产物整体颜色加深,基体明显遭到较为严重的腐蚀。
图2是使用激光共聚焦显微镜观测的不同时间盐雾腐蚀后试样表面3D形貌图,该形貌图较为清晰地展示了盐雾试验时间不断延长时试样表面腐蚀的产生和发展。结合图3腐蚀坑的形貌,可以看出:在腐蚀发生的初期,锌层首先发生腐蚀,腐蚀方式以点蚀为主,点蚀坑直径基本在1.5~2.5 μm,且随着盐雾试验时间的延长没有明显径向增长的趋势[17];随着盐雾试验的继续,点蚀坑数量迅速增多,深度增大,且很快出现成片的腐蚀区域;随后腐蚀不断向均匀腐蚀发展,试样表层的锌层不断消耗,并且腐蚀72 h后开始出现了铁锈的痕迹,基体逐渐开始暴露。

(a) 0 h (b) 6 h (c) 24 h (d) 30 h

(e) 48 h (f) 72 h (g) 96 h (h) 120 h图1 盐雾腐蚀不同时间后试样表面的宏观形貌Fig. 1 Macro morphology of specimen surfaces corroded by salt-spray for different periods of time
图4为盐雾腐蚀不同时间后镀锌钢板表面SEM形貌以及部分元素分布图。从图中可以看出,在盐雾试验前,试样表面较为完好,偶尔可见轻微镀锌缺陷,锌元素覆盖整个表面,但难以避免地出现极少氧元素。当盐雾试验进行至6 h时,试样表面迅速产生针絮状腐蚀产物,密集分布于表面,且针絮无指向性,产物较为疏松,偶见腐蚀轻微区域和紧凑型腐蚀产物;此时试样表面相对平整,腐蚀深度较浅,而氧元素含量激增,说明表面锌层快速发生氧化。当盐雾试验进行至24 h时,试样表面不平整,腐蚀加剧,除了出现针絮状产物,还出现了不规则小块状产物;试样表面EDS面扫描结果显示,块状腐蚀产物位置有较多氯元素和较少氧元素分布,结合OHTSUKA等[18]的研究,氯离子的存在破坏了锌的氧化层引发了局部腐蚀,造成这些区域针絮状腐蚀产物过早失去尖锐部分呈现糊状,加速了镀锌钢板的腐蚀。当盐雾试验进行至48 h时,试样表面已形成较多相对致密的板带状产物,这些板带状产物上附着有团簇状产物,板带状产物间隙间也密集地分布有团簇状产物;从元素分析上看,此时锌、氧等元素分布较为均匀,几乎检测不到铁元素。当盐雾试验进行至96 h时,锌层持续遭到破坏,致密的团簇状腐蚀产物不断减少,残存的板带状腐蚀产物遭到进一步腐蚀,呈沟壑状,部分遭到破坏的位置检测到了较多的氯元素,说明相对致密的板带状腐蚀产物的解体和流失是受到了氯离子的影响。盐雾试验进行至120 h时,锌层基本失效,检测到了较多的铁元素分布。
图5主要为中性盐雾试验过程中各典型腐蚀产

(a) 0 h(b) 24 h(c) 30 h

(d) 48 h(e) 72 h(f) 96 h图2 盐雾腐蚀不同时间后试样表面的3D形貌Fig. 2 3D morphology of specimen surfaces corroded by salt-spray for different periods of time

(a) 6 h,低倍(b) 6 h,高倍

(c) 24 h,低倍(d) 24 h,高倍

(e) 72 h,低倍(f) 72 h,高倍图3 盐雾腐蚀不同时间后试样表面腐蚀坑的激光共聚焦形貌Fig. 3 CSLM morphology of pits on specimen surfaces corroded by salt-spray for different periods of time at low (a,c,e) and high (b,d,f) magnifications
物的XRD谱。盐雾试验后镀锌钢板的腐蚀产物主要有针絮状、团簇状、板带状以及基体的沟壑状腐蚀产物。EDS能谱分析结果表明,腐蚀过程中腐蚀产物的组成元素主要为锌、氧、氯、碳、铁等元素,且同一腐蚀时间的腐蚀产物在元素构成、元素比例等方面均无较大差异。由图5可见:在盐雾试验开始阶段纯锌层表面迅速生成非晶态Zn(OH)2,并且很快转变为β-Zn(OH)2,随后会脱水成为ZnO。由于环境中存在较多氯离子,氯离子会与锌的氧化物结合并产生破坏作用,在盐雾试验48 h后就明显有Zn5(OH)8Cl2·H2O生成。除此之外,长时间的盐雾试验还会生成Zn5(CO3)2(OH)6。当盐雾试验进行至120h时,基体很大程度暴露出来遭到严重腐蚀,产物中有大量的Fe2O3。腐蚀过程中,阳极反应主要是Zn失去电子变为Zn2+,阴极反应主要是O2得到电子和H2O生成OH-,最初的反应为

(1)

(2)

(3)

(4)
盐雾氛围中氯离子的存在会对锌层表面的氧化层进行破坏,具体反应为

(5)
长时间盐雾试验后,CO2会参与镀锌钢板表面的腐蚀反应生成Zn5(CO3)2(OH)6,反应式为

(6)
最后,基体暴露发生氧化反应

(7)
2.2 腐蚀速率
采用失重法计算盐雾腐蚀不同时间后镀锌钢板的腐蚀速率,计算式为

(8)
式中:v为腐蚀速率;m0为盐雾试验前试样的质量;mt为经不同时间盐雾腐蚀后试样的质量;S为试样表面暴露面积;t为盐雾腐蚀时间。
图6为盐雾腐蚀不同时间后试样的腐蚀速率。从图中可以看出,镀锌钢板的腐蚀速率整体上呈现出先上升后下降的趋势。在6~30 h时,腐蚀速率迅速上升,镀锌钢板表面锌层质量损失较快,此时锌层迅速氧化但腐蚀产物较为疏松,氯离子的存在也加速了氧化层的局部腐蚀,腐蚀程度随着盐雾腐蚀时间的延长而变得严重。48 h左右时,试样的腐蚀速率趋于平缓,此时镀锌钢板表面腐蚀产物以较为致密的团簇状和板带状产物为主,团簇状产物既附着于板带状产物之上,又密集分布于板带状产物之间,从而延缓了腐蚀介质的深入腐蚀,使试样表面进入腐蚀的平台期。在72~96 h时,试样腐蚀速率有小幅度的升高。随后基体开始暴露,锌层基本失效,腐蚀速率下降。腐蚀速率的变化主要反映了试样表面腐蚀状态的发展,和腐蚀产物种类、存在状态均有关系。锌镀层在大气环境中的优良耐蚀性与锌表面腐蚀产物的致密度、腐蚀产物与表面的黏结力有关[17]。在大气腐蚀中,起初形成的腐蚀产物疏松地附着在材料表面,但是随着潮湿环境的持续,腐蚀产物逐渐变得致密,黏附力增大。形成这种腐蚀产物层之后,进一步的腐蚀优先在锌层表面没有被覆盖的孔隙中进行,而被腐蚀产物覆盖的表面则腐蚀过程减缓。这是一个动态过程,随着时间的推进,有些孔隙被新形成的腐蚀产物所覆盖,而有些位置的腐蚀产物则发生溶解。腐蚀产物层越致密和连续,对应位置的活性表面积越小,腐蚀速率也越小。

(a) 0 h(b) 6 h(c) 24 h

(d) 48 h(e) 96 h(f) 120 h图4 盐雾腐蚀不同时间后试样表面SEM形貌及部分元素分布Fig. 4 SEM morphology and element distribution of specimen surfaces corroded by salt-spray for different periods of time

图5 盐雾腐蚀不同时间后试样表面腐蚀产物的XRD谱Fig. 5 XRD pattern of corrosion products on specimen surfaces corroded by salt-spray for different periods of time

图6 盐雾腐蚀不同时间后试样的腐蚀速率Fig. 6 Corrosion rate of specimens corroded by salt-spray for different periods of time
2.3 电化学性能
图7为盐雾腐蚀不同时间后的试样在质量分数为3.5%的NaCl溶液中的开路电位。一般认为,开路电位越负,材料的表面活性越大。盐雾腐蚀时间为0 h时,锌层较为活泼,开路电位较低。随着盐雾试验的开始,开路电位迅速发生正移,表明腐蚀产物的产生一定程度上降低了表面活性。在盐雾试验0~96 h时,开路电位在-1.05 V左右小幅波动,而在120 h时开路电位正移至-0.6 V左右,达到了质量分数为3.5%的NaCl溶液中钢基体的腐蚀电位。由此可以推断,盐雾试验120 h时,锌层基本被完全破坏,暴露出的钢基体受到了全面腐蚀。

图7 盐雾腐蚀不同时间后试样在3.5% NaCl溶液中的开路电位Fig. 7 OCP of specimens corroded by salt-spray for different periods of time in 3.5% NaCl solution
图8为盐雾腐蚀不同时间后试样在质量分数为3.5%的NaCl溶液中的电化学阻抗谱。根据图9所示等效电路模型对电化学阻抗谱进行拟合,结果见表2。结果表明,电化学阻抗谱表现出两个时间常数的特征。在盐雾腐蚀0~30 h时,腐蚀过程由锌的活化溶解控制;而在盐雾腐蚀48~72 h时,低频扩散尾的出现表明此时腐蚀过程由反应离子扩散和活化溶解混合控制[19];在盐雾腐蚀96~120 h时,腐蚀过程由基体的活化溶解控制。

(a) Nyquist图

(b) Bode图图8 盐雾腐蚀不同时间后试样在3.5% NaCl溶液中的电化学阻抗谱Fig. 8 EIS of specimens corroded by salt-spray for different periods of time in 3.5% NaCl solution: (a) Nyquist plots; (b) Bode plots

(a) 模型一
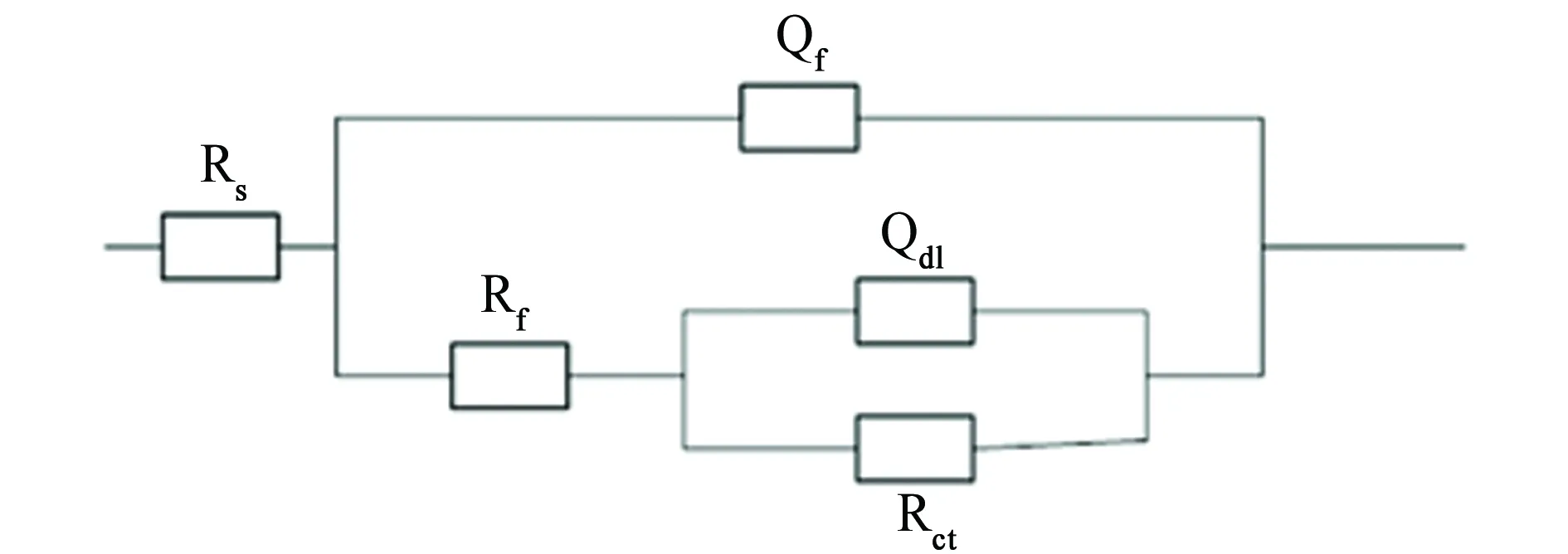
(b) 模型二图9 电化学阻抗谱的等效电路模型Fig. 9 Equivalent circuit models of EIS
图10为盐雾腐蚀不同时间后试样在质量分数为3.5%的NaCl溶液中的极化曲线。由极化曲线阳极和阴极的Tafel斜率可看出,腐蚀过程由阳极和阴极反应混合控制。
通过Tafel拟合得到盐雾腐蚀不同时间后试样的腐蚀电流密度,并对腐蚀时间和腐蚀电流密度作图,如图11所示。结果表明:盐雾腐蚀48 h时,腐蚀电流密度达到其最低点,为3.83 μA/cm2,说明此时致密的腐蚀产物膜对镀锌钢板具有较强的保护性;盐雾腐蚀72 h时,腐蚀电流密度突然升高,这是因为致密的腐蚀产物在氯离子影响下逐渐发生较大规模溶解,产物膜被破坏;之后,钢基体不断暴露,镀锌层保护作用消失,钢的腐蚀占主导地位。
3 结论
(1) 盐雾试验开始后镀锌钢板表面迅速失去金属光泽,发生点蚀。随着腐蚀的不断进行,点蚀坑数量增加、深度增大,逐渐形成连续的腐蚀坑,镀锌钢板向均匀腐蚀发展。盐雾腐蚀72 h后,局部出现铁锈,基体开始暴露。
(2) 腐蚀初期1 000 MPa级镀锌钢板的腐蚀产物蚀以疏松的针絮状产物为主,盐雾腐蚀48 h后,腐蚀产物较为致密,以板带状和附着于板带或密布在板带之间的团簇状产物为主,随后团簇状产物不断流失,板带状产物出现裂痕和凹陷,基体暴露并产生沟壑状腐蚀产物。开始阶段腐蚀产物主要为Zn(OH)2,其迅速脱水成为ZnO,较为致密地覆盖于试样表面。由于盐雾环境中的氯离子与锌氧化物结合生成Zn5(OH)8Cl2·H2O,破坏了氧化层,在盐雾试验进行至48 h时,就明显有Zn5(OH)8Cl2·H2O生成。长时间盐雾腐蚀后,还会生成Zn5(CO3)2(OH)6。当盐雾试验进行至120 h,基体很大程度暴露出来,遭到严重腐蚀,腐蚀产物中有大量的Fe2O3。

表2 电化学阻抗谱的拟合参数Tab. 2 Fitted parameters of EIS

图10 盐雾腐蚀不同时间后试样在3.5% NaCl溶液中的极化曲线Fig. 10 Polarization curves of specimens corroded by salt-spray for different periods of time in 3.5% NaCl solution

图11 盐雾腐蚀不同时间后试样的腐蚀电流密度Fig. 11 Corrosion current density of the samples after salt-spray of different times
(3) 盐雾试验进行48 h时,致密的腐蚀产物限制了腐蚀的快速发展,对应的腐蚀速率和腐蚀电流密度均出现了降低的现象。其中,腐蚀速率降低至0.195 g/(m2·h),腐蚀电流密度降低至3.83 μA/cm2,该时段的腐蚀由反应离子扩散和活化溶解混合控制。
