烟株生长过程中土壤微生物的变化特征
2019-10-25林书震李小龙李红丽詹义忠芦阿虔田艳华
林书震,李小龙,李红丽,詹义忠,芦阿虔,田艳华,王 岩
(1.郑州大学化工与能源学院,河南 郑州 450000;2.南平市烟草公司邵武分公司,福建 邵武 354000)
微生物是土壤的重要组成部分,也是土壤中最活跃的部分[1]。微生物结构和功能多样性对维持土壤系统的健康起着极其重要的作用[2-4],某些土传病害的发生在一定程度上是土壤微生物群体相互作用的结果[5-6]。烟草青枯病是由青枯菌(Ralstonia solanacearum)引起的细菌性土传病害,在我国南方烟区大面积发生,造成大规模减产[7]。青枯病的防控以往都主要集中在抗性育种选育、物理防控、化学试剂防控及改善栽培管理等方面。虽然各类研究成果对青枯病的防控均取得了一定效果,但目前烟草青枯病仍是生产上的一大难题[8-10]。一些关于烟草青枯病防控的研究发现土壤微生物数量和种类会随烟株的生长发生变化[11-13],但基于稀释平板法等传统手段研究土壤中微生物的数量和种类,很难从整体上明晰土壤微生物的变化特征[14],也难以发现具体是哪些微生物与烟草青枯病有关。近年来,分子生物技术快速发展和应用为研究微生物群落结构特征提供了广阔的空间[15]。第二代高通量测序技术能够将实验室不可培养的微生物通过16S/18S rDNA基因测序的方法检测出来,对分析微生物群落组成结构和多样性展现出巨大的优势,成为研究土壤微生物的重要工具[16-17]。
邵武市是福建省烟叶种植面积最大的一个烟区,位于武夷山南麓,生产中烟草青枯病发生较为严重。本试验在邵武市烟区选取代表性烟田,对烟株生长过程中土壤微生物进行16S/18S rDNA基因测序,分析土壤微生物特性、功能及其多样性变化等,探讨烟株生长过程中土壤微生物群落结构及其改变与青枯病发生的内在联系,为定向调控土壤微生物群落结构和土壤健康质量的措施提供理论依据。
1 材料与方法
1.1 试验地点
试验于2017年2~7月在福建省邵武市(N26°55′~ 27°35′,E117°2′~ 117°52′)城郊芹田村、沿山百樵村、沿山上访组、大竹洋坑村4个植烟区进行。气候条件属于中亚热带季风气候区,气候温暖湿润,日照充足,雨量充沛,常年平均降水量1 800 mm左右,年平均气温18℃,试验地点海拔200~250 m。
1.2 试验材料
供试烟田在移栽前以条沟方式施用烟草专用肥,然后在团棵期和旺长期再进行追肥。移栽时施烟叶专用肥25 kg(666.7 m2用量,下同),牛粪有机肥100 kg,钙镁磷肥30 kg,团棵期追施硝酸钾25 kg,旺长期硫酸钾18 kg。烟田土壤类型为沙土、壤质,含水量均在20%~25%之间,其他土壤理化性质见表1。供试烤烟品种为K326。试验地前茬作物均为水稻。

表1 烟田土壤理化性质
1.3 试验设计
试验选取地理位置间隔较远、地势平坦、农业管理措施相同的4个植烟区,每个烟区分别选取土壤类型相同的健康(青枯病发病率低,20%以下)和非健康(青枯病发病率高,20%以上)两块田作为试验田。样本编号Y、T、W、C分别表示烟株移栽前、团棵期、旺长期、采摘期,编号最后的数字1和2分别表示健康烟田和非健康烟田。分别在烟株移栽前、团棵期、旺长期和采摘期采取根部土壤进行可培养微生物数量测定和16S/18S rDNA基因测序,并进行其他理化性状分析。
1.4 测定内容及方法
1.4.1 土样采集
分别在烟株移栽前、团棵期(移栽后40 d)、旺长期(移栽后70 d)和采摘期(移栽后100 d),采用S型五点取样法采取烟株根部土壤。取样时首先去除烟株根部表层土壤,以烟株茎部为中心直径10 cm左右、深10 cm左右处的土壤进行取样。取样后用密封袋低温封存,部分送往实验室在4℃下冷藏以待微生物数量测定,部分用15 mL离心管装满立即送往上海美吉生物医药科技有限公司对微生物进行基因测序。
1.4.2 微生物数量测定
采用稀释平板法[18]测土壤微生物数量。准确称取10 g鲜土,加到盛有90 mL无菌水并带有玻璃珠的三角瓶中,在摇床上以150 r/min震荡30 min,使其充分混匀,静止后吸取5 mL上清液于45 mL无菌水中充分混合均匀得到10-1梯度的溶液,依次稀释至10-1~10-5浓度的土壤溶液待用。吸取200 μ L不同稀释度的土壤溶液涂布在平板上,在培养箱内培养。每个样本选择3个浓度梯度的土壤溶液,每个浓度梯度涂3板,取平板菌落数的平均值计算该样本土壤中微生物的数量。细菌采用牛肉膏蛋白胨培养基,放线菌采用高氏一号培养基,真菌采用孟加拉红培养基。
1.4.3 微生物基因测序
土壤微生物基因测序采用第二代高通量测序技术,对烟株不同生长时期的土壤样本进行细菌(16S rDNA)和真菌(18S rDNA)序列检测。测序原理与步骤如下:
DNA抽提和PCR扩增:根据E.Z.N.A.® soil试剂盒(Omega Bio-tek,Norcross,GA,U.S.)说明书进行总DNA抽提,DNA浓度和纯度利用NanoDrop2000进行检测,利用1%琼脂糖凝胶泳检测DNA提取质量;细菌16S用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和 806R(5’-GGACTACHVGGGTWTCTAAT-3’)引物对V3-V4可变区进行PCR扩增;真菌18S用SSU081F(5’-TTAGCATGGAATAATRRAATAGGA-3’)和 1196R(5’-TCTGGACCTGGTGAGTTTCC-3’)引物对V5-V7可变区进行PCR扩增。
Illumina Miseq测序:使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST(Promega,USA)进行检测定量。根据Illumina MiSeq平台(Illumina,San Diego,USA)标准操作规程将纯化后的扩增片段构建文库,16S为PE 2*300文库,18S为PE2*250文库。用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。原始数据上传至NCBI数据库中。
数据处理:原始测序序列使用Trimmomatic软件质控,使用FLASH软件进行拼接,使用UPARSE软件(version 7.1 http://drive5.com/uparse/),根据97%的相似度对序列进行OTU聚类;使用UCHIME软件剔除嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva数据库(SSU123),设置比对阈值为70%。
1.5 数据计算与统计分析
采用Excel 2010对微生物数量进行计算分析和统计,测序数据在上海某公司提供的I-Sanger生物信息分析云平台进行处理分析。
2 结果与分析
2.1 可培养微生物数量
室内微生物培养结果表明,不同植烟区在烟株生长发育的各个时期土壤微生物的变化特征较为相似(表2),微生物数量为细菌>放线菌>真菌,依次相差一个数量级。烟田土壤整体微生物数量水平偏低,细菌数量级仅有106~107,这可能是酸性土壤不利于细菌生长,这与前人的研究一致[11-13]。细菌数量随着烟株生长发育的进程呈现先增多后减少的趋势,在旺长期数量达到最大,较上一生长时期增加2~5倍;放线菌的数量变化规律与细菌相似,不同的是放线菌数量在团棵期下降,随后在旺长期达到最大;真菌数量随着烟株生长先减少后增多,在旺长期又降至最低。

表2 烟田土壤微生物数量
2.2 测序结果分析
2.2.1 测序结果概述
对各试验田土壤样本中的数据进行处理,得到细菌优化序列数目1 170 563条,真菌1 170 627条。为了研究样品的物种组成多样性,对所有样品的有效序列进行聚类,以97%相似水平将序列聚类成操作分类单元(Operational Taxonomic Units,OTU)。测序结果显示,所有土壤样品中细菌共有49个门,119个纲,246个目,456个科,891个属,1 856个种,6 136个OTU;真菌共有47个门,83个纲,115个目,137个科,171个属,257个种,614个OTU。
2.2.2 细菌群落组成
如果将丰度>10%的细菌划分为优势类群[19],烟株移栽前土壤中细菌在门水平上的优势类群为Proteobacteria(变形菌门)、Acidobacteria(酸杆菌门)、Chloroflexi(绿弯菌门)和Actinobacteria(放线菌门),丰度分别为33.45%±6.58%、18.40%±4.82%、14.79%±4.39%和10.27%±2.44%,占细菌总量的76.91%±1.39%;团棵期优势类群为Proteobacteria(34.50%±2.97%)、Acidobacteria(18.19%±2.23%)和Chloroflexi(14.45%±1.22%),占细菌总量的67.14%±1.46%,其中Actinobacteria丰度在团棵期减少到8.59%±1.13%;旺长期优势类群为Proteobacteria(32.16%±4.57%)、Actinobacteria(18.38%±1.72%)、Chloroflexi(16.14%±3.22%)和Acidobacteria(12.74%±2.70%),占细菌总量的79.43%±2.39%,其中Actinobacteria丰度增长明显,仅次于Proteobacteria;采摘期优势类群为Proteobacteria(30.32%±5.03%)、Actinobacteria(17.92%±2.34%)、Chloroflexi(17.03%±4.00%)和Acidobacteria(12.18%±1.92%),占细菌总量的77.45%±2.07%。
不同植烟区各个时期细菌优势类群Proteobacteria、Acidobacteria、Chloroflexi和Actinobacteria的丰度总和一直稳定在77%左右,如图1所示。烟株移栽前和团棵期的细菌群落结构较为相似,旺长期和采摘期的群落结构较为相似,但旺长期则发生了明显地改变。其中,优势类群中变化最为显著的是Actinobacteria和Acidobacteria。不同植烟区Actinobacteria丰度较团棵期增加了85%~136%,但Acidobacteria丰度减少了15%~56%。丰度低于10%的类群中Firmicutes(厚壁菌门)、Bacteroidetes(拟杆菌门)、Gemmatimonadetes(芽单胞菌门)和Planctomycetes(浮霉菌门)等在烟株生长过程中也发生了较大变化,其中,Firmicutes和Planctomycetes丰度在旺长期较前一时期分别增加了92%~402%和34%~235%,而Bacteroidetes和Gemmatimonadetes丰度分别减少了12%~77%和36%~56%。健康和非健康之间烟田土壤中细菌的群落结构没有明显的差异。

图1 烟田土壤中细菌在门水平上的群落组成
选取相对丰度前20位的属水平上的细菌,根据其在每个样品中的相对丰度信息绘制成热图(图2)。在烟株的整个生长时期,变化较明显的细菌有Nitrospira(硝化螺旋菌属)、Rhodanobacter(产黄杆菌属)、unclassified_f__Micrococcaceae(微球菌科下的属)、norank_p__Saccharibacteria(未分类门下的属)、norank_o__Subgroup_7(酸杆菌纲下的属)、norank_f__Nitrosomonadaceae(亚硝化单胞菌科下的属)、norank_c__JG37-AG-4(绿弯菌门下的属)和Bradyrhizobium(慢生根瘤菌属)。这些细菌均在旺长期前后发生了变化,如Rhodanobacter的相对丰度在团棵期较多,随后在旺长期减少;unclassified_f__Micrococcaceae的相对丰度在团棵期较少,随后增多。

图2 烟田土壤中细菌在属水平上的热图
2.2.3 真菌群落组成
各植烟区不同生长时期的真菌优势类群(>5%)的丰度和一直稳定在90%左右,但其种类和丰度变化明显。由图3可以看出,烟株移栽前真菌在门水平上的优势类群为Ascomycota(子囊菌门)、norank-k-Fungi、Basidiomycota(担子菌门),丰度分别为66.05%±12.33%、13.51%±6.54%和11.27%±6.27%,占真菌总量的90.85%±3.07%;团棵期优势类群为Ascomycota(59.73%±12.86%)、norank-k-Fungi(22.95%±12.06%)和Basidiomycota(6.26%±2.91%), 占 真 菌 总 量 的88.23%±2.42%; 旺长期优势类群只有Ascomycota,丰度到达了89.71%±4.56%,norank-k-Fungi和Basidiomycota丰度分别降到了2.87%±2.67%和4.55%±2.44%,其中norank-k-Fungi丰度减少最明显;采摘期优势类群为Ascomycota(80.94%±7.77%)、Basidiomycota(6.97%±3.36%),占真菌总量的87.91%±5.65%。Ascomycota在烟田土壤中的丰度最高,旺长期丰度最高,各植烟区较团棵期分别增长了17%~108%,且Ascomycota在非健康烟田土壤中的丰度一直大于健康烟田;norank-k-Fungi丰度在团棵期烟田土壤中最多,旺长期后丰度骤减,不同植烟区分别减少了51%~97%,且norank-k-Fungi在非健康烟田土壤中的丰度一直小于健康烟田;Basidiomycota丰度随烟株生长先减少后增多,移栽前丰度最高,旺长期丰度最低。在<5%的类群中,Chytridiomycota(壶菌门)的变化同样很显著,移栽前和团棵期丰度为2.23%±1.10%,旺长期和采摘期丰度为0.52%±0.37%,平均减少了75%。由此发现烟田土壤中真菌群落结构在烟株生长发育过程中差别较大,其中旺长期变化最为明显。
如图4所示,相对丰度前20位的属水平上的真菌随烟株生长的变化较小。norank_k__Fungi(未分类门下的属)的相对丰度在团棵期后明显减少;Pseudallescheria(假霉样真菌属)、unclassified_o__Pezizales(盘菌目下的属)属于子囊菌门,在采摘期明显增多。这与门水平上的分析一致。
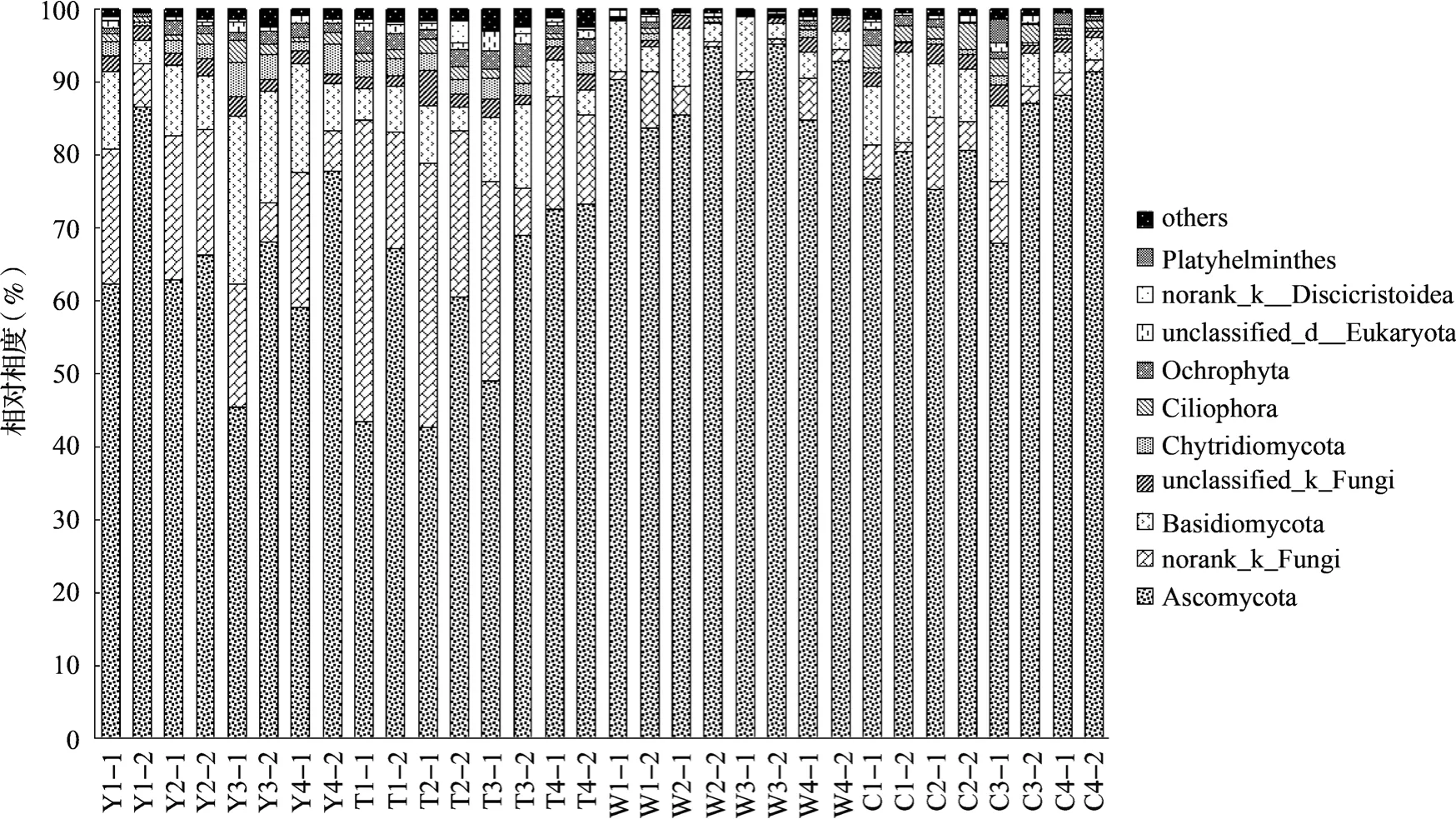
图3 烟田土壤中真菌在门水平上的群落组成

图4 烟田土壤中真菌在属水平上的热图
2.3 烟田土壤微生物多样性
2.3.1 微生物Alpha多样性
环境中微生物的多样性(Alpha)分析可以反映微生物群落的丰度和多样性变化(表3)。Coverage指数是指各样本文库的覆盖率,其数值越高,则样本中序列被测出的概率越高,而没有被测出的概率越低。本实验中各样本细菌的Coverage值都在94%以上,真菌的Coverage值都在99%以上,表明本次测序结果能够代表样本中微生物的真实情况。Sobs(the observed richness)值表示丰富度实际观测值,既OTU数目。本实验中细菌Sobs指数在各生长时期差异不大,非健康烟田土壤中Sobs有先增长后减少的趋势;真菌Sobs指数在旺长期最少。Chao指数反映群落丰富度(Community richness),指数越大群落丰富度越高;Shannon指数能反映群落多样性(Community diversity),Shannon指数值越大,说明群落多样性越高。非健康烟田土壤中细菌的Chao、Shannon指数均值在烟株团棵期时达到最高,随后逐渐降低,表明细菌群落在烟株团棵期时最为丰富、多样性最高,而健康土壤中细菌的多样性指数没有明显规律;真菌的Chao、Shannon指数均在烟株的旺长期时最低,与稀释平板法中真菌的数量相吻合,表明真菌群落在烟株旺长期时丰富度降低、多样性减少。健康和非健康烟田之间土壤微生物的Alpha多样性没有显著性差异。

表3 烟田土壤中微生物的Alpha多样性
2.3.2 微生物样本层级聚类分析
研究不同样本的相似性和差异关系,可对样本距离矩阵进行聚类分析,构建样本层级聚类树。图5是分别将烟田土壤样本中的细菌和真菌进行层级聚类分析。从a图中发现除了移栽前的Y1-2样本,移栽前和团棵期样本聚在同一树枝上,旺长期和采摘期样本聚在同一树枝上。从a图中还可以发现,移栽前和旺长期所有属于健康烟田的样本距离较近,健康与非健康烟田土壤样本明显分开。旺长期和采摘期也是相似的规律。这说明不仅烟株生长改变了土壤中细菌的群落结构,而且青枯病发生也可能影响了土壤中细菌群落结构的变化,即导致健康与非健康烟田土壤细菌群落结构间出现了较大差异。对烟田土壤样本的真菌进行层级聚类分析发现,前两个时期样本聚在一起,后两个时期样本聚在一起,而健康和非健康土壤样本之间没有明显的聚类,表明只有烟株生长对真菌的群落组成的影响程度较大。
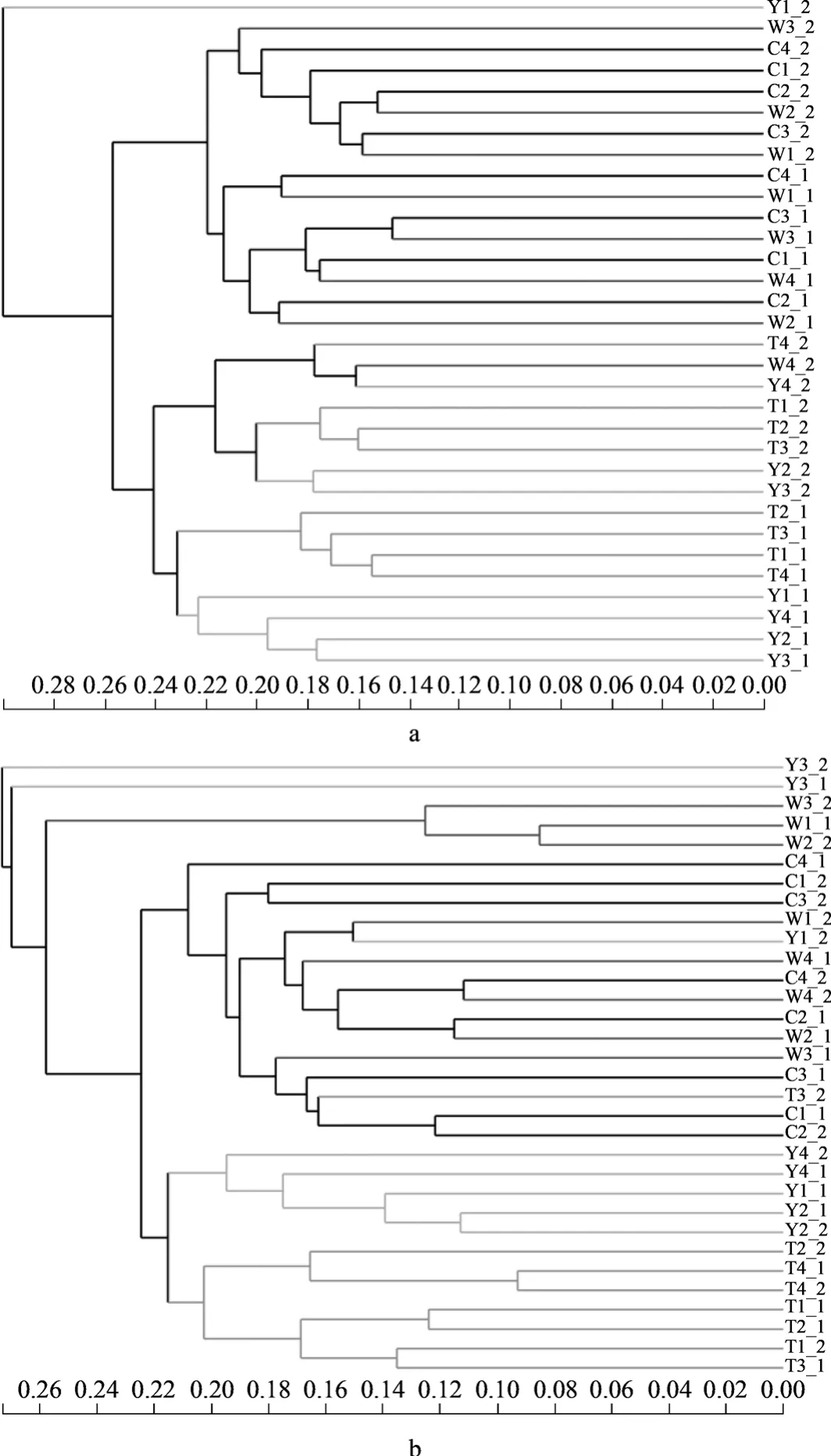
图5 烟田土壤微生物在OTU水平上的层级聚类分析
2.3.3 微生物物种差异分析
根据得到的群落丰度数据进行组间差异显著性检验,可以检测不同组(样本)微生物群落中丰富度差异的物种,并通过假设性检验评估观察其差异的显著性。比较本实验所有植烟区的4个时期结果(图6和图7)发现,门水平上细菌优势菌群Acidobacteria和Actinobacteria的P值分别为0.000 509 5和 1.13×10-10, 远 小 于 0.001, 表 明这两种菌群在不同时期丰度变化显著。除此之外,Firmicutes、Bacteroidetes、Gemmatimonadetes、Planctomycetes等菌群的P值也小于0.001。真菌优势类群中Ascomycota和norank-k-Fungi的P值分别为0.000 039 95和0.000 560 1,表明这两种菌群在整个烟株生长过程中变化显著。烟田土壤中多种微生物丰度都随烟株生长发生明显变化,这些微生物菌群改变了土壤微生物群落结构,从而导致烟田土壤健康状况发生了改变。属水平上,细菌除相对丰度最高的norank_ f__Acidobacteriaceae__Subgroup_1_(酸杆菌科下的属),其它均在整个生长时期发生显著变化。真菌中变化最显著的仍是norank_k__Fungi,其它具有显著差异的菌种均属于子囊菌门。

图6 烟田土壤微生物在门水平上的物种差异分析

图7 烟田土壤微生物在属水平上的物种差异分析
3 小结与讨论
土壤微生物与植物关系十分密切,植物在生长过程中主要通过根系分泌物影响根际微生物的群落结构[20]。本实验中烟株在旺长期对土壤微生物的数量和群落结构影响最大。细菌和放线菌在旺长期数量最多,是因为旺长期烟株根系大量可溶性的分泌物为细菌提供了足够的有效性碳源所致。烟株生长的后期根系分泌物减少,土壤中细菌数量随之减少[21]。真菌数量变化规律和细菌、放线菌刚好相反,可能是因为真菌属于真核生物,受环境变化反应较慢,细菌、放线菌在旺长阶段大量繁殖争夺营养资源、空间资源等迫使真菌生长受到了限制;也有可能是真菌Ascomycota在烟株旺长期的大量增殖抑制了其它真菌的生长,从而使真菌的整体数量减少。以往的研究发现,提高土壤细菌微生物多样性能够降低烟草青枯病的发病率[22],而邵武地区烟田土壤微生物的群落多样性指数均较高,且健康和非健康烟田之间也无明显差异。这可能是因为当土壤微生物具有高水平的多样性时,可能会达不到预期的抑病-多样性关系的发展[23]。
旺长期是土壤微生物群落结构发生显著变化的重要时期。细菌Acidobacteria、Bacteroidetes、Gemmatimonadetes等丰度减少,Actinobacteria、Firmicutes、Planctomycetes等丰度增多,这些细菌微生物所共同构成的土壤微生物区系可能与烟草青枯病的爆发存在一定的联系。Actinobacteria中的微球菌科(Micrococcaceae)丰度在旺长期较团棵期增加了4.71倍,且健康烟田土壤中该菌的丰度高于非健康烟田土壤,Wu等[24]通过试验对照发现,石灰+碳酸氢铵+生物有机肥处理后烟草青枯病发病率降低,微球菌科的丰度在处理组的丰度明显高于对照组,说明微球菌对烟草青枯病发生有一定的抑制作用。Firmicutes中的芽孢杆菌属,已有大量的研究证明芽孢杆菌对青枯病的抑制有良好的效果。许多芽孢杆菌能分泌大量的酶和抗生素,苏阿德等[25]发现用芽孢杆菌处理番茄种子能够有效地控制番茄青枯病,其中枯草芽孢杆菌的效果最好,本实验中烟株采摘期土壤中芽孢杆菌属在健康烟田中的丰度高于非健康烟田,也佐证了该论点。邵武烟田土壤中Ascomycota丰度在烟株生长后期高达90%左右,且非健康烟田土壤中的丰度明显大于健康烟田。研究表明部分寄生的子囊菌可引起植物的多种病害[26],土壤中营寄生的子囊菌在烟株旺长期大量增殖并对烟草根部进行破坏,为青枯菌入侵烟株内部提供途径,增加了烟株感染几率。感染青枯病的烟株逐渐死亡后,根部又会聚集大量的腐生类子囊菌,从而继续对周围健康烟株发生破坏作用。Ascomycota(在非健康烟田土壤中丰度较大),可能对烟株健康生长不利,norank-k-Fungi丰度仅次于Ascomycota,在健康烟田土壤中丰度较高,可能表明norank-k-Fungi属于有益菌。因此,上述结果表明,真菌优势菌种Ascomycota、norank-k-Fungi可能与烟草青枯病的发生有关。
烟草青枯病是福建烟草的主要病害,一般在每年4月下旬或5月上旬由南向北开始发生,5月中、下旬遇上适宜的气候(高温多雨)即开始大量爆发[27]。邵武地区烟株5月上旬烟草青枯病开始流行,此时烟株已处于旺长期中后期,土壤微生物数量、群落结构变化最为明显。因此,从本研究的结果进行推论表明,烟株的旺长期是防治青枯病较为关键的时期,在旺长期施加微生物调控的措施以提高微生物多样性和有益菌数量,减少致病菌特别是Ascomycota数量,维持和稳定土壤微生态的健康,可预防青枯病等土传病害的发生。
