参附注射液联合阿奇霉素治疗小儿支原体肺炎的临床疗效及机制
2019-10-24封其华
张 军,封其华
(1. 苏州大学附属儿童医院风湿免疫科,江苏苏州 215025;2. 宿迁市第一人民医院儿科,江苏宿迁 223899)
近年来,肺炎支原体感染(mycoplasma pneumonia infection, MP)约占小儿肺炎发生率的10%~20%,逐渐成为小儿感染性呼吸道疾病的主要病原体之一。MP不仅可继发咽炎、扁桃体炎等呼吸道多种感染,甚至还可导致脑膜炎、肝炎、心肌炎等,严重时也可导致患儿死亡[1]。目前,临床上治疗支原体肺炎常用药物是以阿奇霉素为代表的大环内酯类抗生素为主,但是近年来病原体对大环内酯类抗生素耐药性显著增加。因此,寻找适当的联合用药可更好促进大环内酯类抗生素的临床疗效,降低其副作用。现代医学认为小儿肺炎的发病机制与病菌入侵、免疫功能紊乱有关[2]。参附注射液属于临床常见中成药,主要含人参皂苷和水溶性生物碱,对免疫、心脏等均具有明显调理作用[3]。本研究拟观察参附注射液联合阿奇霉素治疗小儿MP的临床疗效,并探讨其可能的分子机制。
1 资料与方法
1.1 一般资料选取2016年6月-2017年6月于苏州大学附属儿童医院风湿免疫科收治的肺炎患儿80例为研究对象,其中男46例,女34例;年龄2月~12岁,平均年龄(6.2±3.8)岁,病程5~14 d。用随机数字法将入选病例随机分为2组,每组40例,其中观察组男性24例,女性16例;对照组男性22例,女性18例。两组之间性别、年龄、病程、阿奇霉素药敏实验等资料差异均无统计学意义(P>0.05)。
1.2 诊断标准及治疗方法在入组肺炎患儿中,诊断为MP的依据[4]:以发热、咳嗽为主要症状;胸片显示肺部云雾状或扇状游走阴影等;ELISA法检测血中MP-IgM结果为阳性(滴度≥1∶64)。同时排除病程长于14 d;重症肺炎;伴有其他系统严重疾病者;已接受其他相关治疗者。
两组患儿入院后均给予止咳、平喘、退热、祛痰、补液等常规对症处理。对照组给予阿奇霉素10 mg/kg,静脉滴入,每日1次,共3 d。观察组在对照组的基础上同时予以参附注射液,100 mL/(次•d),溶于50 g/L葡萄糖注射液250 mL,静脉滴入,1次/d,共3 d。两组均在症状、体征、X线表现及肺炎支原体滴度恢复正常时停药。
1.3 观察指标两组在治疗前后均常规检查血、尿及大便常规和肝肾功能、胸片及肺炎支原体滴度等。观察两组治疗前后咳嗽持续时间、肺部啰音消失时间、退热时间、X线阴影吸收时间。记录两组治疗前及治疗后第7天时CD3+、CD4+、CD8+T细胞亚群比例及CD4+/CD8+比值。
1.4 疗效及不良反应判定参照疗效评定标准[5]如下。治愈:患儿咳嗽、发热等临床症状消失,肺部无啰音,胸部X线检查恢复正常,肺炎支原体滴度恢复正常;显效:患儿临床症状明显好转,肺部啰音显著减少,胸部X线有一项异常,肺炎支原体滴度恢复正常;有效:患儿临床症状缓解,肺部啰音较前减少,胸部X线仍有阴影,肺炎支原体滴度正常;无效:患儿临床症状无缓解,体征无改善,胸部X线未明显改变,肺炎支原体检测仍阳性。有效率=(治愈+显效+有效)例数/总例数×100%。不良反应主要指:口干舌燥、面部潮红、心悸、血压升高、恶心、头痛、大便干燥等。
1.5 人淋巴细胞分离取患儿新鲜抗凝血2 mL,混入2 mL Hank’s液,再加入等体积的淋巴细胞分离液,以1 000 r/min离心15 min,收集第二层环状乳白色淋巴细胞层,放入4 mL细胞洗涤液中,再次离心20 min,弃上清,重复2次后即可获得人T淋巴细胞,用于后续实验。
1.6 miR-181a转染用慢病毒将miR-181a转染入人T淋巴细胞中。在装有miR-181a mimics(购自广州锐博生物公司)EP管中加入250 μL DEPC水,取20 μL miR-181a mimics与500 μL opti-MEM混合,轻轻吹打均匀后室温作用25 min,在60 mm培养皿(细胞数约为7.0×105)中加入4 mL无血清DMEM和混合的opti-MEM,培养6 h,弃去无血清DMEM后正常培养。
1.7 miR-181a的检测按照TaKaRa RNA Extraction试剂盒的操作步骤,从人T淋巴细胞中提取总RNA。采用加尾反转录法,按试剂盒(Bulge-LoopTMmiRNA-181a qPCR,购自广州锐博生物公司)的操作步骤,从提取的总RNA中检测患儿血浆中miR-181a水平。
1.8 MTT法检测按照实验要求,取1×104的转染miR-181a的或正常的人T淋巴细胞孵育在96孔板内,分别孵育12、24、36、48、72 h,加入20 μL MTT溶液(5 mg/mL),继续培养4 h。终止培养并离心,吸弃培养液后,加入150 μL二甲基亚砜,摇床震荡10 min,于490 nm读取吸光度(A)值。
1.9 ELISA检测取小儿血清或1.7项中的细胞培养上清,按照ELISA试剂盒说明书操作方法包被、加样、加酶标抗体(细胞因子IL-2、IL-22、IFN-γ和TNF-β)及底物显色液、于450 nm处读取A值。
1.10 荧光素酶报告试验使用PBS清洗分离后的人T淋巴细胞(来自前文1.5项中步骤),弃清洗液。向96孔板中加入20 μL的PLB(passive lysis buffer)溶液,于室温轻缓摇晃15 min,转移至检测试管中,使用荧光发光仪(Promega GLOMAX)对样品进行检测[3]。
1.11 Q-PCR检测细胞因子mRNA表达按照实验要求,于不同组(转染miR-181a或正常)的人T淋巴细胞中加入Trizol(Invitrogen)溶液进行吹打,按照试剂盒的说明依序加入氯仿、乙醇、异丙醇等试剂,最终加入DEPC水对DNA进行溶解。按照q-PCR试剂盒的操作步骤,检测细胞因子IL-2、IL-22、IFN-γ、TNF-β的mRNA表达,各引物序列见表1。
表1 IL-2、IL-22、IFN-γ、TNF-β的引物序列
Tab.1 The primers of IL-2, IL-22, IFN-γ and TNF-β

基因引物序列IL-2Forward: 5'-TACAAGAACCCGAAACTGACTCG-3'Reverse: 5'-ACATGAAGGTAGTCTCACTGCC-3'IL-22Forward: 5'-GCTTGACAAGTCCAACTTCCA-3'Reverse: 5'-GCTCACTCATACTGACTCCGT-3'IFN-γForward: 5'-TCGGTAACTGACTTGAATGTCCA-3'Reverse: 5'-TCGCTTCCCTGTTTTAGCTGC-3'TNF-βForward: 5'-ATGACACCACCTGAACGTCTC-3'Reverse: 5'-CTCTCCAGAGCAGTGAGTTCT-3'
1.12 免疫印迹使用RIPA细胞裂解液对人T淋巴细胞(来自前文1.5项中步骤)提取蛋白,经电泳、转膜、封闭、孵育一抗(1∶2 000)、二抗(1∶8 000)、显影等步骤检测P-AKT和P-MEK蛋白的磷酸化水平。
1.13 统计学处理采用SPSS 17.0软件包进行分析。计量资料予以方差分析,计数资料予以卡方检验,等级资料予以秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患儿临床疗效及不良反应的比较观察组治疗14 d总有效率(95%)显著高于对照组(77.5%),差异具有统计学意义(P<0.05),两组之间不良反应无明显差异(P>0.05,表2)。
2.2 两组患儿症状消失时间的比较与对照组相比,治疗后观察组咳嗽持续时间、肺部啰音消失时间、退热时间和胸部X线阴影消失时间均明显缩短(P<0.05,表3)。
2.3 两组患儿治疗前后T细胞亚群的比较与治疗前相比,两组患儿在治疗后的CD3+、CD4+、CD8+亚群及CD4+/CD8+比例均显著上升(P<0.05);与对照组治疗后相比,观察组治疗后CD3+、CD4+、CD8+亚群及CD4+/CD8+比例均显著上升(P<0.05,表4)。
表2 两组患儿临床疗效及不良反应的比较
Tab.2 Comparison of clinical curative effects and adverse reactions between the two groups [n(%)]

组别n治愈显效有效无效有效率不良反应对照组40 10(25.0) 12(30.0) 9(22.5) 9(22.5)31(77.5) 1(2.5)观察组40 12(30.0) 16(40.0) 10(25.0) 2(5.0)38(95.0)*# 3(7.5)
与对照组相比,*P=0.023(χ2=5.165);与对照组相比,#P=0.008(Mann Whitney U=9.65)。
表3 两组患儿症状消失时间的比较
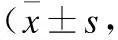

组别n咳嗽持续时间肺部啰音消失时间退热时间胸部X线阴影吸收时间对照组408.5±1.26.5±0.77.5±0.89.5±1.6观察组405.6±0.8*4.2±0.8*5.2±0.9*6.2±1.4*t12.723.4212.089.82P<0.001<0.001<0.001<0.001
与对照组相比,*P<0.05。
表4 两组患儿治疗前后T细胞亚群的比较
Tab.4 Comparison of T lymphocyte subsets before and after treatment between the two groups


组别nCD3+(%)CD4+(%)CD8+(%)CD4+/CD8+对照组治疗前4062.8±7.535.8±5.130.6±3.81.20±0.31对照组治疗后4065.3±8.240.6±5.334.5±4.11.35±0.28F11.24615.72512.14512.27P0.013<0.0010.0040.05观察组治疗前4063.1±7.936.2±4.831.4±4.11.22±0.34观察组治疗后4069.1±7.8*43.2±6.1*34.4±4.6*1.62±0.41*F22.27033.2857.56344.663P<0.001<0.0010.007<0.001
与对照组治疗后相比,*P<0.05。
2.4 两组患儿治疗前后血清炎性因子水平的比较与治疗前相比,两组患儿在治疗后IL-2、IL-22、IFN-γ及TNF-β水平均显著上升(P<0.05);与对照组治疗后相比,观察组治疗后IL-2、IL-22、IFN-γ及TNF-β水平均显著上升(P<0.05,表5)。
2.5 两组患儿治疗前后淋巴细胞内miR-181a水平的比较对照组治疗后miR-181a水平(12.2±4.5)低于治疗前(15.2±3.6)(P<0.05);观察组治疗后的miR-181a水平(9.3±5.3)显著低于治疗前(15.3±3.8)(P<0.05)。与对照组治疗后相比,观察组治疗后淋巴细胞内miR-181a的表达降低更加明显(P<0.05)。
2.6 miR-181a对人T淋巴细胞增殖及分泌细胞因子功能的影响MTT结果(图1)显示,患儿人正常淋巴细胞转染miR-181a组细胞增殖明显低于正常组;转染组细胞上清中细胞因子IL-2、IL-22、IFN-γ及TNF-β也显著下降,差异具有统计学意义(P<0.05)。
2.7 miR-181a在淋巴细胞中的作用靶点通过在线数据库查找,发现miR-181a 3′UTR可以与KRAS、NRAS及MAPK1相结合,通过荧光素酶报告试验发现,miR-181a转染组的KRAS、NRAS及MAPK1表达降低;Western blot结果显示,下游P-AKT和P-MEK也明显降低,差异具有统计学意义(P<0.05,图2)。
表5 两组患儿治疗前后血清炎性因子水平的比较


组别nIL-2(μg/L)IL-22(pg/mL)INF-γ(ng/mL)TNF-β(ng/mL)对照组治疗前404.6±1.320.2±9.410.6±4.722.7±10.5对照组治疗后5.5±0.926.4±11.214.6±2.633.0±9.7F21.62723.25816.35854.523P<0.001<0.001<0.001<0.001观察组治疗前404.9±1.520.6±10.510.8±3.223.6±11.7观察组治疗后6.7±0.8*38.9±10.3*16.8±3.0*44.4±9.0*F35.25644.36829.35258.632P<0.001<0.001<0.001<0.001
与对照组治疗后相比,*P<0.05。
图1 miR-181a在体外对淋巴细胞增殖及分泌细胞因子功能的影响
Fig.1 The effect of miR-181a on lymphocyte proliferation and secretion of cytokinesinvitro
与对照组(Normal)相比,*P<0.05。

图2 miR-181a在淋巴细胞中的作用靶标
Fig.2 The target of miR-181a in lymphocytes
2.8 miR-181a在体内外对细胞因子mRNA水平的影响q-PCR结果显示,与对照组相比,miR-181a可以明显降低IL-2、IL-22、IFN-γ和TNF-β的mRNA表达,差异具有统计学意义;体外ELISA实验结果显示,小儿MP血清中细胞因子IL-2、IL-22、IFN-γ和TNF-β也出现明显下降,差异具有统计学意义(P<0.05,图3)。
2.9 小儿MP的miR-181a表达与血清中细胞因子的相关性分析Person检验发现,在小儿MP中,淋巴细胞miR-181a的表达水平与血清中IL-2、IL-22、IFN-γ和TNF-β的水平明显负相关,具有统计学意义(P<0.05,图4)。

图3 miR-181a在体外对细胞因子表达水平的影响
Fig.3 The effect of miR-181a on cytokines levelinvitro
与对照组(Normal)相比,*P<0.05。


图4 小儿支原体肺炎中miR-181a与血清中细胞因子的相关性Fig.4 Correlation between miR-181a level and serum cytokines level in children with Mycoplasma pneumonia
3 讨 论
MP是小儿临床常见疾病,由肺炎支原体引起的间质性支气管炎、急性细支气管炎等。MP的发病机制目前尚未完全明确,有研究者认为机体免疫功能紊乱在MP发生发展中可能起重要作用。本研究发现,参附注射液联合阿奇霉素相对单独使用阿奇霉素不仅具有更高的治疗有效率,还明显缩短患儿的临床症状持续时间,此外,还发现联合组可以增高CD3+、CD4+、CD8+亚群及CD4+/CD8+比例,提示参附注射液可能通过增强机体免疫功能而提高阿奇霉素治疗MP的疗效。
IL-2和IL-22是T细胞亚群活化的重要效应分子,在调控固有免疫反应、防御和损伤修复方面具有重要作用[6]。IFN-γ和TNF-β广泛参与炎症反应、免疫系统的发育和调节,能够调控机体免疫细胞介导抗炎机制,增强对病原微生物的抵抗作用[6]。本实验检测血清中细胞因子IL-2、IL-22、IFN-γ及TNF-β的水平,发现参附注射液可提高患儿血清中细胞因子水平,增强机体免疫系统以抵抗MP。
众多研究表明,miR-181a在肿瘤、炎症及自体免疫性疾病中都发挥了重要作用[7-8]。小鼠体内过表达miRNA-181a能够促进B淋巴细胞分化,同时使循环T淋巴细胞减少[9]。本研究联合组比单用阿奇霉素组患儿血清miR-181a含量降低,体外MTT实验发现升高miR-181a可以抑制人淋巴细胞增殖,提示miR-181a在机体抵抗MP过程中发挥着一定的作用。有研究报道,miR-181a可以靶向“炎症小体”,可作为炎症反应的“效应器”抑制炎症反应[10]。本研究还发现,升高miR-181a的表达可以抑制淋巴细胞分泌细胞因子IL-2、IL-22、IFN-γ和TNF-β。据此推测,参附注射液通过降低小儿淋巴细胞中miR-181a的表达水平,继而促进细胞因子IL-2、IL-22、IFN-γ及TNF-β的分泌,从而调控机体免疫系统以抗MP。
本研究使用在线数据库(TargetScan和miRWalk)发现miR-181a可以靶向KRAS、NRAS和MAPK1基因[11]。进一步进行荧光素酶报告实验,结果发现miR-181a可以降低KRAS、NRAS和MPAK1的mRNA表达。我们针对KRAS、NRAS和MPAK1基因下游,检测发现AKT和MEK的磷酸化水平明显下降,提示miR-181a通过降低KRAS、NRAS和MPAK1的mRNA表达,从而抑制AKT和MEK的磷酸化,抑制AKT和MAPK通路,抑制淋巴细胞的增殖及功能。
本研究进一步验证了miR-181a可以降低IL-2、IL-22、IFN-γ及TNF-β的mRNA表达,表明miR-181a可以抑制淋巴细胞分泌细胞因子。为了探究miR-181a是否在体内同样发挥着相似功能,我们在80例患儿血清中检测发现IL-2、IL-22、IFN-γ及TNF-β的含量与淋巴细胞中miR-181a的表达水平呈负相关,表明miR-181a在体内依然可以影响淋巴细胞分泌细胞因子的能力,抑制机体抗MP的免疫应答。
综上所述,在阿奇霉素治疗基础上联合参附注射液治疗小儿MP可获得满意疗效,该方案可以有效缓解患儿临床症状,促进患儿免疫功能恢复,其机制可能通过降低淋巴细胞中miR-181a水平,升高AKT和MEK的磷酸化水平,并促进淋巴细胞增值及分泌相关细胞因子而实现。
