IL-22可诱导角质形成细胞双调蛋白表达促进银屑病发病
2019-10-24王丽娟侯卫坤牟宽厚吕社民
韩 丹,王 博,王丽娟,刘 玮,侯卫坤,牟宽厚,吕社民,周 艳
(1. 西安交通大学第一附属医院皮肤科,陕西西安 710061;2. 西安交通大学第一附属医院转化医学中心,陕西西安 710061;3. 西安交通大学附属西安市红会医院关节外科,陕西西安 710054;4. 西安交通大学医学部遗传学与分子生物学系,陕西西安 710061)
近年研究发现,Th22参与了包括寻常型银屑病(psoriasis vulgaris, PsV)在内的多种自身免疫性疾病的发病过程[1]。IL-22是Th22型细胞的代表性细胞因子,IL-22R1为其特异性受体,IL-22与其结合后方可发挥生物学作用[2]。IL-22结合蛋白(IL-22 binding protein, IL-22BP)是IL-22的一种可溶型受体,表达于单核细胞、活化的T细胞和上皮细胞等。IL-22BP与IL-22的亲和力显著高于IL-22R1与IL-22的亲和力,因此,IL-22BP可以中和IL-22在体内的作用[3]。双调蛋白(amphiregulin, AREG)是表皮生长因子家族的成员之一,是一种自分泌生长因子,也是迄今为止角质形成细胞最丰富的表皮生长因子受体配体[4],ZHENG等[5-6]用免疫组化法检测到AREG蛋白在银屑病皮损的高表达,可促使银屑病的表皮增殖。LUO等[7]研究发现,IL-22可上调角质形成细胞系(HaCaT)细胞HB-EGF(表皮生长因子家族成员)表达,提示IL-22参与了表皮生长因子家族的调控功能。目前,尚未见到AREG和IL-22的相关研究报道。因而,本实验分析银屑病患者皮损中IL-22和AREG表达水平及其相关性,并用IL-22刺激培养的角质形成细胞,观察AREG的表达变化,再通过IL-22BP抑制该反应,以期进一步阐明IL-22在银屑病中的作用机制。
1 材料与方法
1.1 对象和组织标本患者皮肤活检标本取自西安交通大学第一附属医院皮肤科。26例PsV患者(18~71岁),平均年龄(39.531±12.402)岁,男14例,女12例,均符合PsV的诊断标准[8]。纳入标准:1月内未接受系统治疗,2周内未使用过外用药物;没有免疫抑制剂应用史;没有严重的系统性疾患。15例健康人(22~57岁)皮肤为对照(healthy control, HC)组,平均年龄(36.927±11.594)岁,男8例,女7例。HC组无银屑病等皮肤疾患病史或任何其他自身免疫性疾病家族史。所有研究对象均签署知情同意书。本研究按照人类伦理委员会程序,遵循赫尔辛基世界医学协会原则,经西安交通大学第一附属医院医学伦理委员会批准。皮肤组织进行手术后,储存在液氮中,准备用于实时定量聚合酶链反应(Real-time quantitative polymerase chain reaction, RT-qPCR)等检测。
1.2 细胞及试剂HaCaT细胞(空军军医大学皮肤科实验室,中国);RPMI-1640培养基(GIBCO公司,美国),胰蛋白酶及EDTA(四季青公司,中国);重组人IL-22(Peprotech公司,美国)及IL-22BP(R&D Systems公司,美国);TRIzol法总RNA抽提试剂盒(Invitrogen公司,美国);IL-22、IL-22R1、IL-22BP、AREG和β-actin引物(奥克公司,中国);cDNA试剂盒(Fermentas公司, 加拿大);SYBR®Premix ExTaqTMⅡ(TaKaRa公司,日本);5-Target qPCR Kit(Bio-Rad公司,美国);兔抗人AREG抗体(Abcam公司,英国);GAPDH(Santa Cruz公司,美国);蛋白酶抑制剂(Beyotime公司,中国);RIPA蛋白裂解液(Cybrdi Biotechnology公司,美国);蛋白定量BCA试剂盒(中国健康元生物有限公司,中国);SDS(Amresco公司,美国)
1.3 角质形成细胞的培养与分组HaCaT细胞用含100 mL/L胎牛血清的RPMI-1640培养基(含100 U/mL青霉素+100 U/mL链霉素),当细胞达到70%~80%融合时,用37 ℃预热的2.5 g/L胰酶+0.5 g/L EDTA进行消化传代。细胞传代2次后,于6孔板中接种细胞数量约3×105/孔,置37 ℃恒温培养箱培养,待细胞平稳生长至70%~80%融合时,换成无血清RPMI-1640培养基,分别加入IL-22以及IL-22+IL-22BP(20 ng/mL)培养24 h。每组平行设3个复孔,对照组为不加药物的无血清的RPMI-1640培养基。24 h后将各组细胞分别离心,收取沉淀的细胞。
1.4 RT-qPCR法检测目的基因mRNA表达将1.1项冷冻保存的每个皮肤组织标本放入研钵中,加入液氮以保持低温,用研杵研磨成粉状,加入1 mL Trizol;按照标准TRIzol法进行RNA抽提;按照Fermentas公司说明书将样品逆转录为cDNA;反应条件设定:95 ℃ 3 min,95 ℃ 10 s,退火20 s,72 ℃ 20 s,总共40个循环。内参为β-actin。所用引物及退火温度信息见表1。应用SYBR®Premix ExTaqTMⅡ荧光染料法进行RT-qPCR反应,mRNA表达量用ΔΔCT法进行计算。1.3项中各组HaCaT细胞亦进行如上检测。
表1 RT-qPCR基因引物信息
Tab.1 Information of gene primers for RT-qPCR

基因名称引物序列(5'-3')产物大小(bp)退火温度(℃)IL-22ForwardCCTATATCACCAACCGCACCTTCReverseAGATTGAGGGAACAGCACTTCTTC17653IL-22R1ForwardTCCAGCCTCACCACTCACAAGReverseTTCATTTCATCTTCACCACAACTCC13061IL-22BPForwardCAGTGGGTAGCAGGAGAAGGACReverseGGAGAGGCAGTGAGCAGGAG10151AREGForwardCTGCCTTTATGTCTGCTGTGReverseTTTCGTTCCTCAGCTTCTCC10361β-actinForwardTCGTGCGTGACATTAAGGAGAAGReverseAGGAAGGAAGGCTGGAAGAGTG17961
1.5 Western blot检测AREG的蛋白表达采用改良型RIPA细胞裂解液(50 mmol/L Tris-HCl pH 7.4,150 mmol/L NaCl,0.2 mmol/L EDTA,10 g/L sodium deoxycholate,10 mL/L Triton X-100,1 g/L SDS)裂解细胞30 min,离心30 min。BCA法测定细胞总蛋白浓度,常规进行SDS-PAGE 凝胶电泳,转膜、封闭后,加AREG抗体(1∶1 000)1 mL置于4 ℃孵育过夜。再加入HRP标记的抗兔二抗(1∶1 000)1 mL,室温孵育1 h,洗膜、显影,置UVP成像系统中摄影,分析AREG与GAPDH的条带灰度值。

2 结 果
2.1 IL-22/IL-22R1以及AREG在PsV患者皮损中高表达RT-qPCR检测显示,PsV(n=26)组皮损中IL-22和IL-22R1的mRNA相对表达明显高于HC组(n=15)(P<0.001),AREG(14.612±3.571)表达亦高于HC(P<0.01),分别升高了36倍、24倍、15倍,差异均有统计学意义。IL-22BP表达与HC组比较差异无统计学意义(P>0.05,图1)。提示IL-22及AREG均参与PsV的发病。
2.2 PsV皮损处IL-22和AREG mRNA表达呈正相关对PsV皮损中IL-22/IL-22R1和AREG mRNA水平的相关性(n=26)分析发现,仅有IL-22与AREG的mRNA水平呈正相关(r=0.49,P<0.05);IL-22R1与AREG的mRNA水平不相关(r=0.29,P>0.05,图2)。提示IL-22有可能影响AREG的表达水平。
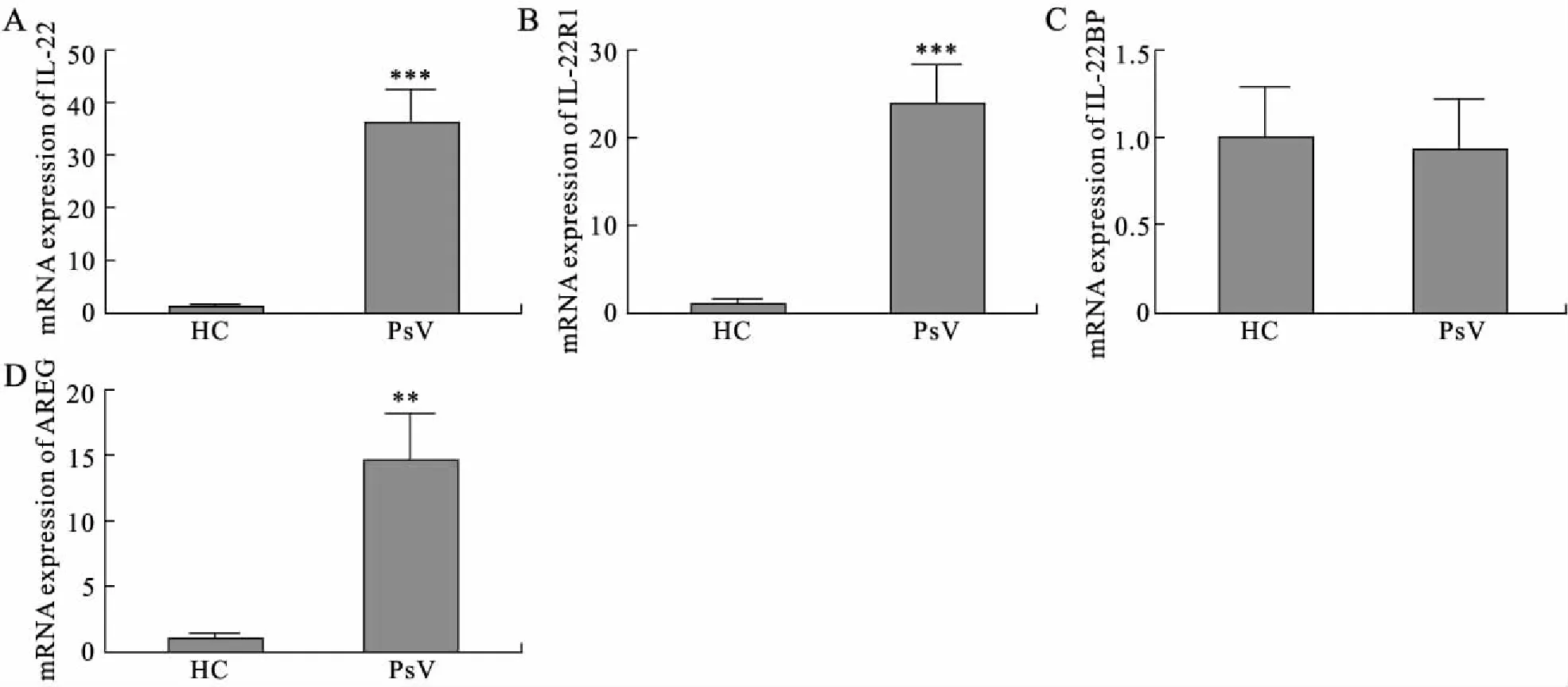

图1 PsV和患者皮损中IL-22/IL-22R1、IL-22BP以及AREG mRNA的表达Fig.1 The mRNA of IL-22/IL-22R, IL-22BP and AREG was increased in lesional skin of PsV与HC组比较,**P<0.01,***P<0.001。
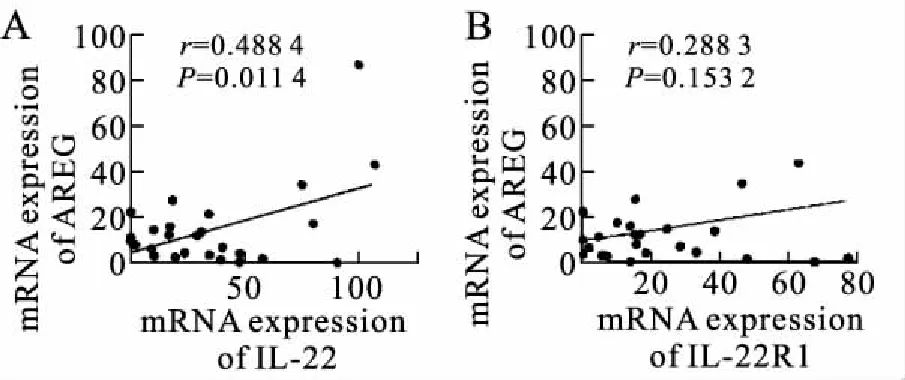
图2 PsV皮损中AREG与IL-22(A)和IL-22R1(B)mRNA表达的相关分析
Fig.2 Positive correlation between the mRNA expression of AREG and IL-22(A)/IL-22R1(B) in lesional skin of PsV
2.3 IL-22可诱导HaCaT细胞AREG mRNA和蛋白表达IL-22干预HaCaT细胞时,AREG mRNA相对表达(22.021±3.757)增高22倍(P<0.01),蛋白灰度表达(5.917±0.991)增高6倍(P<0.01);IL-22BP同时干预可将IL-22所增加的AREG mRNA表达下降75.4%(5.422±1.910)(P<0.01),蛋白表达下降69.2%(1.825±0.260)(P<0.01,图3)。这表明,IL-22可以促使HaCaT细胞产生AREG,该效应可被IL-22BP明显阻断。
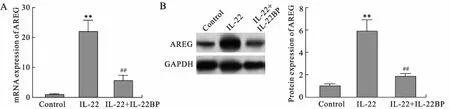
图3 IL-22对HaCaT细胞AREG mRNA和蛋白表达的影响
Fig.3 Effects of mRNA and protein expressions of AREG in HaCaT cells treated with IL-22
3 讨 论
本研究发现,PsV皮损中IL-22和IL-22R1水平均明显高于健康人皮肤。提示PsV皮损内高表达IL-22相关因子,可能为IL-22/IL-22R1介导的免疫失衡所致。有研究表明,IL-22的受体IL-22R1主要表达于银屑病的表皮,提示其在银屑病中的作用仍以角质形成细胞为主[9]。IL-22信号通路影响自身免疫性疾病多个分子进程。然而,大多数研究资料并不确定IL-22是介导炎症反应本身,还是炎症所伴随的附属品[10]。IL-22与IL-17协同作用可以提高银屑病患者抗菌肽的表达[11],更重要的是,IL-22介导表皮棘层增厚和角质细胞分化异常,而这些改变均为银屑病特有的病理变化。ZHENG等[9]用IL-22缺陷老鼠进行研究,发现没有IL-22生成时,IL-23介导的皮肤炎症明显减少。MA等[12]在银屑病小鼠模型注入中和IL-22的抗体后,原皮损所表现的棘层增厚及炎细胞浸润明显缓解。然而,对于IL-22在银屑病中发挥的具体功能及其下游参与基因,值得深入探索和研究。
AREG一直在肿瘤研究中受到高度关注,在多种人类癌症中均有过表达,如结肠癌、乳腺癌、肺癌、肝癌、前列腺癌、胃癌等。在一些异常的表皮增生性皮肤病如银屑病、日光角化病、疣、角化棘皮瘤和皮肤鳞癌中,其表达也有所增加[13]。HaCaT细胞中AREG过表达可增强细胞增殖[14]。LI等[15]发现AREG转基因小鼠可导致与银屑病相似的皮肤过度增殖等表现。AREG在PsV皮损高表达有可能是通过与其受体EGFR结合,在银屑病的表皮增殖和炎症级联中发挥作用。本研究发现,PsV皮损处高表达的IL-22 mRNA水平则与过表达的AREG呈正相关。如果剔除IL-22高表达的样本,尽管存在正相关趋势,但是差异无统计学意义。分析认为,这种相关性在IL-22高表达的银屑病皮损中更加明显,而IL-22低表达的皮损这种正相关几乎不存在,提示高表达的IL-22更有可能影响银屑病皮损AREG的表达水平。这提示AREG在某种条件下可能为IL-22的下游信号之一。细胞实验结果也证实IL-22可能通过促使角质形成细胞的AREG的mRNA和蛋白表达水平增加,进一步发挥其在银屑病中的促进增殖作用。
IL-22BP可通过与IL-22R1竞争而抑制IL-22的上述功能,在本研究细胞刺激实验中,IL-22BP可将IL-22所增加的AREG大部分表达抵消。IL-22BP又称为IL-22RA2,虽然IL-22BP与IL-22R1链具有最高的结构同源性,但IL-22BP对IL-22的亲和力远高于IL-22R1,从而阻止IL-22与IL-22R1的结合[3]。尽管有资料显示,IL-22-IL-22BP轴失衡与银屑病皮炎有关[16],但内源性IL-22BP在影响银屑病角质细胞功能中的作用仍不清楚。FUKAYA等[3]研究证明,IL-22BP主要在C57BL/6构建的咪喹莫特银屑病小鼠的角质形成细胞表达,缺乏IL-22BP时银屑病样皮炎的表皮增生和炎症均会加重,IL-17A、IL-22、IL-1β、CXCL1、MMP9、S100A7等银屑病相关炎性因子均明显增加,真皮中白细胞和γδT细胞明显增多;IL-22BP治疗可减轻银屑病小鼠皮肤病理和炎症的严重程度。这些发现表明,IL-22BP可通过介导角质形成细胞对IL-22信号的自我调节,进而参与银屑病的发病机制。因此,IL-22BP可能成为干预和治疗皮肤自身免疫性和炎症性疾病的一个强有力的靶点。本研究结果发现IL-22BP能够抑制IL-22对角质形成细胞AREG的调节作用,也为未来银屑病的新药研发提供了新的理论依据。
