CNV-seq及染色体核型分析在染色体异常检测中的比较
2019-10-24赵明刚王晓岩
李 翠,赵明刚,贺 芳,王晓岩,李 旭,王 翔
(1. 西安交通大学第一附属医院:1. 转化医学中心;2. 检验科,陕西西安 710061)
人体正常染色体受到某些因素影响后可发生异常改变,包括染色体数目异常和染色体结构畸变。据报道,我国每年出生的染色体异常患儿约10万,在活产儿中,染色体异常的发生率为0.5%~1%[1]。
传统的染色体核型分析技术可以检测染色体数目异常及大于10 Mb的片段缺失、重复、倒位等结构异常,但不能覆盖全基因组,且常难以判断异常染色体片段的来源[2]。染色体微阵列分析技术(chromosomal microarray analysis, CMA)可以提供高分辨率和全基因组范围内染色体不平衡改变的检测,精确定位异常改变的片段[3-4],但CMA芯片成本较高,且无法检测探针未覆盖的染色体区段。因此,临床上亟需一种更经济准确的方法,以便全面准确地检测染色体异常疾病。基因组拷贝数变异测序(copy number variation sequencing, CNV-seq)不仅可以检测CMA芯片平台所覆盖的染色体疾病类型,还可发现芯片探针无法覆盖的染色体的微缺失、微重复,且成本较低,重复性好[5]。
在本研究中,我们对临床发现的42例疑似染色体异常患者进行CNV-seq检测,评估CNV-seq技术在染色体疾病检测中的应用价值。
1 资料与方法
1.1 一般资料选取2018年1月-2018年9月于西安交通大学第一附属医院进行门诊咨询及染色体检查的患者42例,包括进行外周血染色体检查的患者5例,进行羊水染色体检查的患者37例,其中男性3例,女性39例,年龄3~38岁(平均年龄19.7岁)。
1.2 实验方法
1.2.1外周血细胞培养及染色体核型分析 患者签署知情同意书后采集外周血,2 mL EDTA抗凝血用于后续CNV-seq检测,4 mL肝素钠抗凝血进行常规培养、制片后,进行染色体G显带分析。
1.2.2羊膜腔穿刺及羊水染色体核型分析 患者签署知情同意书后,在无菌条件下进行超声下引导穿刺羊水20 mL。15 mL羊水离心后进行细胞培养,常规收获制片后进行染色体G显带分析;5 mL羊水用于后续CNV-seq检测。
1.2.3CNV-seq检测 患者外周血/羊水标本进行DNA提取,构建测序文库并进行质控,然后通过HiSeq 2000测序平台进行CNV-seq检测。
1.2.4CNV-seq检测结果分析 将染色体全基因组测序检测到的基因组CNV参照国际基因组CNV多态性数据库Decipher、UCSC Genome Browser、Online Mendelian Inheritance in Man(OMIM)、International Standards for Cytogenomic Arrays(ISCA)等以及相关文献评估CNV是否致病。检测报告将严格按照美国医学遗传学会指南[6]进行CNVs分级。
2 结 果
2.1 染色体核型分析结果42例标本染色体分析分辨率均在320条带。染色体核型分析结果发现,共存在8例染色体异常,其中染色体结构异常6例,数目异常2例,检出率19.04%。此外,还检出4例为染色体多态性变异,其余30例患者染色体核型分析均未发现明显异常。染色体核型分析异常患者临床资料及检测结果见表1。
表1 染色体核型分析异常患者的临床资料及检测结果
Tab.1 Clinical information and results of patients with chromosome abnormality confirmed by karyotype analysis
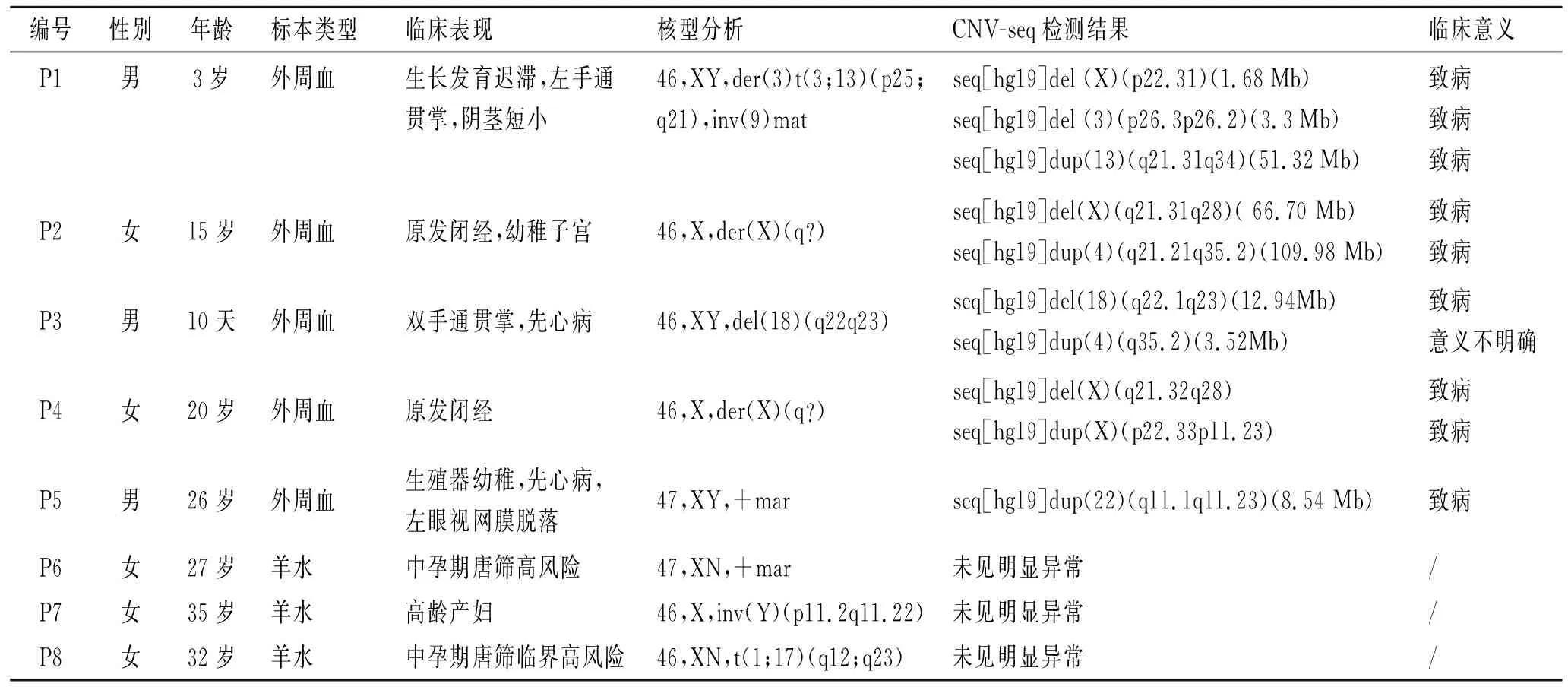
编号性别年龄标本类型临床表现核型分析CNV-seq检测结果临床意义P1男3岁外周血生长发育迟滞,左手通贯掌,阴茎短小46,XY,der(3)t(3;13)(p25;q21),inv(9)matseq[hg19]del (X)(p22.31)(1.68Mb)seq[hg19]del (3)(p26.3p26.2)(3.3Mb)seq[hg19]dup(13)(q21.31q34)(51.32Mb)致病致病致病P2女15岁外周血原发闭经,幼稚子宫46,X,der(X)(q?)seq[hg19]del(X)(q21.31q28)( 66.70 Mb)seq[hg19]dup(4)(q21.21q35.2)(109.98 Mb)致病致病P3男10天外周血双手通贯掌,先心病46,XY,del(18)(q22q23)seq[hg19]del(18)(q22.1q23)(12.94Mb)seq[hg19]dup(4)(q35.2)(3.52Mb)致病意义不明确P4女20岁外周血原发闭经46,X,der(X)(q?)seq[hg19]del(X)(q21.32q28)seq[hg19]dup(X)(p22.33p11.23)致病致病P5男26岁外周血生殖器幼稚,先心病,左眼视网膜脱落47,XY,+marseq[hg19]dup(22)(q11.1q11.23)(8.54 Mb)致病P6女27岁羊水中孕期唐筛高风险47,XN,+mar未见明显异常/P7女35岁羊水高龄产妇46,X,inv(Y)(p11.2q11.22)未见明显异常/P8女32岁羊水中孕期唐筛临界高风险46,XN,t(1;17)(q12;q23)未见明显异常/
2.2 CNV-seq检测结果42例标本均获得有效的测序结果。CNV-seq结果显示,42例标本中,染色体异常7例,检出率为16.67%。在传统染色体核型分析检出的6例染色体结构异常中,CNV-seq结果发现4例存在CNVs;而2例染色体数目异常患者中,1例存在CNV(表1)。在染色体核型分析结果正常的30例患者中,CNV-seq发现2例患者存在片段<10 Mb的CNV变化,其中1例检测结果判读为可能致病的CNV,相关临床资料及检测结果见表2。此外,对染色体核型分析发现的4例染色体多态性变异进行CNV-seq检测,均未检出100 kb以上已知的、明确致病的CNV, 相关临床资料及检测结果见表3。
表2 2例CNV<10 Mb的重复或缺失患者的临床资料及检测结果
Tab.2 Clinical information and results of two patients with chromosome microdeletion and microduplication
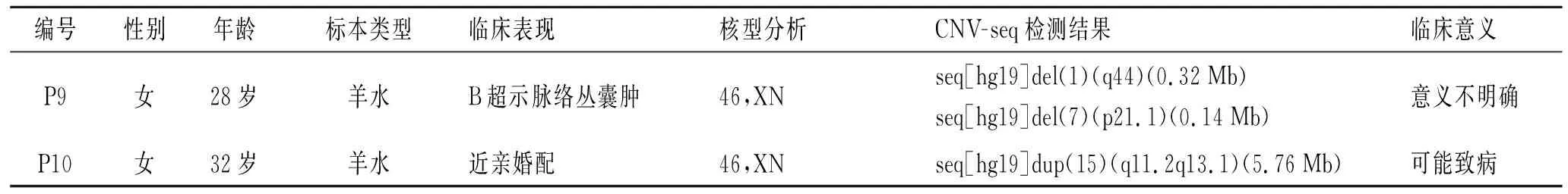
编号性别年龄标本类型临床表现核型分析CNV-seq检测结果临床意义P9女28岁羊水B超示脉络丛囊肿46,XNseq[hg19]del(1)(q44)(0.32Mb)seq[hg19]del(7)(p21.1)(0.14Mb)意义不明确P10女32岁羊水近亲婚配46,XNseq[hg19]dup(15)(q11.2q13.1)(5.76Mb)可能致病
表3 4例染色体多态性变异患者的临床资料及检测结果
Tab.3 Clinical information and results of four patients with chromosome polymorphism

编号性别年龄标本类型临床表现核型分析CNV-seq检测结果临床意义变异来源P11女37岁羊水高龄46,XN,22ps-未见明显异常/父亲P12女31岁羊水B超示脉络丛囊肿46,XN,14pstk+未见明显异常/母亲P13女27岁羊水B超示肠管回声增强46,XN,9qh+未见明显异常/父亲P14女41岁羊水不良孕产史46,XN,inv(9)(p12q13)未见明显异常/父亲
2.3 随访本次研究病例中,共对42例患者进行了染色体核型分析和CNV-seq检测,其中外周血染色体检查的患者5例,羊水染色体检查的患者37例,对所有的患者进行常规随访。37例羊水染色体检查的患者中,1例选择引产,由于在外院引产,未能获取进一步引产情况。其余36位孕妇均已产下表型正常、发育良好的健康活婴,但由于婴儿较小,可能有些表型还未表现出来,我们将会继续跟踪随访。5例外周血染色体检查的患者均进入针对性的临床治疗阶段。
3 讨 论
染色体的数目或结构异常所致的疾病称染色体异常。染色体异常通常表现为先天性智力低下、发育滞后、多发畸形、性发育不全、反复流产及不孕不育等。据文献报道,6.7%~21.4%出生缺陷患儿是由染色体畸变引起的[7]。虽然染色体异常与疾病的关系越来越明显,但目前诊断染色体疾病的金标准仍是染色体核型分析。
染色体核型分析是一种经典的遗传学检测技术,检测步骤相对复杂,技术性要求较强,且分辨率较低。此外,细胞生长状态、显带水平及操作人员的技术水平均会影响最终的实验结果。随着分子遗传学技术快速发展,荧光定量PCR技术(quantitative fluorescent polymerase chain reaction, QF-PCR)、荧光原位杂交技术(fluorescent in situ hybridization, FISH)等已逐渐应用于临床检测中[8-9]。然而,无论是染色体核型分析、QF-PCR,还是FISH检测,都无法对来源未知的染色体片段及染色体微缺失微重复进行快速有效的鉴别。因此,临床急需一种高通量、低成本、易操作的检测技术,以对染色体异常进行快速诊断。
近些年,高通量测序技术迅猛发展,极大地推动了分子技术在临床产前筛查、遗传病检测、肿瘤检测、微生物病原体检测及器官移植排斥筛查等方面的应用[10]。高通量测序技术又称下一代测序(next generation sequencing, NGS),是一种直接测序法,能在同一时间对上百万DNA片段进行测序,大大提高了测序效率。与传统的染色体核型分析及CMA检测相比,CNV-seq技术以高通量测序技术为基础,无需细胞培养,且不受探针种类及通量的限制,具有检测范围广、操作简便、通量高及成本低等优势[11]。国内外研究者均对CNV-seq技术的临床适用性及准确性进行了评估,结果表明,CNV-seq技术可应用于流产物分析及产前诊断方面[12-13]。2019年4月,《低深度全基因组测序技术在产前诊断中的应用专家共识》指出,CNV-seq技术可以弥补染色体核型分析和CMA的不足,对于染色体病高风险胎儿,CNV-seq技术可作为一线产前诊断方法。但是,CNV-seq技术不能检测三倍体及多倍体,无法发现染色体互相易位、倒位等染色体结构重排,且无法检测杂合性缺失(包括单亲二倍体)[14]。
本研究中,采用传统的染色体核型分析技术对42例患者进行常规染色体分析发现,8例存在染色体异常,其中6例患者为染色体结构异常,2例为染色体数目异常。同时,利用CNV-seq技术对这42例患者标本进行高通量测序分析,结果发现,对于染色体核型分析确诊的6例染色体结构异常的患者,CNV-seq发现其中4例存在基因的CNVs。将检测到的CNVs参照国际权威数据库及相关参考文献进行致病性评估发现,除其中1个CNV临床意义暂不明确外,其余均是明确致病的。4例存在异常CNVs患者中,P1父亲染色体正常,母亲染色体核型为46,XX,t(3;13)(p25;q21),inv(9),由此可推测P1患者异常核型来源于其母亲;其余3例患者家属拒绝家系调查,未能获得患者异常染色体来源。在染色体核型分析结果正常的30例患者中,CNV-seq还发现2例患者存在片段<10 Mb的CNVs,其中1例检测结果判读为可能致病的CNV。
此外,染色体核型分析还发现4例染色体多态性变异。有研究指出,染色体多态性具有引起流产、不孕不育等生殖异常遗传效应[15-16]。但目前对于多态性引起的生殖异常,还需进一步在分子水平进行研究。为了排除本研究中发现的4例染色体多态性携带其他染色体CNV,我们将标本同时进行CNV-seq检测,结果并未发现明显异常CNV改变。
综上所述, CNV-seq技术克服了现有染色体诊断技术的缺点,能够快速、准确地为染色体异常患者提供更为详细的临床检测信息。尤其对染色体核型分析不能明确诊断的染色体片段,CNV-seq检测能协助确定其所涉及的区带。因此,对于染色体病患者和高危人群进行CNV-seq联合染色体核型分析检测,能为患者提供更为详细准确的临床诊断,从而为遗传咨询和生育指导提供依据。
