CTC检测在胃癌结直肠癌预后评估中的价值及差异性分析
2019-10-24刘医辉董春慧张文文段学琴刘锡枝
赵 琳,刘医辉,董春慧,张文文,段学琴,刘锡枝,陈 玲
(1. 西安交通大学第一附属医院肿瘤科,陕西西安 710061;2. 宁夏回族自治区人民医院肿瘤科,宁夏银川 750000;3. 西安市第九医院肿瘤科 陕西西安 710054)
早期、精准检测和判断肿瘤的发生发展对疾病的诊断治疗具有重要的指导意义。1896年ASHWORTH[1]发现肿瘤患者外周血、骨髓、淋巴结中存在的循环肿瘤细胞(circulating tumor cells, CTCs),在一定的条件下增殖浸润,引起肿瘤的复发与转移。胃癌结直肠癌患者术后死亡的主要原因为复发和转移,目前认为循环肿瘤细胞是引起肿瘤复发转移的重要环节,而这不能通过普通的影像学及血液学检测手段发现。糖类抗原19-9(CA19-9)、癌胚抗原(CEA)等血清学肿瘤指标虽有一定的预测价值,但结果也仅能作为参考[2]。近年来随着生物实验技术的进步,液体活检进入了临床实践中,应用于肿瘤的早期诊断、预后监测、复发转移、个体化治疗和疗效评估等方面[3]。多项研究表明,测量CTC可作为一种“液体活检”,对癌症患者能够进行实时无创、频繁地监测其治疗反应[4-6]。液体活检用于检测的循环肿瘤细胞,使精准判断肿瘤预后的设想成为可能。本研究分析了32例胃癌、36例结肠癌CTC检测结果,并进行了差异比较,现报道如下。
1 资料与方法
1.1 一般资料收集2015年1月至2016年6月西安交通大学第一附属医院行手术切除并经病理证实为结直肠癌36例、胃癌32例,其中男性41例、女性27例,年龄23~74(平均年龄57.43)岁。随访时间截止于2019年8月,所有病例随访时长为30个月。
1.2 循环肿瘤细胞的检测方法
1.2.1标本采集 严格消毒后,取肘正中静脉血4 mL。所有血样加入柠檬酸葡萄糖抗凝剂真空采血管,室温(15~30℃)保存,且在24 h内进行富集处理。
1.2.2密度梯度离心法富集 试剂盒采用人外周血白细胞去除试剂盒+荧光原位杂交试剂盒(江苏莱尔生物医药科技有限公司)。取4 mL全血至50 mL离心管中,补充CS1至45 mL。离心(650 g,室温,5 min),沉淀细胞加CS2至45 mL,离心(650 g,室温,5 min),沉淀细胞后补加CS1至5 mL。吸取150 μL磁微粒混悬液,1 mL CS1,重复洗涤3次后,用CS1重悬磁微粒至100 μL。按每份100 μL的比例将磁微粒缓慢加入前续处理好的样本中。于50 mL离心管中加入3 mL CS3,将加入磁微粒中的所有液体轻轻叠加到CS3顶层,离心(300 g,室温,5 min)。轻柔吸取最上2层溶液,加CS1至14 mL,离心(950 g,室温,5 min),弃上清至300 μL,加入1 mL CS1,靠于磁力架上2~3 min,离心(2 070 g,室温,3 min),弃上清至100 μL,加入100 μL CF1固定液,涂片至20 mm×20 mm的标本框中。
1.2.3免疫荧光法染色 取CF2固定液200~300 μL完全覆盖标本区域,室温固定8 min。吸去标本区上的CF2固定液,放入已预热的染色缸I中静置10 min。标本载玻片依次在染色缸中静置2 min,室温晾干。取探针前离心(1 000 r/min),轻轻吹打混匀3次,并在液面处吸取。每个标本区加入10 μL CEP8探针,盖上盖玻片。吸取Rubber Cement 200~300 μL,完全封住盖玻片边缘进行杂交:变性76 ℃ 5 min;杂交37 ℃ 1.5 h后洗片。按每人份20 μL CD45-AF594荧光抗体、180 μL 20 g/L BSA溶液的比例配制抗体工作液,避光待用。用2 g/L BSA洗标本区2次,每次300 μL。吸去标本区上的2 g/L BSA,将配置好的抗体加至标本区,室温并避光孵育1 h。将DAPI管离心(1 000 r/min)后,液面处取10 μL DAPI染液,加至标本区,盖上盖玻片,镜下观察或置于2~8 ℃环境下避光保存。
1.2.4典型CTCs的判定标准 ①单个细胞,核质均匀,未发现分层;②信号3个或3个以上,且在细胞核上;③红色通道下未见CD45显色;④细胞表面无磁珠。 经过鉴定符合上述标准的细胞,可以认为是上皮细胞组织来源的肿瘤细胞,即CTCs。本实验中将CD45(-)、细胞数>1个视为CTCs阳性。
1.3 统计学分析采用SPSS 17.0软件进行统计学分析。采用χ2检验对计数资料组间率的差异进行比较,当有20%以上格子的期望频数小于5,或有任意一个格子的期望频数小于1,或总例数(n)<40时采用Fisher确切概率法。以P<0.05为差异具有统计学意义。
2 结 果
2.1 CTCs检测结果判读胃癌和结直肠癌进行了染色体荧光探针标记,胃癌采用CEP8、CEP17标记,结直肠癌采用CEP8、CEP7标记(图1)。
2.2 胃癌和结直肠癌患者术后CTCs检测结果和生存差异胃癌组患者外周血中检出CTCs<2组有8例(25%),随访30个月后,全部患者存活;检出CTCs≥2组有24例(75%),随访30个月后,仅有8例存活,两组的生存差异具有统计学意义(P=0.001)。在结直肠癌组患者中外周血检出CTCs<2组共28例(78%),随访时间结束时,全部患者存活,检出CTCs≥2组有8例(22%),其中6例患者在随访终点时间存活,结直肠癌中CTCs<2组与CTCs≥2组的生存差异具有统计学意义(P=0.044)。胃癌与结直肠癌患者的生存差异具有统计学意义(P=0.000,表1)。

图1 CTCs的免疫荧光染色
Fig.1 Immunofluorescence staining of circulating tumor cells (CTCs)
A: CEP8 triploid, CD45(-), Dapi(+) (×40); B: CEP17 triploid, CD45(-), Dapi(+) (×40); C: CEP8 triploid/17 triploid, CD45(-), Dapi(+) (×40)。
表1 胃癌与结直肠癌患者不同CTCs检测表达值与生存差异
Tab.1 Differences in CTCs expression and survival in gastric cancer and colorectal cancer
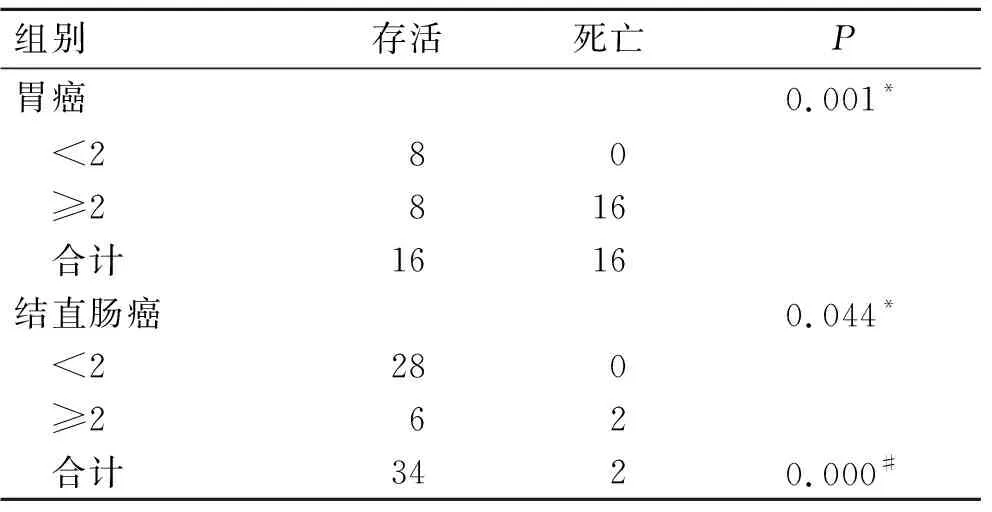
组别存活死亡P胃癌0.001* <280 ≥2816 合计1616结直肠癌0.044* <2280 ≥262 合计3420.000#
*:同一癌种组内生存率比较;#:胃癌与结直肠癌生存率比较。
2.3 CTCs与胃癌结直肠癌的临床病理特征的关系CTCs≥2与胃癌患者的年龄、性别、TNM分期、淋巴结转移、远处转移和肿瘤分化程度、脉管侵犯与否均无关(P>0.05,表2)。结直肠癌患者中结果相同(P>0.05,表3)。
3 讨 论
胃癌和结直肠癌的高发病率、高死亡率迫切需要早期诊断、预后监测的灵敏便捷方法进行跟踪[7-8]。
随着精准治疗的推进,液体活检在科研的基础上,极大推进了临床实践的精准医疗发展。CTCs代表原发性和转移性肿瘤的表型和遗传型。在血液学传播、上皮-间充质转变(EMT)、循环肿瘤微栓塞(CTM)和CTCs的肿瘤启动能力等方面成为CTCs的研究的热点。
影响CTC分析的主要原因是CTC在血液里含量极微,在癌症患者的血液中检测到CTCs,其浓度非常低,每5×109红细胞有1个细胞,白细胞为5~10×106个[9]。因此,对CTC的检测技术要求较高,检测并计数恶性肿瘤产生的CTC需要非常灵敏和特异的方法,故检测非常困难。现在检测CTC的技术有很多种,主要包括 CTC 富集和鉴定技术[10]。富集技术主要基于其物理或生物学特性与血液中其他细胞的不同而实现。富集方法主要包括密度梯度离心、免疫磁珠分选、芯片富集技术等,其中免疫磁珠分选法因其分选特异性高,且富集到的CTC活性较好,故目前大多数检测都采用此法[11]。鉴定技术则普遍基于肿瘤细胞表面抗原的表达,上皮细胞粘附分子(EpCAM)和细胞角蛋白(CK)是CTC鉴定中最常用的标记物。2004年FDA批准用于临床CellSearch技术,依赖于细胞表面EpCAM的表达,易出现漏检。本实验采用阴性富集技术,利用外周血粒细胞表达白细胞表面共同抗原CD45,与磁珠结合后去除无关细胞,间接富集CTC。本法不依赖肿瘤细胞表面抗原的表达,适用的肿瘤类型较广,其回收率达90%以上。同时采用imFISH技术,将免疫荧光检测与荧光原位杂交技术结合对CTCs进行检测,其不仅改进了传统FISH的繁杂操作,又保护了胞内外抗原;既保留了免疫细胞化学检测,又实现了从核酸水平对细胞进行定位、定性和定量分析。
表2 胃癌患者不同临床病理特征与CTCs阳性率的相关性
Tab.2 Correlation between clinicopathological features and positive rates of CTCs in patients with gastric cancer
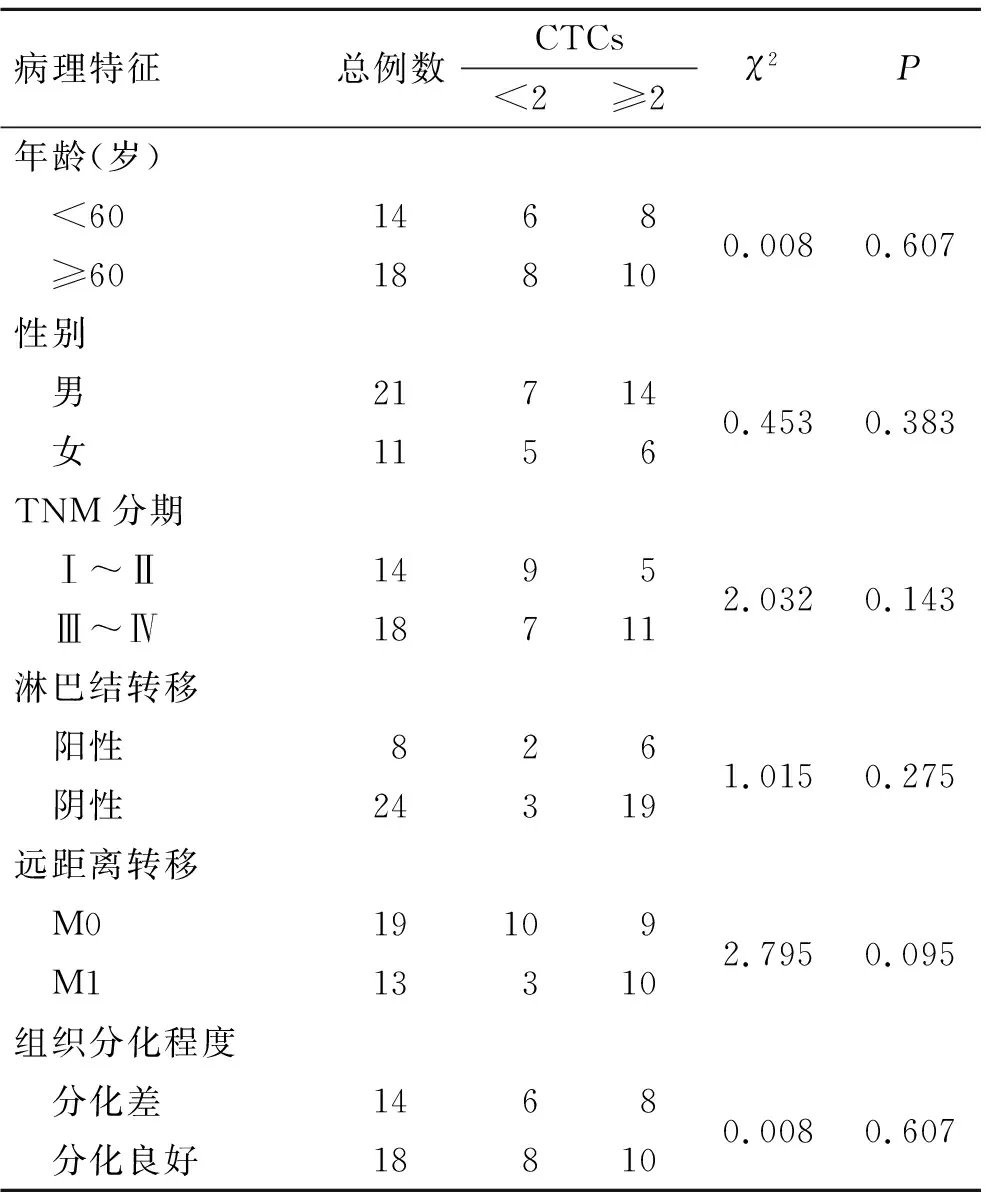
病理特征总例数CTCs<2≥2χ2P年龄(岁) <601468 ≥60188100.0080.607性别 男21714 女11560.4530.383TNM分期 Ⅰ~Ⅱ1495 Ⅲ~Ⅳ187112.0320.143淋巴结转移 阳性826 阴性243191.0150.275远距离转移 M019109 M1133102.7950.095组织分化程度 分化差1468 分化良好188100.0080.607
表3 结直肠癌患者不同临床病理特征与CTCs阳性率的相关性
Tab.3 Correlation between clinicopathological features and positive rates of CTCs in patients with colorectal cancer
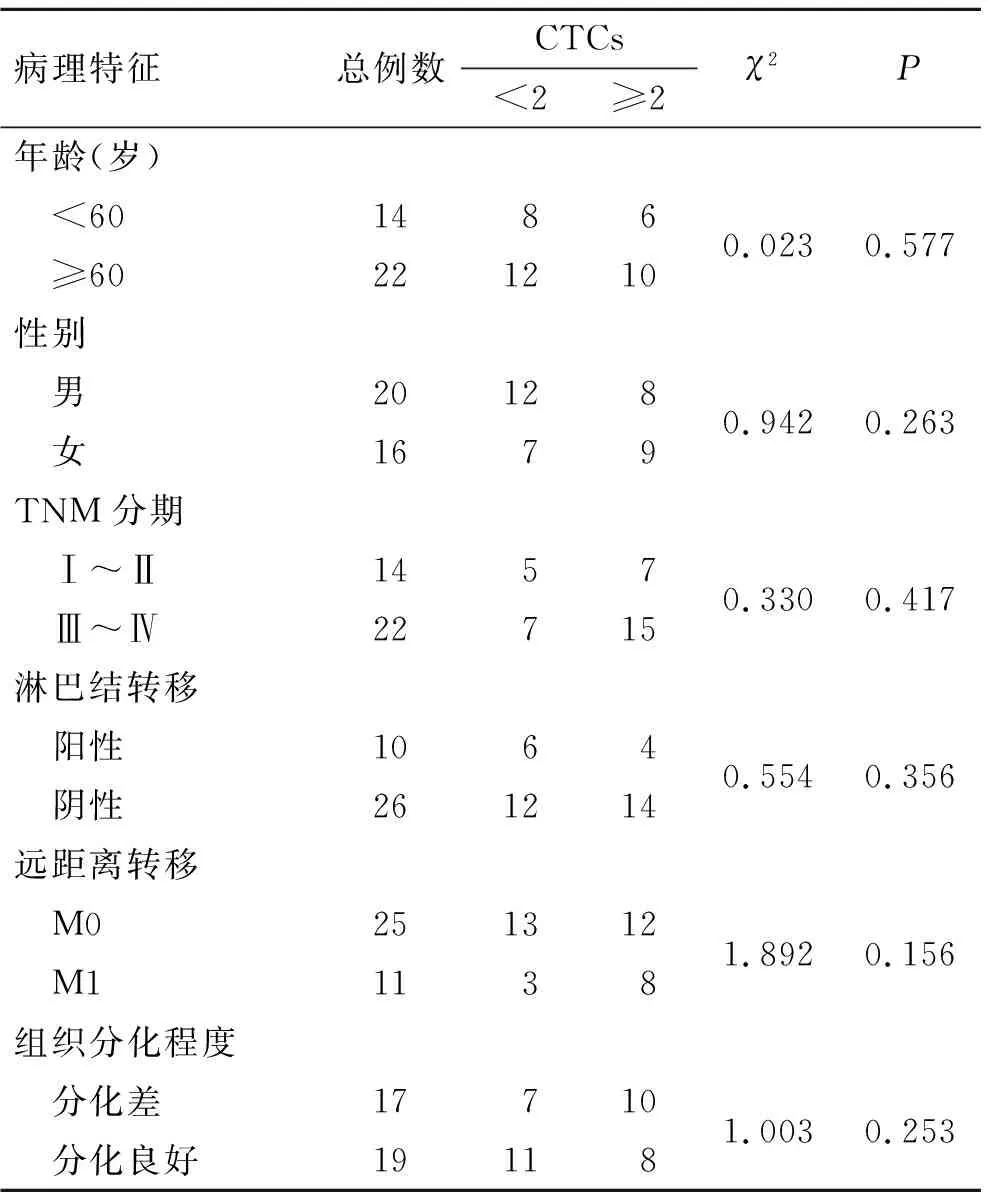
病理特征总例数CTCs<2≥2χ2P年龄(岁) <601486 ≥602212100.0230.577性别 男20128 女16790.9420.263TNM分期 Ⅰ~Ⅱ1457 Ⅲ~Ⅳ227150.3300.417淋巴结转移 阳性1064 阴性2612140.5540.356远距离转移 M0251312 M111381.8920.156组织分化程度 分化差17710 分化良好191181.0030.253
DNA异倍体是染色体异常的表型,也是细胞癌变的特征指标,与恶性肿瘤的异常增殖相关。一般来说,在染色体水平鉴定循环肿瘤细胞(CTC)更为客观及准确。由于肿瘤细胞的异质性,同一患者组织来源的肿瘤细胞可能会出现多种染色体不稳定的情况;另外同一细胞的染色体倍体检测中也会出现多条染色体倍体异常的情况。本研究采用的是染色体着丝粒探针,在检测过程中出现同一肿瘤细胞会出现两种染色体异倍体分别存在或共存的现象。研究发现,胃癌中17号染色体多体与远端转移存在显著的相关性[12];8号染色体扩增的CTC在进展期胃癌具有较高的检出率[13];结直肠癌中存在8号染色体和7号染色体扩增情况[14]。
目前CTC最为成熟的应用是对局部或者转移性肿瘤预后的评估,其实用性已得到证实;而简便、可反复检测的特点亦使其在动态疗效评估中具有较大的应用潜力。TIEN等[15]发现门静脉中的CTC数量也可作为肝转移的重要预测因素。胃癌和结直肠癌预后有明显差异,虽然化疗和靶向治疗方法不断改进,但胃癌对诸多疗法不敏感,是导致其预后差的主要原因,早期检测明确预后,积极治疗是提高肿瘤患者生存率的有效方法。HIRAIWA等[16]对130例胃肠道癌患者和41例健康志愿者进行研究,其中包括44例胃癌患者,结果显示27例转移性胃癌患者的CTC计数高于14例非转移性胃癌患者。另一项研究包括136例晚期胃癌患者,表明CTC的出现是较短PFS的独立预测因子[17]。LI等[18]研究发现,CTC的非整倍性与进展期胃癌患者预后相关,定量比较监测治疗前后多形CTC有助于预测预后的改善或恶化以及化疗耐药性。
LI等[19]应用imFISH分析技术在肺癌、胃癌、乳腺癌及食管癌中研究发现,以CTCs≥2为分界值时,肿瘤检出的阳性率依次为71.33%、86.21%、76.77%和78.35%,具有较高的灵敏度,且假阳性相对较低。本研究结果显示,胃癌和结直肠癌患者术后CTCs的检测值与生存率具有统计学差异(P<0.05),以检测指标≥2为分界,生存率明显下降。与既往研究成果相符。因此,评估CTCs可能是预测胃癌结直肠癌患者肿瘤进展和预后的有用策略。本研究结果显示,胃癌的高检测CTC值较结直肠癌具有更差的预后,与临床数据一致,提示我们更应该重视胃癌患者的CTC值监测,及时发现复发转移的趋势,尽早更换治疗策略。
在本研究收集的32例胃癌患者与36例结直肠癌患者中,CTC的数量(≥2)与肿瘤分期、淋巴结转移、肿瘤分化程度等无关,这与既往文献中提示CTC与肿瘤分化程度和淋巴结转移率相关不符[19-21],可能与样本数量较少、CTC检测中的误差及随访时间短有关。
CTCs是一个有广阔应用前景的研究领域,但仍处于起步阶段。由于在技术方法上缺乏共识,CTCs研究转化为常规临床检验还需要探索。CellSearch系统是美国FDA批准的第一个检测和列举CTCs的标准半自动化方法。许多研究成功地使用CellSearch系统计数CTCs作为各种癌症的预后和治疗效果的指标[22-23]。阴性富集联合双探针imFISH技术在肿瘤CTC检测中具有较高的灵敏度和特异性,对于肿瘤的辅助诊断和早期检测具有重要意义。由于本研究时间短、样本量小,CTC 与疗效等信息的相关性以及确定患者的阳性CTCs阈值尚有待于进一步的研究。
