长链非编码RNA SNHG5对肝癌上皮间质转化及肿瘤干细胞增殖的影响
2019-10-24李雅睿卢新兰刘亚萍陈昳菲卢桂芳和水祥任牡丹
李雅睿,卢新兰,刘亚萍,赵 艳,郭 丹,陈昳菲,卢桂芳,和水祥,任牡丹
(西安交通大学第一附属医院消化内科,陕西西安 710061)
肝细胞癌(hepatocellular carcinoma, HCC)是我国常见的恶性肿瘤之一,其起病隐匿、进展迅速[1]。尽管外科手术、化疗放疗及肿瘤靶向治疗等新型HCC治疗手段不断发展,但患者总体预后仍不够理想[2]。肿瘤干细胞(cancer stem cells, CSCs)是肝癌复发、转移和耐药的根源,上皮间质转化(epithelial to mesenchymal transition, EMT)是细胞干性调控的重要途径,同时肿瘤干细胞又具有EMT的特征,因此,EMT在肝癌干细胞的发展中扮演重要角色[3]。近年来,长链非编码RNA(long non-coding RNA, LncRNA)被证实具有调控肿瘤形成、生长、转移等作用,其异常表达可介导肿瘤干细胞的致瘤性并调控肿瘤的侵袭转移,且部分LncRNAs可以作为潜在的肿瘤诊断、治疗位点[4-6]。核仁小RNA宿主基因5(small nucleolar RNA host gene 5, SNHG5)被证实与多种恶性肿瘤的发生发展过程有关[7-11],但目前其在肝癌中的作用尚不明确。本研究检测了SNHG5在HCC组织及对应癌旁组织中的表达情况,应用慢病毒基因敲除技术初步探索 SNHG5对EMT和肿瘤干细胞增殖的影响。
1 资料与方法
1.1 临床资料收集西安交通大学第一附属医院48例肝癌患者的癌组织及癌旁组织(2016年7月-2017年8月)。患者术前均未接受放化疗和免疫治疗。所有组织标本均经术后病理证实为HCC。手术标本在切除后迅速置于液氮罐或-80 ℃冰箱中保存。
1.2 细胞株及主要试剂人肝癌细胞HepG2与Huh7(上海生命科学研究院);DMEM、F12培养基(GIBCO);胎牛血清(杭州四季青);胰蛋白酶(Sigma);SNHG5-shRNA慢病毒(上海吉凯基因化学技术有限公司);细胞总RNA提取试剂Trizol(美国Invitrogen公司);PCR反转录试剂盒、实时荧光定量PCR(qRT-PCR)试剂盒及引物(TaKaRa公司);SDS-PAGE凝胶试剂盒(上海碧云天生物技术有限公司);兔抗人E-cadherin、N-cadherin,OCT4和SOX-2多克隆一抗(CST)、辣根过氧化物酶标记的山羊抗兔二抗(壮志生物公司);Transwell小室(Millipore公司);Matrigel胶(BD公司);碱性成纤维生长因子(bFGF),表皮细胞生长因子(EGF)、B27(美国Invitrogen公司)。
1.3 qRT-PCR法检测基因表达用Trizol试剂提取样本总RNA,紫外分光光度计检测浓度及纯度。应用反转录试剂盒将RNA反转录为cDNA,实时定量PCR在美国Bio-Rad C1000 PCR仪上进行,每样本设3个复孔,反应条件:95 ℃ 30 s,95 ℃ 10 s,58 ℃ 5 s,扩增40个循环。基因表达情况采用2-ΔΔCt法进行数据分析。所有实验重复3次。引物序列见表1。
表1 目的基因的引物序列
Tab.1 Primer sequences of the target genes

基因引物序列(5'-3')SNHG5Forward:CGAGTAGCCAGTGAAGATAATGReverse:CACACAACAGTCAAGTAAACCE-cadherinForward:ATTCTGATTCTGCTGCTCTTGReverse:AGTCCTGGTCCTCTTCTCCN-cadherinForward:CATCATCCTGCTTATCCTTGTGReverse:CATAGTCCTGGTCTTCTTCTCCOCT4Forward:TATGCAAAGCAGAAACCCTCGTGReverse:CTGGCGCCGGTTACAGAACCASOX-2Forward:ATGACCAGCTCGCAGACCTACReverse:TTGACCACCGAACCCATGGAGGAPDHForward:ATCGTTCGTGACATTAAGGAGAAGReverse:AGCAAGGAAAGCTGGAAGAGTG
1.3.1细胞培养及SNHG5-shRNA转染 细胞用含100 mL/L FBS的DMEM培养液置于50 mL/L CO2、37 ℃培养箱。慢病毒转染:取对数期细胞接种于6孔板中,待细胞贴壁后,以感染复数(moltiplicity of infection, MOI)=10,每孔加入一定滴度的慢病毒与5 μg/mL聚凝胺(polybrene),24 h后更换为完全培养基,扩大培养。72 h后在倒置荧光显微镜下观察荧光强度判断转染效率。SNHG5-shRNA序列见表2。
表2 shRNA序列
Tab.2 shRNA sequences

基因序 列shRNA-SNHG55'-CAGUGAAGAUAAUGAAUGUTT-3'3'-ACAUUCAUUAUCUUCACUGTT-5'shRNA-negative control5'-UUCUCCGAACGUGUCACGUTT-3'3'-ACGUGACACGUUCGGAGAATT-5'
1.3.2Transwell实验检测细胞侵袭及迁移能力 侵袭实验:Matrigel以无血清DMEM稀释比例为1∶8,每个Transwell上室加入60 μL,37 ℃培养箱过夜。取Transwell小室放入24孔板,接种细胞前,小室中加入无血清DMEM培养基,于37 ℃放置1 h,吸出小室内培养基;细胞用胰酶消化后,用无血清DMEM培养液重悬为1×108/L。每个Transwell上室加入0.1 mL细胞悬液(约1×104个细胞),下室加入0.6 mL含100 mL/L胎牛血清的DMEM培养液,常规培养36 h后,取出小室并弃去上室液体,用棉签擦去膜上层细胞,室温下用甲醇固定15 min,结晶紫染色20 min,PBS清洗2次,于倒置相差显微镜下计数膜下层的细胞。迁移实验不需要Matrigel胶包被基底膜,余同侵袭实验。
1.3.3瘤球形成实验检测肿瘤干细胞特性 取对数期Huh7肝癌细胞,PBS缓冲液洗涤后无血清培养基重悬,种植于无血清的DMEM/F12(体积比1∶1)培养基中,加入B27(1∶50稀释)bFGF(20 ng/mL)和EGF(20 ng/mL),常规培养。每3~4 d再次添加B27、bFGF和EGF,10 d后计数肿瘤细胞球的数目,并拍摄照片。细胞球形成率=球形结构的数目(长径>30 μm)/初始种植细胞的个数。重复3次。
1.3.4Western blot检测蛋白表达 提取细胞总蛋白,BCA蛋白浓度测定试剂盒测定提取蛋白浓度。行SDS-PAGE凝胶电泳,每孔道蛋白上样量40 μg,恒压2 h,湿法转膜至PVDF膜,恒流2 h。50 g/L脱脂奶粉室温封闭1 h,分别加入1∶1 000稀释的对应一抗4 ℃过夜。次晨复温,TBST漂洗10 min,3次。加入1∶2 000稀释的辣根过氧化物酶标记山羊抗兔二抗室温孵育2 h,TBST漂洗10 min,3次。ECL显影,Image J软件行灰度分析。
1.4 统计学处理应用SPSS 20.0软件行统计学处理。计量资料以均数±标准差表示。两组间比较采用t检验,多组间均数比较采用方差分析,行×列表资料采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 肝癌组织及癌旁组织中SNHG5的表达及其与临床病理特征之间的关系qRT-PCR结果显示,HCC组织中SNHG5的表达明显高于对应癌旁组织,差异有统计学意义(P<0.01,图1)。SNHG5在肝癌患者中表达上调,其高表达与患者的肿瘤大小、HBV感染、病理分化类型和临床分期有关(P<0.05),在性别、年龄和AFP各组之间差异均无统计学意义(表3)。
2.2 基因敲除慢病毒SNHG5-shRNA显著抑制肝癌细胞系中SNHG5的表达SNHG5在肝癌细胞系中高表达,转染SNHG5-shRNA慢病毒72h后,细胞内绿色荧光表达明显,表明慢病毒转染效率较高。进一步行qRT-PCR验证基因敲除效率,结果显示,转染SNHG5-shRNA后肝癌细胞中SNHG5表达水平较对照组明显降低,差异有统计学意义(P=0.0014,图2)。
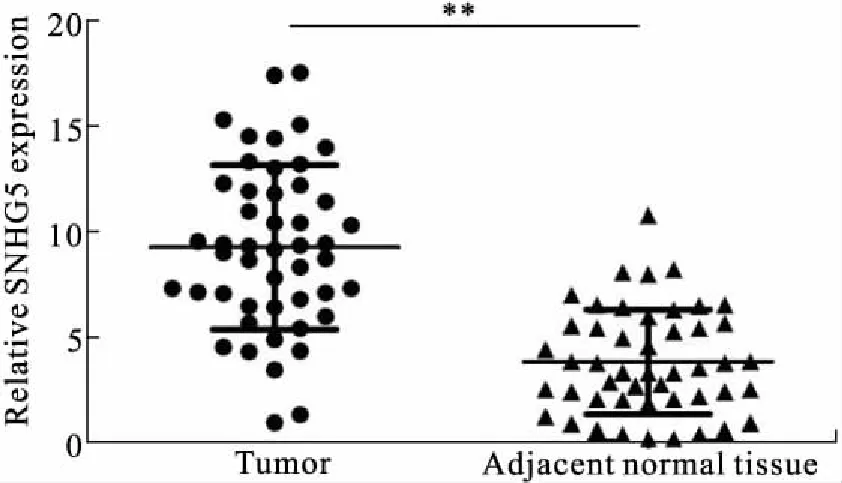
图1 SNHG5在HCC组织中高表达
Fig.1 SNHG5 was highly expressed in HCC tissues
与癌旁组织相比,**P<0.01。
表3 SNHG5在HCC组织中的表达特点
Tab.3 Expression characteristics of SNHG5 in HCC tissues
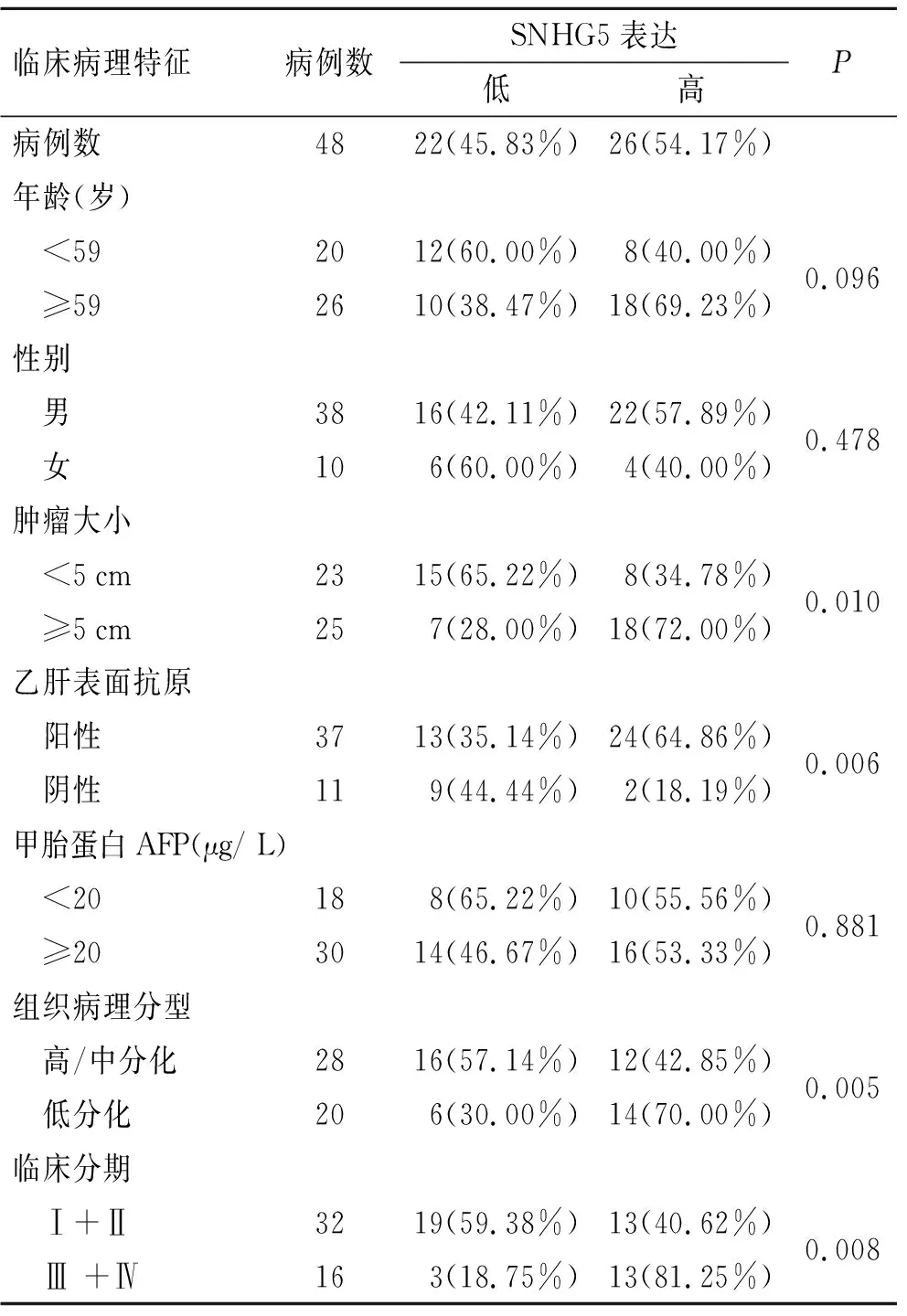
临床病理特征病例数SNHG5表达低高P病例数4822(45.83%)26(54.17%)年龄(岁) <592012(60.00%)8(40.00%) ≥592610(38.47%)18(69.23%)0.096性别 男3816(42.11%)22(57.89%) 女106(60.00%)4(40.00%)0.478肿瘤大小 <5cm2315(65.22%)8(34.78%) ≥5cm257(28.00%)18(72.00%)0.010乙肝表面抗原 阳性3713(35.14%)24(64.86%) 阴性119(44.44%)2(18.19%)0.006甲胎蛋白AFP(μg/ L) <20188(65.22%)10(55.56%) ≥203014(46.67%)16(53.33%)0.881组织病理分型 高/中分化2816(57.14%)12(42.85%) 低分化206(30.00%)14(70.00%)0.005临床分期 Ⅰ+Ⅱ3219(59.38%)13(40.62%) Ⅲ +Ⅳ163(18.75%)13(81.25%)0.008
2.3 敲除SNHG5抑制肝癌细胞侵袭迁移能力Transwell迁移实验结果显示,HepG2细胞SNHG5-shRNA组与对照组穿孔细胞数分别为(182.2±10.44)/孔和(49.80±10.33)/孔;Huh7细胞SNHG5-shRNA组与对照组穿孔细胞数分别为(185.8±10.57)/孔和(62.00±10.19)/孔。Transwell侵袭实验结果显示,HepG2细胞SNHG5-shRNA组与对照组穿孔细胞数分别为(172.2±12.94)/孔和(45.20±5.59)/孔;Huh7细胞SNHG5-shRNA组与对照组穿孔细胞数分别为(180.4±7.10)/孔和(58.80±5.63)/孔。以上结果表明,SNHG5-shRNA组侵袭和迁移细胞数目较对照组明显减少,差异有统计学意义(P<0.001,图3)。
2.4 敲除SNHG5抑制肝癌干细胞增殖瘤球形成实验结果显示,SNHG5-shRNA组肝癌干细胞球形成率呈下降趋势,并且干细胞球形成率的下降具有统计学意义(P=0.044,图4)。与此同时,相较于对照组,SNHG5-shRNA组干细胞球的体积也在缩小。以上结果表明,敲除SNHG5对肝癌干细胞球的形成及增长具有抑制作用。
2.5 SNHG5调控EMT与干细胞标志物的表达qRT-PCR和Western blot分别检测EMT及肿瘤干细胞调控基因mRNA与蛋白水平的表达,SNHG5-shRNA组的E-cadherin表达明显高于阴性对照组(P=0.045);SNHG5-shRNA组的N-cadherin、OCT4和SOX-2的表达明显低于对照组(P=0.042、0.013、0.042,图5)。

图2 SNHG5-shRNA转染72 h后细胞内绿色荧光及SNHG5基因表达
Fig.2 Intracellular green fluorescence and SNHG5 gene expression 72 h after shRNA transfection
与对照组相比,**P<0.01。
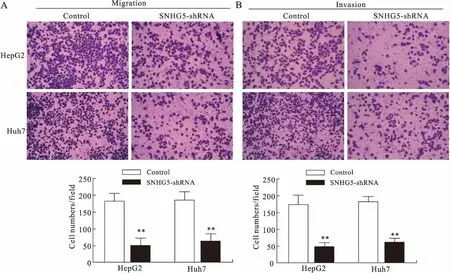
图3 敲除SNHG5抑制肝癌细胞侵袭及迁移能力
Fig.3 SNHG5 knockdown inhibited HCC cell invasion and migration
与对照组相比,**P<0.01。
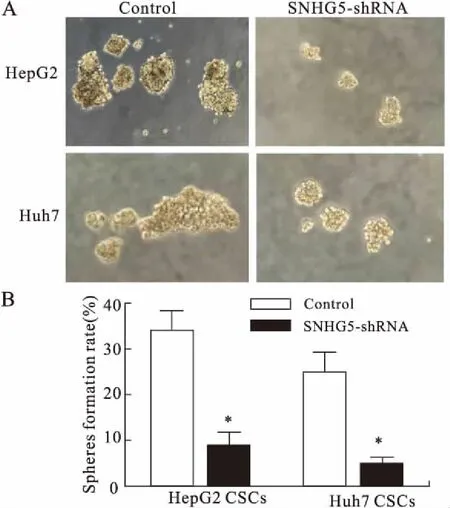
图4 敲除SNHG5抑制肝癌干细胞球的形成及增长
Fig.4 SNHG5 knockdown inhibited the formation and growth of liver cancer stem cells (CSCs) sphere
与对照组相比,*P<0.05。
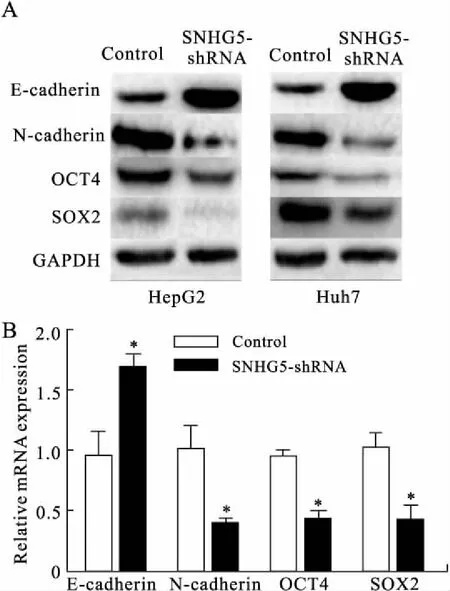
图5 敲除SNHG5抑制肝癌细胞EMT与肿瘤干细胞相关标志物的表达
Fig.5 SNHG5 knockdown inhibited the expressions of EMT and stem cell-associated markers in HCC cells
与对照组相比,*P<0.05。
3 讨 论
REYA等[12]提出的“肿瘤干细胞学说”认为,肿瘤组织中存在一部分具有自我更新、多向分化潜能的干细胞样癌细胞亚群,具有癌细胞和干细胞的特性,是肿瘤形成的起始细胞。与普通肿瘤细胞相比,肿瘤干细胞恶性程度更高。肿瘤干细胞是肿瘤复发转移和耐药的根源,其比例与肿瘤的恶性程度成正相关。细胞内基因改变或者表观遗传学改变引起的肿瘤干细胞自我更新能力失调可能是导致肿瘤发生、复发转移及化疗耐受的主要原因。肝癌干细胞(liver cancer stem cells, LCSCs)在肝癌的发生发展中起至关重要的作用,未来针对LCSC的治疗将是提高肝癌患者预后的关键。
LncRNA是一类转录本长度超过200个核苷酸(nt)的RNA序列,因本身缺乏开放阅读框架无明显蛋白质编码功能[13],曾一度被认为是基因转录中的“暗物质”。近年来,随着高通量测序技术的发展,越来越多的lncRNA被发现,且研究证实,lncRNA在表观遗传学、转录水平及转录后水平实现了对基因表达的调控,在人类疾病中发挥重要的生物学功能[14]。SNHG5作为lncRNAs家族中的一员,在多种肿瘤中异常表达,包括结直肠癌、胃癌、黑色素瘤、乳腺癌等,是一种特殊的肿瘤相关分子[15]。本研究首次发现SNHG5在肝癌组织中表达上调,且其高表达与患者的肿瘤大小、HBV感染、病理分化类型和临床分期有关,进一步探索SNHG5在肝癌中的作用机制有利于发现新的肿瘤诊断分子标志物及治疗靶点。
EMT是细胞形态从上皮表型转化为间质表型的过程,上皮起源的恶性肿瘤细胞在与周围间质的相互作用过程中,逐渐丧失上皮细胞的部分特征(如上皮属性蛋白E-cadherin表达下调),失去细胞间黏附作用,获得间质细胞的某些特殊属性(如反常表达间质细胞特异蛋白N-cadherin等),伴有细胞极性消失、运动能力增强、黏附能力减弱等现象[16]。EMT参与了肿瘤恶性表型转化的启动过程,是肿瘤开始转移的关键步骤。EMT理论揭示了“肿瘤细胞自身属性改变致转移能力增强”的本质,包括肝癌等的多种发生转移的肿瘤均部分或完全具有EMT特征的表达模式[17]。近年来发现,发生了EMT的肿瘤细胞可产生部分干细胞特性。WEINBERG等[18]研究发现,正常乳腺细胞经历EMT转化后获得了干细胞样特性,即EMT转化后的乳腺细胞,获得了间质性质细胞的侵袭能力,同时其克隆形成实验和细胞微球培养形成能力增强。本研究发现,沉默SNHG5后肝癌细胞的侵袭迁移能力及体外成球能力明显减弱。为了探讨其分子机制,本研究检测了细胞内EMT及肿瘤干细胞调控相关因子的表达水平,结果显示,肝癌细胞内发生钙黏蛋白转换,即上皮细胞分子标志物E-cadherin表达上调,而间质表型标志物N-cadherin表达下调;同时,肿瘤的干性调控基因OCT4和SOX2表达下调,导致肿瘤细胞的干性获得能力减弱。
综上所述,lncRNA SNHG5在肝癌组织中表达升高,抑制SNHG5的表达可以促进肝癌细胞的EMT逆转,降低肝癌肿瘤干细胞特性获得的可能性。本研究为发现肝癌临床分子诊断标志物和基因靶向治疗提供了实验依据。
