普洱茶通过降低NF-κB活性促巨噬细胞凋亡改善动脉粥样硬化
2019-10-24肖懿慧袁祖贻
肖懿慧,贺 明,舒 娟,袁祖贻
(西安交通大学第一附属医院,陕西西安 710061)
动脉粥样硬化是一种慢性炎症性疾病[1]。在慢性炎症和各种细胞因子作用下,循环单核细胞粘附于血管内皮,然后迁移到内膜下并转化为巨噬细胞,最后转化为泡沫细胞[2]。同时,巨噬细胞分泌大量促进炎症的细胞因子,进一步招募并激活巨噬细胞[3]。斑块中巨噬细胞的数量和功能直接影响动脉粥样硬化斑块大小和脂质沉积[4]。以往的研究表明,巨噬细胞凋亡在动脉粥样硬化进程中起着重要作用,而巨噬细胞凋亡可以减少粥样硬化斑块的形成,延缓动脉粥样硬化进展[5-6]。
发酵茶具有调节血脂、抗炎、抗氧化等作用[7-9]。中国云南产的普洱茶是由云南大叶生绿等杂叶制成的后发酵(二次发酵)茶,饮用普洱茶可能有助于治疗慢性炎症性疾病。但是,目前没有相关研究报道普洱茶的饮用是否对动脉粥样硬化有改善作用。本研究用载脂蛋白E缺陷(ApoE-/-)小鼠观察饮用普洱茶对早期脂纹形成和晚期纤维脂肪斑块进展的影响,明确普洱茶是否发挥抗炎和调节巨噬细胞凋亡等作用。
1 材料与方法
1.1 材料ApoE-/-小鼠由西安交通大学医学部实验动物中心提供,共40只,雌雄各半。CD68抗体购自英国Serotec公司;荧光素异硫氰酸结合山羊抗小鼠二抗购自美国Rockford Pierce公司;DAPI荧光染料购自澳大利亚Molecular Probes公司;Trizol试剂购自加拿大Invitrogen公司;RIPA裂解液购自美国Cybrdi公司;蛋白酶抑制剂混合物购自德国Roche Molecular Biochcal公司;抗p65及抗IκB抗体购自美国Cell Signaling Technology公司;抗GAPDH抗体购自美国Epitomics公司;辣根过氧化物酶偶联抗鼠抗体购自美国Abcam公司;IRDye 购自美国LICOR公司;Nanodrop 1000购自美国Thermo公司;橙色染色剂购自美国Licor公司;油红O染色法检测试剂盒购自上海歌凡生物公司;原位细胞凋亡检测试剂盒TMR RED购自德国Roche公司;SYBR PrimescriptTMRT-PCR试剂盒购自中国大连TaKaRa公司;转移印迹系统iQ5TM、多色实时PCR检测系统购自美国Bio-Rad公司;BX51成像系统为日本Olympus公司;Image Pro Plus 6.0购自美国MEDIA CYBERNETICS图像技术公司;Odyssey红外成像系统和Odyssey软件来自美国Licor公司。
1.2 小鼠动脉粥样硬化模型的建立、干预及取材ApoE-/-小鼠在温度可控的饲养设施中并模拟12 h明暗循环,自由进食饮水;于6周龄时改为高脂饮食(含21%脂肪和0.15%胆固醇),至18周龄,用于实验。
普洱茶提取物干预组小鼠以该提取物灌胃8周或16周(10 mL/d),对照组小鼠灌胃ddH2O(10 mL/d)。麻醉小鼠后腹腔注射20 g/L阿维汀(0.25 mg/g)处死,穿刺左心室获取血液,用无菌磷酸盐缓冲盐水(PBS)灌注后,在显微镜下取出心脏和胸主动脉。PBS腹腔灌洗后,收集巨噬细胞[10]。动物实验符合西安交通大学动物实验伦理委员会批准的《小鼠牺牲和组织收获方案》。
1.3 普洱茶提取物的制备商品普洱茶样品采集自中国云南省茶林,存放于中国科学院昆明植物研究所[10]。普洱茶的加工过程[7]:将3 g普洱茶(云南庆丰香茶业有限公司)放在纱布袋中,然后浸入500 mL沸水中浸泡10 min;自然冷却后,过滤除菌、分装。中速定量滤纸除去固体物质,0.22 μm孔径过滤器过滤后,10 mL试管分装。普洱茶中总多酚、总黄酮、游离氨基酸、茶黄素、茶红素、茶褐色素等生化成分的含量见既往研究结果[11]。
1.4 脂质斑块检测及CD68免疫组化检测用油红O染色法检测胸主动脉斑块中的脂质,并用偏光显微镜对切片进行分析。免疫组化方法检测CD68:阴性对照与抗体稀释液加入后均孵育过夜,然后将样品与辣根过氧化物酶结合或荧光素异硫氰酸结合山羊抗小鼠二抗孵育1 h;DAPI染色细胞核。使用Olympus BX51成像系统对截面图像进行数字捕获,并使用Image Pro Plus 6.0软件进行量化。
1.5 巨噬细胞的凋亡检测40 g/L多聚甲醛固定组织,1 mL/L Triton X-100提高渗透性。样品用PBS冲洗2次并干燥后将50 μL TUNEL反应混合物添加到每个样品中,按原位细胞凋亡检测试剂盒TMR RED检测细胞凋亡。
1.6 实时定量PCR检测血管组织炎症因子及巨噬细胞p65、IκB-β mRNA表达从小鼠的主动脉组织或腹腔巨噬细胞中分离总RNA,用Trizol试剂提取RNA。使用Nanodrop1000定量总RNA。用SYBR PrimescriptTMRT-PCR试剂盒对得到的RNA进行逆转录和定量PCR分析。95 ℃进行5 s、63.5 ℃进行20 s、72 ℃进行10 s的3步PCR程序,持续45个周期。所有实时反应均在iQ5TM多色实时PCR检测系统上进行。内参为GAPDH。
1.7 Western blot检测腹腔巨噬细胞中p65、IκB-β表达用RIPA裂解液提取腹膜巨噬细胞中的蛋白质,并将蛋白酶抑制剂混合物添加到所有样品中。用100 g/L SDS-PAGE凝胶分离等量的蛋白质提取物,转移印迹系统转移到硝酸纤维素膜上。用50 g/L脱脂乳于室温缓慢摇动1 h,阻断非特异性结合。一抗(抗p65、抗IκB-β或抗GAPDH)4 ℃孵育过夜。辣根过氧化物酶标记的二抗室温下孵育1 h后洗膜,并在暗室显影并定影。分析各个条带的吸光度(A)值。
1.8 电泳迁移率变化分析(EMSA)使用细胞核和细胞质提取试剂分离核蛋白。使用Odyssey红外成像系统(该系统检测带有寡核苷酸标记的NF-κB)进行EMSA分析。DNA结合反应使用10 μg核提取物与寡核苷酸和凝胶移位结合缓冲剂。在室温下暗盒中反应30 min;加入2 mL橙色染色剂,并将样品装入预运行的60 g/L聚丙烯酰胺凝胶中。用NF-κB p65抗体和未标记的NF-κB寡核苷酸确定NF-κB DNA结合活性的超移和特异性。对凝胶进行扫描,并使用Odyssey红外成像系统和Odyssey软件对信号进行分析。
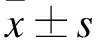
2 结 果
2.1 普洱茶干预ApoE-/-小鼠降低脂质斑块面积和脂质成分与对照组相比,普洱茶提取物干预ApoE-/-小鼠8周组的主动脉根部脂质斑块面积分数降低,但差异无统计学意义(P>0.05);干预16周组脂质斑块面积分数明显降低,差异有统计学意义(P<0.05);此外,普洱茶提取物干预8周组的油红O阳性区域平均比值也较对照组降低,但差异无统计学意义(P>0.05);16周干预组则明显降低,差异有统计学意义(P<0.05,图1)。
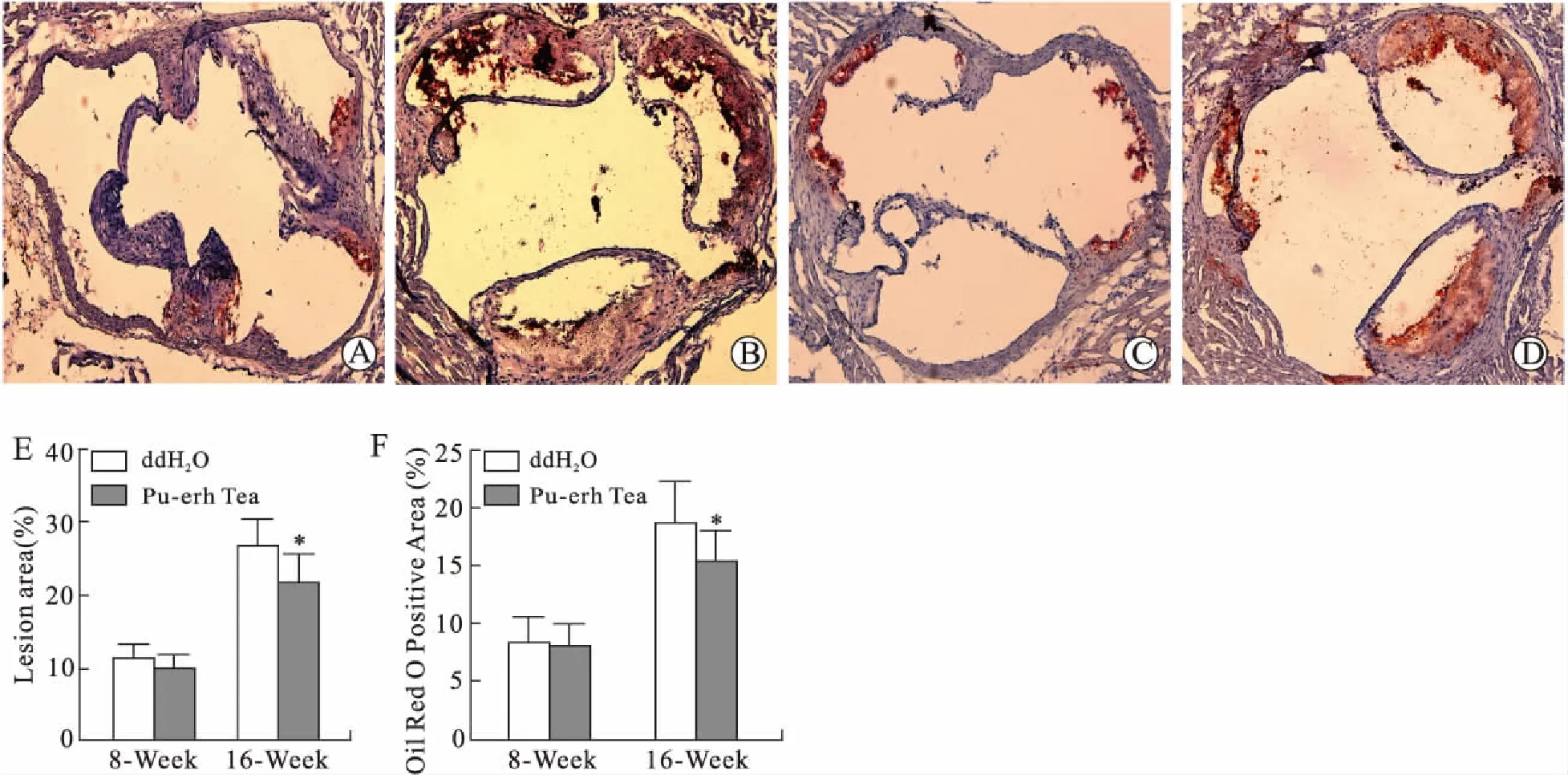

图1 油红O染色检测普洱茶提取物干预ApoE-/-小鼠对主动脉根部脂质斑块面积的影响Fig.1 Pu-erh tea extract inhibited atherosclerosis detected by oil red stainingA~D:油红O染色结果(×200)。A、B:普洱茶提取物分别处理8周、16周;C、D:ddH2O分别处理8周、16周;E:脂质斑块面积分数的量化分析(n=6);F:油红O染色法检测斑块的量化分析(n=6)。与对照组(ddH2O组)比较,*P<0.05。
2.2 普洱茶提取物促进ApoE-/-小鼠斑块中巨噬细胞凋亡与对照组相比,普洱茶提取物干预8周组斑块内CD68阳性率降低,差异有统计学意义[(6.9±1.1)%vs. (4.2±1.0)%,P<0.05];干预16周组CD68阳性率明显降低,差异有统计学意义[(14.1±2.1)%vs. (8.2±2.0)%,P<0.01]。此外,与对照组相比,普洱茶提取物干预8周和16周的ApoE-/-小鼠主动脉斑块中巨噬细胞平均比例分别降低41.3%(P<0.05)和45.2%(P<0.05)。与对照组相比,普洱茶提取物干预8周组的斑块中凋亡巨噬细胞与总巨噬细胞的平均比率增加[(37.4±5.4)%vs. (8.5±2.8)%,P<0.01];普洱茶提取物干预16周的平均比率增加[(46.2±5.8)%vs. (17.1±4.4)%,P<0.05,图2]。
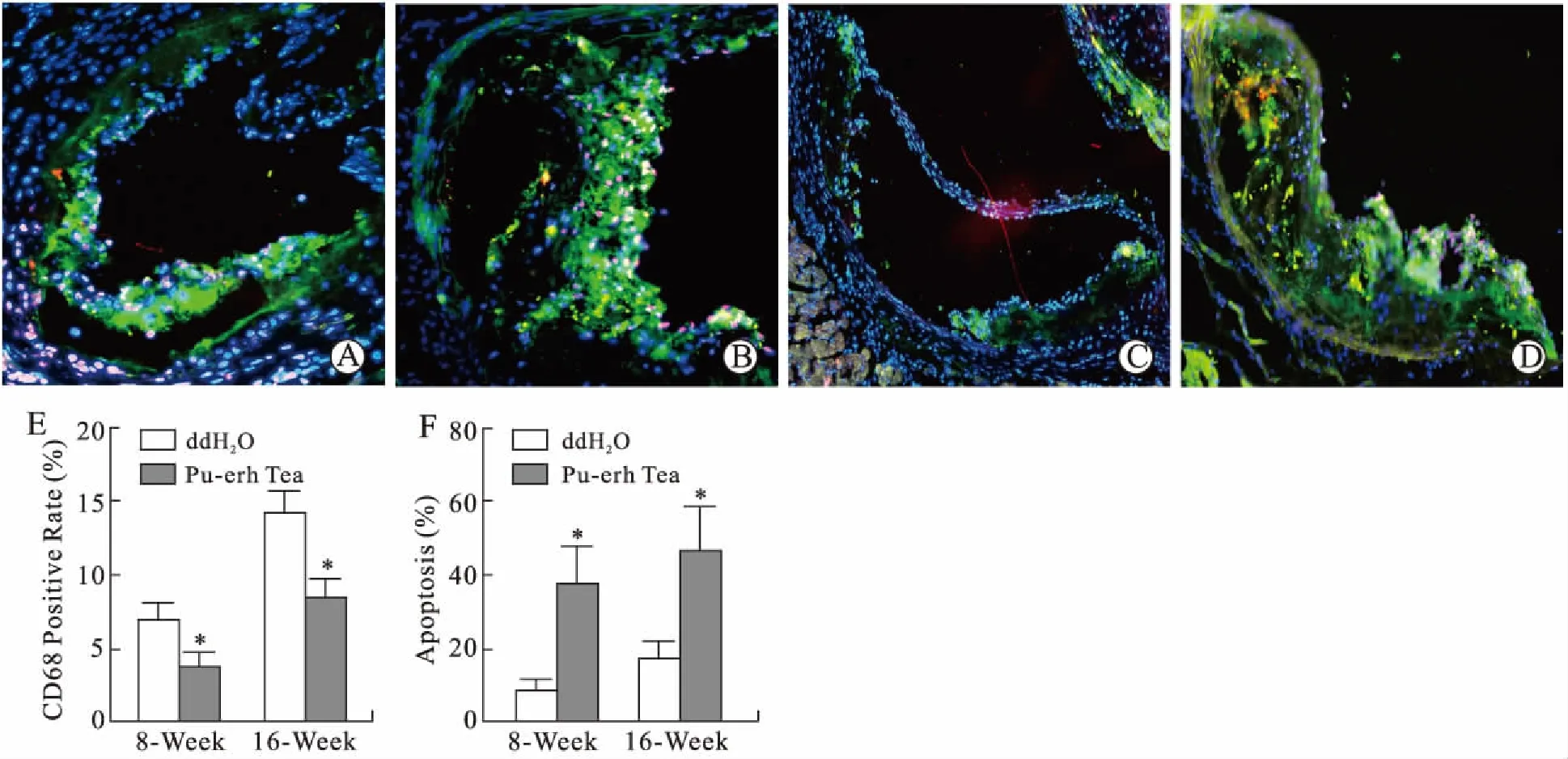

图2 免疫荧光染色检测普洱茶提取物促进斑块内巨噬细胞凋亡Fig.2 Pu-erh tea extract promoted the apoptosis of macro-phages in the plaqueA~D:免疫荧光染色结果(×200)。A、B:普洱茶提取物分别处理8周、16周;C、D:ddH2O分别处理8周、16周;E:CD68阳性率量化分析(n=6);F:巨噬细胞凋亡率量化分析(n=6)。与对照组(ddH2O组)比较,*P<0.05。
2.3 普洱茶提取物干预降低NF-κB的表达并抑制其DNA结合活性Western blot检测结果显示,普洱茶提取物干预8周和16周组ApoE-/-小鼠的腹腔巨噬细胞中p65蛋白表达分别降低40.8%(P<0.05)和61.8%(P<0.01)。干预8周组IκB-β蛋白表达略有下降(P>0.05),干预16周组IκB-β表达明显下降[(52.3±8.2)%,P<0.05,图3A~图3C]。
实时定量PCR检测结果显示,ApoE-/-小鼠主动脉组织中的p65 mRNA表达分别下降(28.1±9.1)%(P<0.05)和(53.6±6.4)%(P<0.05),IκB-β的mRNA表达均下降,干预16周组下降更为明显[(56.1±4.9)%,P<0.05,图3D、图3E]。
图3 普洱茶提取物干预对巨噬细胞内P65、IκB-β蛋白及mRNA表达的影响
Fig.3 Effects of pu-erh tea extract intervention on protein nd and mRNA expressions of P65 and IκB-β in macrophages
A~C:Western blot检测结果及统计学分析;D、E:实时定量PCR检测结果的统计学分析。n=6。与对照组(ddH2O组)比较,*P<0.05,**P<0.01。
EMSA法测定小鼠腹腔巨噬细胞核蛋白中NF-κB的DNA结合活性,干预8周组及16周组其结合活性平均灰度值分别降低(49.4±7.7)%(P<0.05)和(75.6±10.1)%(P<0.01,图4)。
2.4 普洱茶提取物降低ApoE-/-小鼠主动脉组织炎症细胞因子的表达实时定量PCR检测结果(图5)显示,普洱茶提取物干预16周组ApoE-/-小鼠的主动脉组织IL-6、IL-12和TNFα mRNA表达分别比对照组下降(17.83±10.8)% 、(36.39±12.2)%和(43.73±14.8)%(P<0.05);而对血管组织中IL-8、IL-18、MMP9、ICAM和VCAM的表达无明显影响(P>0.05)。
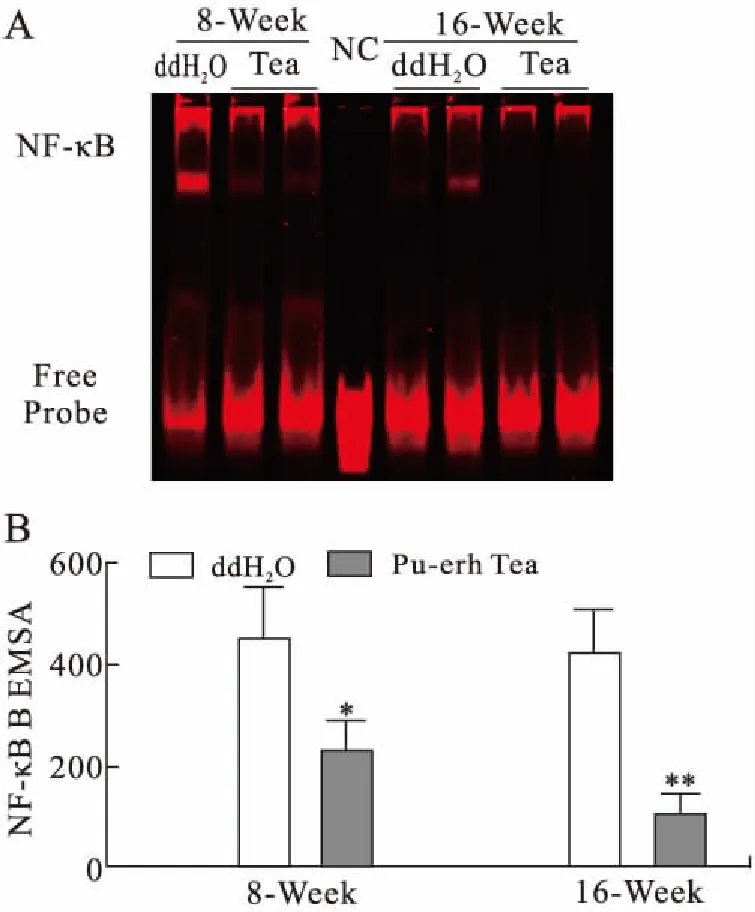
图4 EMSA分析巨噬细胞内NF-κB DNA结合活性变化(A)及统计学分析(B)
Fig.4 Effect of pu-erh tea extract intervention on NF-κB
与对照组(ddH2O组)比较,*P<0.05,**P<0.01(n=6)。
3 讨 论
巨噬细胞由血液循环中的单核细胞转化而来,吞噬氧化型低密度脂蛋白后转化为泡沫细胞[5-6]。巨噬细胞促进动脉粥样硬化的进展,是动脉粥样硬化斑块中最主要的炎性细胞,巨噬细胞凋亡可抑制斑块的进展和促进斑块修复,巨噬细胞可能是动脉粥样硬化的预防与治疗的重要靶细胞[5-6]。
发酵茶被证实具有调节血脂、抗炎、抗氧化的作用[7-9]。既往研究均观察到发酵茶中提取某一种成分对动脉粥样硬化的影响[10-12],但在动物或人类中,尚没有研究观察饮用普洱茶对动脉粥样硬化的影响,对巨噬细胞功能及凋亡的研究更是未见报道。本研究表明,普洱茶提取物喂养ApoE-/-小鼠16周明显减少主动脉粥样斑块面积和脂质沉积,同时观察到普洱茶提取物明确促进斑块中巨噬细胞凋亡,这提示饮用普洱茶可能通过促进巨噬细胞凋亡,抑制动脉粥样硬化形成。
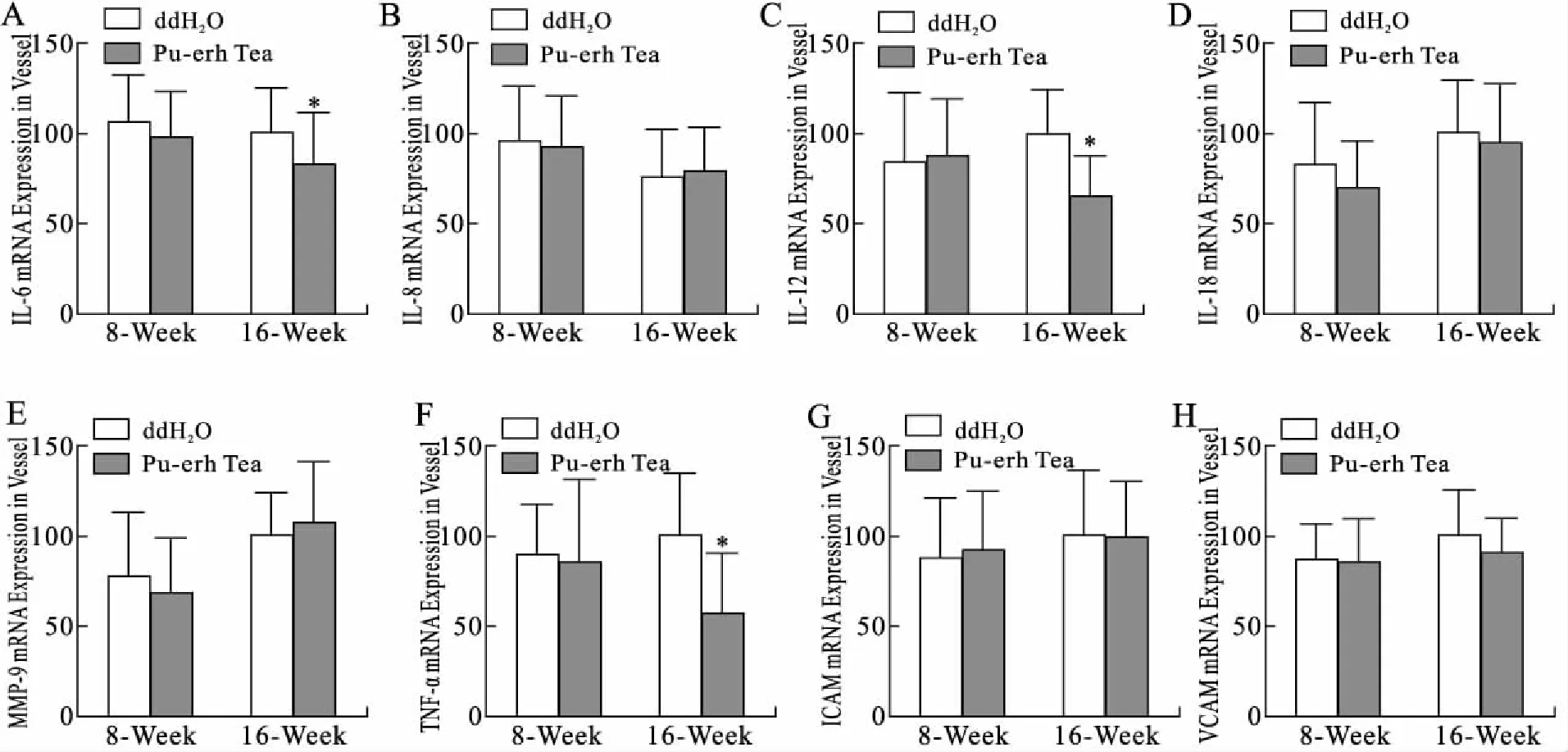
图5 普洱茶提取物对ApoE-/-小鼠主动脉组织中细胞因子mRNA表达的影响
Fig.5 Effect of pu-erh tea extract on the expression of cytokine mRNA in ApoE-/-mice aortic tissue
A~H:实时定量PCR检测结果统计学分析。与对照组(ddH2O组)比较,*P<0.05。
有研究发现,激活NF-κB能够抑制巨噬细胞凋亡[13]。本研究中,普洱茶提取物喂养小鼠8周及16周,主动脉脂质斑块内及巨噬细胞中NF-κB亚单位p65 蛋白表达及mRNA活性均明显降低;巨噬细胞内NF-κB DNA结合活性明显降低,提示饮用普洱茶可能通过抑制NF-κB表达及活性,进而促进巨噬细胞凋亡。IκB 是NF-κB 的抑制因子,本研究发现,短期普洱茶提取物喂养(8周),IκBβ mRNA及蛋白表达变化不明显,长期喂养(16周)则其mRNA及蛋白表达均下降明显,提示饮用普洱茶对NF-κB表达及活性的抑制作用并未通过IκBβ介导。
动脉粥样硬化的本质是动脉慢性炎症[1]。本研究发现,普洱茶提取物喂养干预16周后,ApoE-/-小鼠主动脉组织中TNFα、IL-6及IL-12 mRNA表达明显下降。提示饮用普洱茶降低体内炎症因子水平,进而对动脉粥样硬化的发展起到抑制作用。
综上可以得出结论:饮用普洱茶可能通过抑制NF-κB表达及活性,促进巨噬细胞凋亡,同时降低体内炎症因子水平,进而发挥抗动脉粥样硬化作用。此机制可能并未通过IκB介导,确切机制还需要在更多的动物模型和人群中进一步研究。
