螺内酯对慢性房颤模型兔心房结构重构的影响
2019-10-24王立立田国栋宋学莲孟存良
杨 倩, 王立立, 田国栋, 宋学莲, 孟存良
(1河北省人民医院心内科, 河北 石家庄 050051; 2容城县人民医院心内科, 河北 容城 071600)
心房颤动(atrial fibrillation,AF),简称房颤,是临床上最常见的心律失常[1],它可以导致心衰和脑卒中等多种并发症,并可引起死亡率增加[2]。随着我国人口老龄化进程的加速,房颤的发病率逐渐增加, 已经成为影响公众健康和加重社会负担的重要疾病[3],但目前房颤的治疗效果尚不尽如人意。因此,了解房颤的发病机制,从而探索房颤治疗的新方法,仍是临床亟待解决的问题。
心房结构重构在房颤的发生和维持中发挥重要作用,它可以导致房内及房间传导延迟、传导异质性增加,促进折返形成,从而导致房颤[4-5]。近年来的研究表明,基质金属蛋白酶(matrix metalloproteina-ses,MMPs),尤其是MMP-2和MMP-9的表达及活性增加是引起心房结构重构的关键因素[6-7],而螺内酯(spironolactone,SP)可以抑制MMPs的表达[8-9]。本研究通过快速心房起搏(rapid atrial pacing, RAP)3周建立兔慢性房颤模型,探讨螺内酯对于该模型兔心房结构重构及MMPs表达的影响。
材 料 和 方 法
1 动物和材料
选用新西兰兔24只作为实验对象,体重2.5~3.5 kg,由河北医科大学动物实验中心提供(合格证号:11400700277731)。动物心脏起搏器购自上海复旦旦华科技有限公司,起搏电压5 V,起搏频率为 600次/分。采用Philip IU22超声诊断仪测定各项心脏超声指标;采用苏州东方DF-5A型电生理刺激仪行心房Burst刺激。抗Ⅰ型胶原蛋白(collagenⅠ)和Ⅲ型胶原蛋白(collagenⅢ)抗体购自Bioworld;抗MMP-2、MMP-9和内参照β-actin抗体均购自ProteinTech。
2 主要方法
2.1兔房颤模型的建立 动物用3%戊巴比妥钠(1 mL/kg)经耳缘静脉注射麻醉,仰卧位固定于动物手术台上,备皮,于胸骨左缘第3、4肋间打开胸腔,暴露心脏,找到左心房,采用结扎左心耳的方法将起搏电极固定于左心房,引出电极,关闭胸腔。电极沿皮下隧道移行至右侧后背部,应用电生理刺激仪测试电极,保证裸露导线与心房肌接触良好,且与胸壁绝缘。于兔右侧背部脊柱旁制作起搏器囊袋,庆大霉素冲洗囊袋后,将动物起搏器与起搏电极连接固定,起搏器设置为关闭状态,置于皮下囊袋中[10]。术后用青霉素抗感染治疗,恢复1周。
2.2实验分组 实验兔随机分为3组:RAP和螺内酯组(RAP+SP组)给予开胸、固定左心房电极、持续心房起搏3周,自起搏开始前3 d至起搏3周结束,每日分别给予生理盐水10 mL和螺内酯20 mg/kg(溶解于10 mL生理盐水中)灌胃;假手术组(sham组)仅给予开胸、固定左心房电极,不起搏,不给药。每日行心电图检查,保证起搏器正常工作。
2.3超声心动图指标的测定 采用超声诊断仪于起搏前、后行经胸无创心脏超声检查,测量左心房内径(left atrial diameter,LAD)。于心尖4腔切面及心尖两腔切面,应用双平面面积长度法,在二尖瓣开放前测量左心房最大容量(left atrial maximal volume,LAVmax);在舒张末期(二尖瓣关闭后)测量左心房最小容量(left atrial minimal volume,LAVmin)。左心房射血分数(left atrial ejection fraction,LAEF)通过应用公式计算得出:LAEF(%)=(LAVmax-LAVmin)/LAVmax×100%[11]。
2.4房颤诱发率的测定 采用电生理刺激仪于起搏前、后行心房Burst刺激测定房颤诱发率。给予S1S1刺激,周长50 ms,电压为2倍舒张期阈值电压+0.5 V,重复8次(前4次每次6 s,后4次每次12 s)[12]。应用公式:房颤诱发率(%)=诱发房颤成功兔只数/行Burst刺激兔总只数×100%进行计算。
2.5心房间质纤维化程度的测定 采用4%多聚甲醛溶液固定左心房组织,石蜡包埋后制成厚度约为5 μm的石蜡切片,行Masson染色。显微镜下,心肌间质纤维呈蓝色,心肌细胞呈红色。每个标本选取5个视野,使用Image-Pro Plus 6.0软件对获得的图片进行图像分析,心房纤维化百分比(%)=心房纤维组织面积/(心房纤维组织面积+心房肌组织面积)×100%[12]。
2.6心房collagenⅠ、collagenⅢ、MMP-2和MMP-9蛋白表达水平的测定 取左心房心肌组织剪碎,用RIPA裂解液抽提心房肌组织总蛋白,Bardford比色法测定抽提蛋白的浓度。按照说明书进行操作,蛋白样品与4×蛋白质凝胶电泳上样缓冲液混合后电泳,然后采用半干转的方法转移到PVDF膜,PVDF膜经5% BSA封闭2 h,于经PBS稀释的Ⅰ抗工作液中4 ℃反应过夜,再经1×PBST稀释3 000倍的Ⅱ抗工作液处理90 min,蛋白条带通过显影定影液显色后,采用UVP分析仪器,对胶片进行扫描分析,系统自动生成灰度值。
3 统计学处理
运用SPSS 19.0软件包分析处理数据。计量资料采用均数±标准差(mean±SD)表示,各组组内前后测量数据比较采用配对样本t检验,3组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 动物的一般情况
Sham组家兔因手术死亡1只,RAP组和RAP+SP组各有1只因起搏电极脱位未完成实验而剔除。
2 超声心动图中各项指标的变化
起搏前3组兔心房的各项超声指标的差异均无统计学显著性(P>0.05)。起搏3周后,RAP组和RAP+SP组兔左心房较假手术组明显扩张,LAD、LAVmax和LAVmin明显增加(P<0.05),LAEF明显下降(P<0.05),但RAP组和RAP+SP组相比较,LAD、LAVmax、LAVmin和LAEF的差异无统计学显著性(P>0.05),见表1。

表1 左心房结构和功能的变化
*P<0.05vsbaseline;#P<0.05vssham group.
3 房颤诱发率的变化
起搏前对3组兔经心房Burst刺激均未能诱发房颤。起搏3周后,经心房Burst刺激后,sham组的动物均未诱发房颤,RAP组7只兔均诱发持续性房颤(诱发率100%),RAP+SP组7只兔中有5只诱发持续性房颤(诱发率71%)。
4 心房纤维化程度的变化
起搏3周后,RAP组心房纤维化百分比较sham组明显增加(P<0.05);RAP+SP组心房纤维化百分比较sham组明显增加(P<0.05),但较RAP组明显下降(P<0.05),见图1。
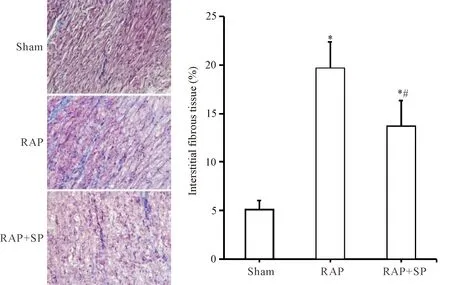
Figure 1. The left atrial myocardium with Masson trichrome-staining of the 3 groups after 3 weeks of RAP (×200). Mean±SD.n=7.*P<0.05vssham group;#P<0.05vsRAP group.
图1 起搏3周后3组兔左心房的Masson染色观察
5 心房collagenⅠ和collagenⅢ蛋白表达水平的变化
起搏3周后,RAP组和RAP+SP组的collagenⅠ和collagenⅢ蛋白表达水平较假手术组均明显增加(P<0.05),但RAP+SP组collagenⅠ和collagenⅢ的蛋白水平较RAP组下降(P<0.05),见图2。
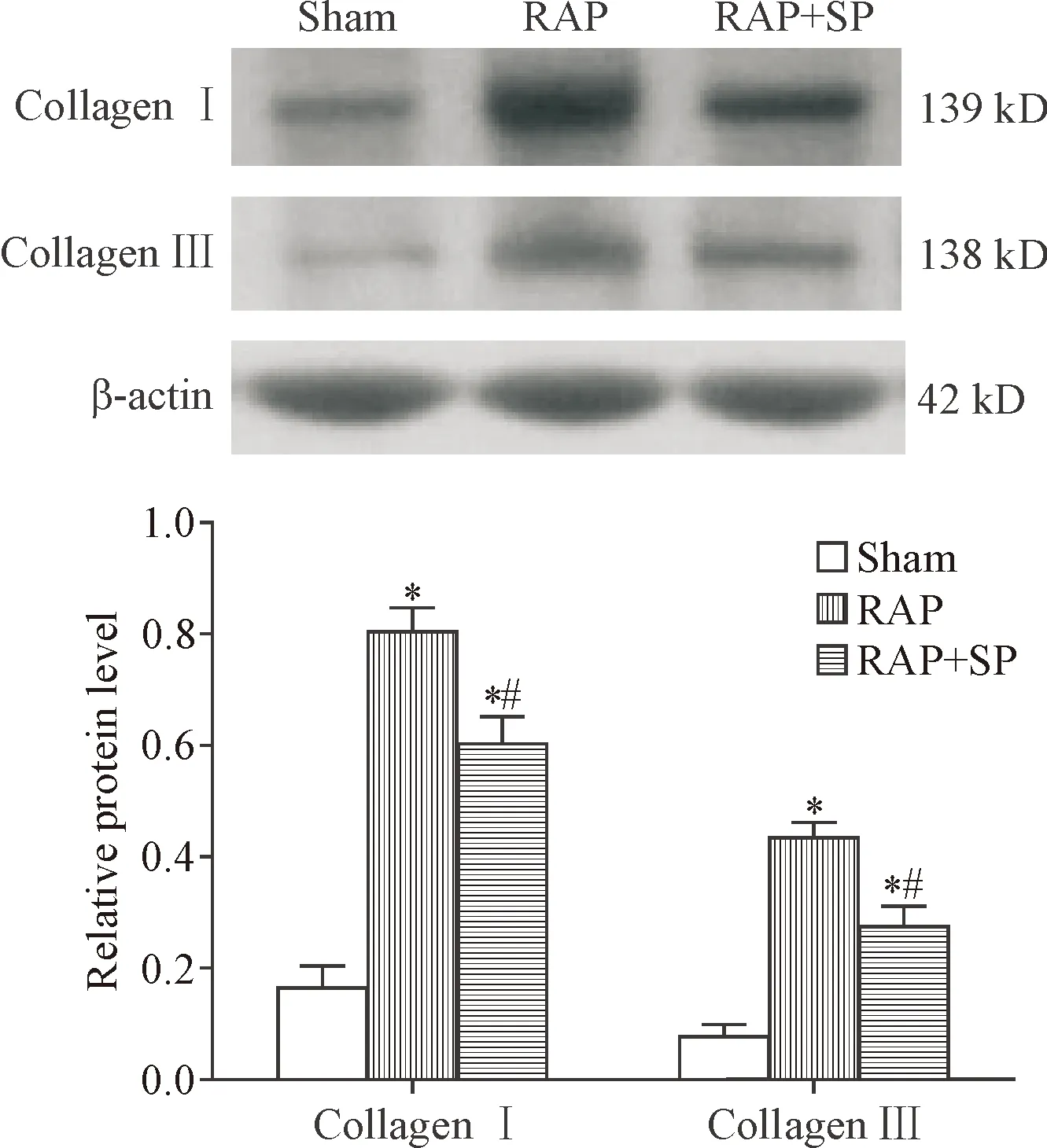
Figure 2. The protein expression of collagenⅠand collagen Ⅲ in the left atria. Mean±SD.n=7.*P<0.05vssham group;#P<0.05vsRAP group.
图2 左心房Ⅰ型和Ⅲ型胶原蛋白的表达水平
6 心房MMP-2和MMP-9蛋白表达水平的变化
起搏3周后,RAP组和RAP+SP组的MMP-2和MMP-9蛋白表达水平较sham组均明显增加(P<0.05),但RAP+SP组MMP-2和MMP-9的蛋白水平较RAP组下降(P<0.05),见图3。
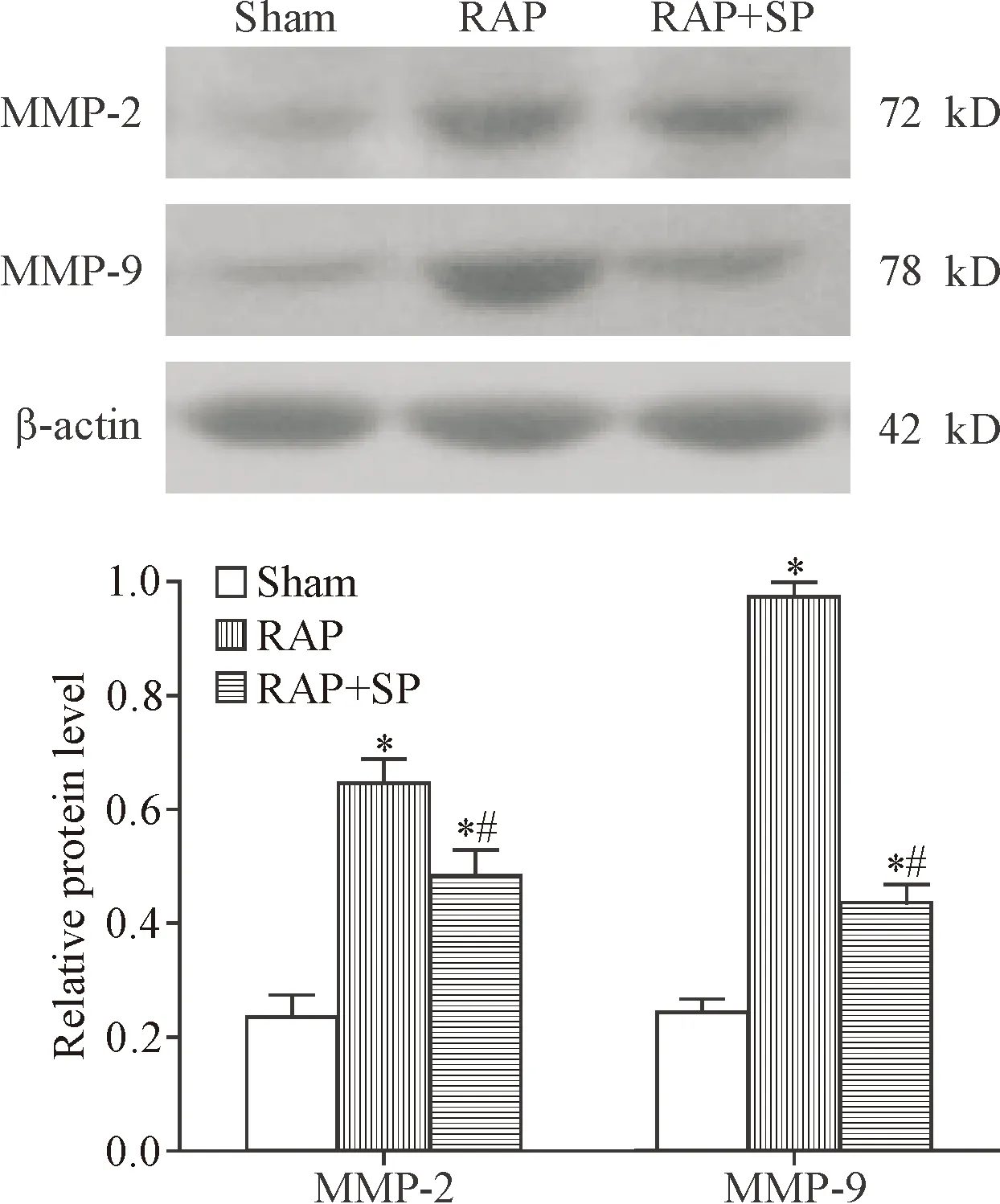
Figure 3. The protein expression of MMP-2 and MMP-9 in the left atria. Mean±SD.n=7.*P<0.05vssham group;#P<0.05vsRAP group.
图3 左心房MMP-2和MMP-9蛋白表达水平的变化
讨 论
房颤发生和维持的主要机制是心房重构,包括电重构和结构重构。相较于电重构,结构重构不完全可逆,其在房颤的发生和维持中发挥更为重要作用,主要表现为心房扩张和间质纤维化[4]。左房扩张是房颤的独立危险因素[13],相对于左心房内径而言,左心房容积在预测房颤复发方面是更准确的参考指标。心房间质纤维化是结构重构的特征性改变,持续性房颤患者心房间质纤维化程度明显增加[14]。我们既往的研究表明[10],快速起搏兔心房3周可引起左心房容积明显扩张,间质纤维化程度明显增加,但左心室的结构和功能均不受影响,因此兔慢性房颤模型是研究药物对心房结构重构的理想模型。本研究应用兔慢性房颤模型进行研究,结果显示:螺内酯能够抑制心房Ⅰ型和Ⅲ型胶原蛋白表达,抑制兔心房间质纤维化,从而抑制心房结构重构;螺内酯对于心房扩张无明显作用,这可能与心房扩张明显(LAVmax约为假手术组4倍),而药物干预时间相对较短有关。
MMPs是一组存在于细胞外基质的蛋白水解酶,生理状态下,激活的MMPs能够降解细胞外基质蛋白,维持心肌间质纤维蛋白稳定性;病理状态下,MMPs的过度激活则与心肌间质纤维化密切相关。多项临床研究和动物实验显示,MMPs,特别是MMP-2和MMP-9的表达和活性增加与心房结构重构密切相关,其可以引起心房细胞外胶原沉积增加,导致心肌纤维化水平增加[10, 15];抑制MMPs可以使心肌纤维化水平下降,进而降低房颤诱发率和诱发房颤的持续时间[9]; MMPs水平不仅与心血管人群房颤的发生相关[16],还与射频消融术后房颤的复发相关[17]。
醛固酮受体拮抗剂螺内酯可能通过抑制醛固酮所致的氧化应激反应,抑制心肌组织MMPs的表达和活性,从而发挥抑制心房结构重构的作用。Zhao等[9]的研究显示,螺内酯可以抑制慢性房颤模型犬心房MMP-9的表达,增加金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinase,TIMP)-1的表达,从而抑制心房结构重构,但其未评估螺内酯对于心肌组织MMP-2的作用。本研究评估了螺内酯对慢性房颤模型兔心房结构重构的作用,并对MMP-2和MMP-9可能发挥的作用进行了探讨,结果显示,螺内酯能够下调慢性房颤模型兔心房MMP-2和MMP-9蛋白的表达,这可能是其抑制心房结构重构的潜在作用机制。
