沉默XIST对结直肠癌细胞阿霉素耐药性的抑制作用及其机制*
2019-10-24王晓梅付曲波黄利兴谢斌辉
舒 涛, 王晓梅, 付曲波, 黄利兴, 谢斌辉
(赣南医学院第一附属医院 1消化内科, 2普外科, 江西 赣州 341000)
结直肠癌(colorectal cancer,CRC)是消化道系统常见肿瘤,在癌症相关死亡率中排名第2位[1]。近年来,由于遗传和环境因素,CRC的发病率和死亡率呈上升趋势[2-3]。化疗是CRC患者的重要辅助治疗手段之一。蒽环类药物阿霉素(adriamycin; 又称多柔比星,doxorubicin,DOX)广泛用于治疗包括CRC在内的多种恶性肿瘤,但DOX的耐药性是导致DOX化疗失败的主要原因[4-5]。因此,对DOX耐药分子机制的进一步阐明及有效逆转CRC化疗DOX耐药干预策略的研究是势在必行的。
X染色体失活特异转录物(X-inactive specific transcript,XIST) 的失调与多种肿瘤的发生有关,提示XIST可作为肿瘤的前驱标致性因子[6-7]。最新研究表明XIST在CRC中表达显著增加,且通过促进细胞增殖、迁移及侵袭来发挥致癌因子的作用[8]。XIST也在5-氟尿嘧啶(fluorouracil, 5-FU)耐药的CRC中高表达,过表达XIST可通过促进胸腺嘧啶的合成从而抑制5-FU对细胞的毒性[9],但XIST是否参与CRC的DOX耐药还有待进一步研究。因此,本研究观察沉默XIST对DOX耐药CRC细胞的作用,并进一步分析其潜在机制。
材 料 和 方 法
1 实验材料
人结直肠癌细胞系LoVo和HCT116细胞购自美国培养物保藏中心。胎牛血清和RPMI-1640培养液购自Gibco;XIST小干扰RNA(XISTsmall interfering RNA, si-XIST)和阴性对照(si-control)、miR-124小干扰RNA(anti-miR-124)和阴性对照(anti-miR-control)、miR-124和阴性对照(miR-control)由上海吉玛基因公司合成;抗P-糖蛋白(P-glycoprotein,P-gp)抗体购自Abcam;抗谷胱甘肽S-转移酶π(glutathioneS-transferase π, GST-π)抗体购自CST;RNA提取试剂盒、逆转录试剂盒和双萤光素酶试剂盒购自Thermo Scientific。细胞线粒体分离试剂盒、RIPA和MTT试剂购于江苏碧云天生物研究所。
2 方法
2.1DOX耐药细胞构建 按照文献[8]方法,HCT116和LoVo细胞通过反复暴露于浓度递增(0.01、0.02、0.04、0.08、0.16、0.32和0.50 mg/L)的DOX,获得最终在0.50 mg/L DOX稳定生长的DOX耐药的CRC细胞(HCT116/DOX和LoVo/DOX)。
2.2细胞培养 HCT116、LoVo、HCT116/DOX和LoVo/DOX细胞均接种在含有10%胎牛血清、100 mg/L链霉素和1×105U/L青霉素的RPMI-1640培养液中,置于37℃、5% CO2和95% O2的细胞培养箱中培养。
2.3细胞转染 浓度为1×109/L的细胞置于6孔板,细胞贴壁后,无血清培养液饥饿培养12 h,按照说明书方法,利用Lipofectamine 3000分别转染si-XIST、si-control、anti-miR-124、anti-miR-control、miR-124和miR-control,将混合物加入细胞,无血清培养液处理6 h后,换上新鲜完全培养液,继续37 ℃培养48 h。
2.4MTT检测细胞对DOX敏感性 每样本以5 000个细胞置于96孔板,细胞贴壁后,对细胞进行(0.05、0.1、0.5、1、5和10 mg/L) DOX处理24 h,按照MTT说明书检测细胞活性。往细胞培养液加入20 μL MTT试剂(5 g/L),37 ℃孵育2 h后,吸弃上清液,每孔加入150 μL DMSO,振荡10 min后,酶标仪490 nm波长检测吸光度(A值)。
2.5RT-qPCR检测RNA表达量 按照RNA提取试剂盒步骤抽提总RNA,并按照逆转录试剂盒步骤进行反转录为cDNA。然后根据引物和各样本cDNA对XIST与miR-124进行RT-qPCR反应。RT-qPCR反应设置为95 ℃反应10 min;92 ℃反应15 s, 55 ℃持续30 s,72 ℃持续30 s, 40个循环。反应结束后,miR-124以U6为内参照,XIST以GAPDH为内参照,以2-ΔΔCt法量化基因相对表达量。XIST的上游引物序列为5’-ACGCTGCATGTGTCCTTAG-3’,下游引物序列为5’-GAGCCTCTTATAGCTGTTTG-3’;miR-124的上游引物序列为5’-GCTTAAGGCACGCGG-3’,下游引物序列为5’-GTGCAGGGTCCGAGG-3’;GAPDH的上游引物序列为5’-CATGAGAAGTATGACAACAGCCT-3’,下游引物序列为5’-AGTCCTTCCACGATACCAAAGT-3’;U6的上游引物序列为5’-CTCGCTTCGGCAGCACA-3’,下游引物序列为5’-AACGCTTCACGAATTTGCGT-3’。
2.6萤光素酶报告基因实验 扩增包含预测的miR-124结合位点的野生型或突变型XIST,与萤光素酶报告载体pMIR-Report融合,即XIST-WT(XIST-WT1或XIST-WT2)和XIST-MUT(XIST-MUT1或XIST-MUT2),再与miR-control或miR-124共转染HCT116/DOX和LoVo/DOX细胞。转染后48 h,收集细胞,报告分析系统检测双萤光素酶,测定萤光素酶相对活性。
2.7Western blot法检测蛋白表达水平 按照实验目的,利用细胞线粒体分离试剂盒提取线粒体和去除线粒体成分的细胞质蛋白,或利用RIPA裂解液萃取细胞全蛋白。利用BCA法将各组蛋白样品定量至相同浓度后,取20 μg蛋白进行SDS-PAGE。电泳结束后,湿转法将蛋白质转移至甲醇预活化的PVDF膜,转膜条件为恒压100 V,时间为2 h。之后利用5%脱脂牛奶室温下封闭1 h并以1 ∶1 000的稀释比例孵育Ⅰ抗体, 4 °C过夜。次日,以TBST洗涤后室温孵育相应的HRP标记的II抗1 h,以TBST洗涤后利用化学发光成像仪显影。采用ImageJ软件扫描各条带灰度值后,以β-actin为内参照,对目的蛋白进行量化。
3 统计学方法
实验数据均以均数±标准差(mean±SD)表示,并使用GraphPad Prism 7.0软件对数据进行统计学分析。对于两组定量资料的比较采用双尾t检验;对于多组定量资料比较采用单因素方差分析后的LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 XIST在DOX耐药细胞系中高表达而miR-124在DOX耐药细胞系中低表达
用RT-qPCR检测XIST与miR-124在2种DOX耐药结直肠癌细胞系LoVo/DOX及HCT116/DOX中的表达。结果显示,与亲本细胞系LoVo和HCT116相比,在2种DOX耐药细胞系中XIST均显著上调(P<0.05),见图1A、B,而miR-124均显著下调(P<0.05),见图1C、D。
2 下调XIST可减弱结直肠癌细胞的DOX耐药
通过MTT实验检测DOX对2种DOX耐药结直肠癌细胞系LoVo/DOX、HCT116/DOX及其亲本细胞系LoVo、HCT116的IC50,结果显示DOX对LoVo/DOX及HCT116/DOX 2种耐药细胞系的IC50均显著高于其亲本细胞系LoVo和HCT116 (P<0.05),见图2A~D。为了研究XIST在耐药中的作用,利用小干扰RNA方法在LoVo/DOX及HCT116/DOX细胞系中沉默XIST,利用RT-qPCR证明沉默效果均较好 (P<0.05),见图2E、F;同时检测耐药蛋白P-gp及GST-π的表达水平,结果显示,在沉默XIST后,P-gp及GST-π蛋白水平均显著降低(P<0.05),见图2G、H。
3 XIST通过与miR-124直接结合抑制其在DOX耐药结直肠癌细胞中的表达
为了探寻XIST致CRC细胞DOX耐药的机制,本研究利用miRcode数据库来寻找XIST可能调控的miRNAs,结果显示miR-124的2段序列可能与XIST结合,见图3A。为了确定两者的相互作用,本研究构建了野生型及突变型XIST与miR-124结合。双萤光素酶报告基因实验结果显示,共转染miR-124和野生型XIST的细胞中萤光素酶活性显著降低(P<0.05),而突变型XIST则没有显著差异(P>0.05),见图3B~E。
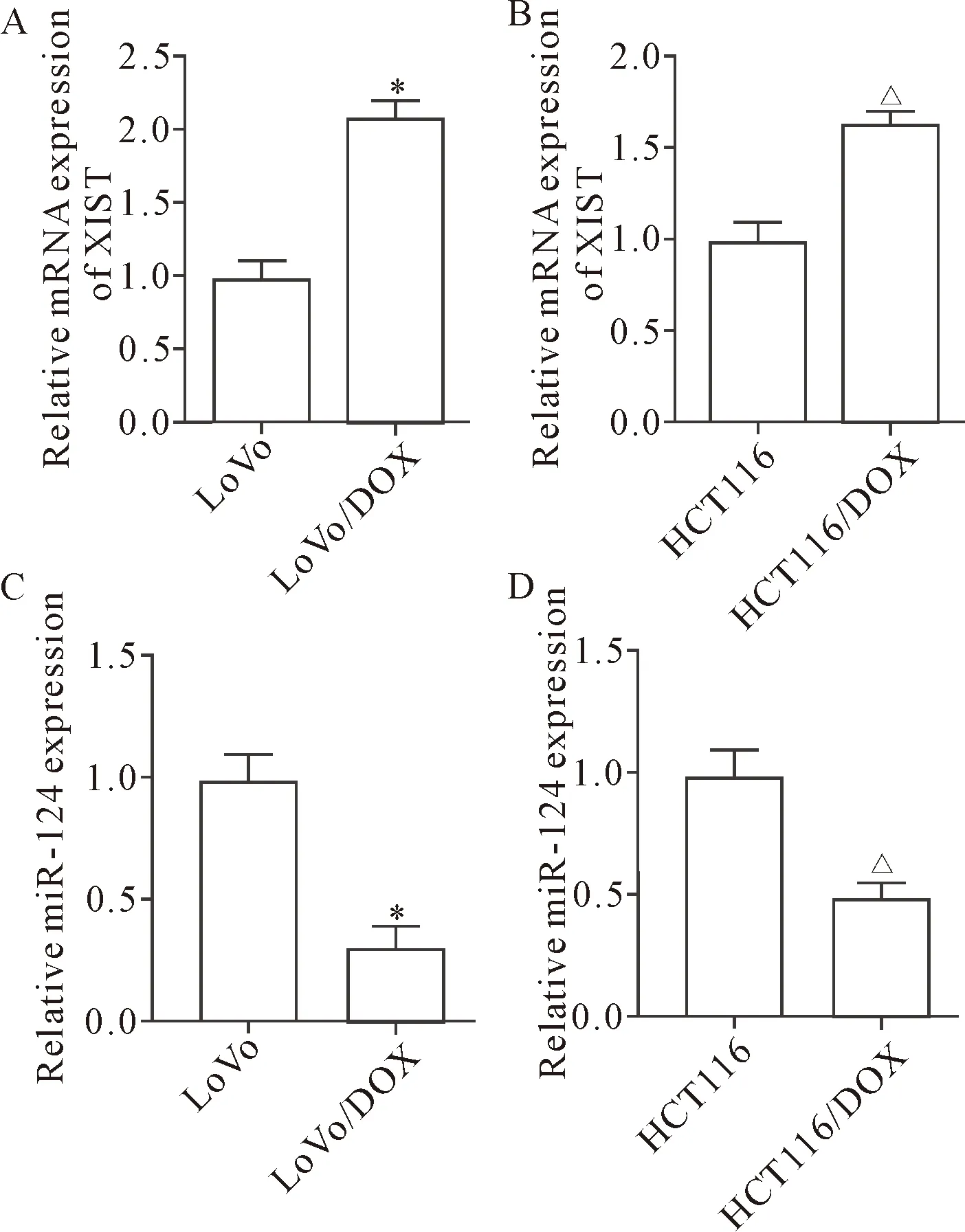
Figure 1. The expression level of XIST and miR-124 in DOX-resistant CRC cells were analyzed by RT-qPCR. A:the mRNA expression of XIST in LoVo and LoVo/DOX cells;B:the mRNA expression of XIST in HCT116 and HCT116/DOX cells;C:the expression of miR-124 in LoVo and LoVo/DOX cells;D:the expression of miR-124 in HCT116 and HCT116/DOX cells. Mean±SD.n=3.*P<0.05vsLoVo cells;△P<0.05vsHCT116 cells.
图1 XIST与miR-124在DOX耐药细胞中的表达情况
4 下调XIST可通过miR-124提高DOX耐药结直肠癌细胞的化疗效果
为了探寻XIST是否通过miR-124来影响CRC细胞DOX耐药,本研究将miR-124、si-XIST或si-XIST+anti-miR-124转染LoVo/DOX及HCT116/DOX细胞。Western blot显示转染miR-124或沉默XIST显著降低耐药蛋白P-gp及GST-π的表达(P<0.05);而共转染si-XIST+anti-miR-124则可逆转由沉默XIST导致的LoVo/DOX细胞及HCT116/DOX细胞的P-gp及GST-π表达降低(P<0.05),见图4。
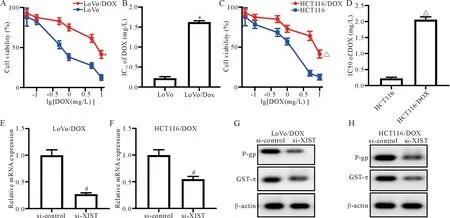
Figure 2. XIST down-regulation impaired DOX resistance in DOX-resistant CRC cells. A~D: the viability was measured by MTT assay after LoVo, HCT116, LoVo/DOX and HCT116/DOX cells were exposed to DOX at various concentrations (0.05, 0.1, 0.5, 1, 5, and 10 mg/L) for 24 h; E and F: the relative mRNA expression of XIST was detected by RT-qPCR in LoVo/DOX and HCT116/DOX cells after transfection with si-XIST or si-control; G and H: the protein levels of P-gp and GST-π in LoVo/DOX and HCT116/DOX cells transfected with si-XIST or si-control were analyzed by Western blot. Mean±SD.n=3.*P<0.05vsLoVo cells;△P<0.05vsHCT116 cells;#P<0.05vssi-control group.
图2 下调XIST可减弱结直肠癌细胞的DOX耐药

Figure 3. XIST repressed miR-124 expression in DOX-resistant CRC cells by direct binding. A: two miR-124 binding sites were predicted on XIST by miRcode; B~E: luciferase reporter assay was performed in LoVo/DOX and HCT116/DOX cells after cotransfection with miR-124 or miR-control and XIST-WT (XIST-WT1 or XIST-WT2) or XIST-MUT (XIST-MUT1 or XIST-MUT2). Mean±SD.n=3.*P<0.05vsXIST-WT+miR-control.
图3 XIST通过与miR-124直接结合抑制其在DOX耐药结直肠癌细胞中的表达

Figure 4. XIST down-regulation reduced chemoresistance of DOX-resistant CRC cells to DOX via regulating miR-124. LoVo/DOX and HCT116/DOX cells were transfected with miR-control, miR-124, si-control, si-XIST, si-XIST+anti-miR-control or si-XIST+anti-miR-124. Western blot was performed to detect the protein levels of P-gp and GST-π in transfected LoVo/DOX (A) and HCT116/DOX (B) cells. Mean±SD.n=3.*P<0.05vsmiR-control group;#P<0.05vssi-control group;△P<0.05vssi-XIST+anti-miR-control group.
图4 下调XIST可通过miR-124提高DOX耐药结直肠癌细胞的化疗效果
讨 论
XIST在胃癌、乳腺癌和直肠癌等肿瘤中具有致癌作用[6-8]。而临床结直肠癌的治疗过程中,肿瘤耐药性是化疗失败的常见原因。研究发现,XIST在耐5-FU的CRC细胞中显著上调,XIST的过表达可抑制5-FU导致的CRC细胞毒性[9]。DOX也常用于CRC的化疗,但XIST是否也影响CRC细胞对DOX的耐药性研究尚少。为了解决这个问题,本研究检测XIST在耐DOX的CRC细胞中的表达,显示在DOX耐药的CRC细胞中,XIST表达异常上调。此外,XIST基因沉默降低了DOX耐药的CRC细胞中P-gp和GST-π蛋白水平。而P-gp及GST-π是导致细胞DOX耐药的关键蛋白,可将DOX泵出胞外[10]。因此,XIST沉默可增加细胞对DOX的化疗敏感性。
XIST可通过调节miRNA的表达,最终导致miRNA的靶mRNA失活或增强活性而发挥生物学效应[6,11-13]。沉默XIST可以扮演miR-101的分子海绵作用,作为zeste同源基因EZH2的增强子来起到抗肿瘤的作用[11-12]。XIST的过表达可通过上调miR-34a-5p的表达来增强鼻咽癌细胞的增殖[13]。miR-124表达参与调节多种肿瘤化疗药物敏感性[14-18]。上调miR-124可抑制P-gp介导的肾癌FZD5耐药性[15]。最近研究表明,在非小细胞肺癌中,miR-124过表达可提高吉非替尼的敏感性[16]。另外,miR-124-3p可作为潜在的增强乳腺癌阿霉素化疗敏感性的治疗靶点[17]。在CRC中,miR-124可以通过抑制靶基因DNMT3B和DNMT1促进CRC细胞对顺铂和5-FU的敏感性[18]。基于此,本研究旨在了解XIST是否可以与miR-124相互作用,以参与CRC耐DOX的调节,同时阐明XIST对CRC耐DOX的潜在机制,为逆转CRC的DOX耐药提供治疗靶点。在本研究中,发现XIST与miR-124存在结合区域;miR-124在耐DOX的CRC细胞中低表达,且过表达miR-124可抑制CRC的DOX耐药细胞中P-gp和GST-π蛋白水平;进一步研究表明,共转染si-XIST+anti-miR-124则可逆转由沉默XIST导致的CRC的DOX耐药细胞中的P-gp及GST-π的降低。这些结果提示,沉默XIST可能通过调节miR-124进而抑制下游P-gp和GST-π蛋白水平来发挥抗DOX耐药性。
综上所述,本研究证明了XIST在DOX耐药细胞系中高表达,而沉默XIST可起到miR-124的分子海绵作用,从而提高CRC对DOX的敏感性。因此,XIST可作为治疗DOX耐药的CRC患者的潜在干预靶点。
