敲减NEDD1表达抑制肺腺癌细胞增殖与迁移*
2019-10-24郭君琪张滢泉李春桥王浛睿孔丽君胡金霞
郭君琪, 杨 赟, 张滢泉, 李春桥, 王浛睿, 孔丽君, 胡金霞
(滨州医学院生物化学与分子生物学实验室, 山东 烟台 264003)
肺癌是全世界最常见的恶性肿瘤之一,每年约有160万人死于肺癌[1]。所有肺癌患者中大约85%为非小细胞肺癌,其中肺腺癌和肺鳞癌是最常见的亚型[2-3]。神经前体细胞表达发育下调蛋白1(neural precursor cell expressed developmentally down-regulated protein 1,NEDD1)基因定位于染色体12q22,是最早在小鼠中枢神经系统发现的发育调控基因,编码一种由660个氨基酸残基构成的蛋白质[4],其N末端为7个WD40重复结构域(WD40 repeat domain),该结构域通常被视为可与其它蛋白质发生相互作用的区域。多种含WD40重复结构域的蛋白被报道与肿瘤的发生发展相关[5],对NEDD1的研究目前主要集中于其在胚胎发育和细胞有丝分裂中的生物学功能和调控方面,而NEDD1与肿瘤发生发展的关系研究较少。我们前期分析肿瘤公共数据库资料发现NEDD1在肺癌和癌旁组织中的表达有差异性,因此本文拟对肺癌组织标本中NEDD1的表达情况进行初步检测,以非小细胞肺癌A549细胞为研究对象,结合细胞功能实验和数据库资料分析,明确NEDD1表达与肺癌的关系,并探讨其在肺癌发生发展中的作用。
材 料 和 方 法
1 组织标本的收集与细胞培养
收集烟台山医院15例肺癌患者(男7例,女8例)手术切除的肿瘤组织及配对癌旁正常组织,并固定切片备用。肺腺癌细胞系A549购自上海中科院细胞库,用含10%胎牛血清(fetal bovine serum, FBS)的RPMI-1640培养基,于37 ℃、5% CO2条件下培养。
2 实验试剂
兔抗人NEDD1抗体(13993-1-AP)购自Proteintech;HRP标记的山羊抗兔IgG(PV-6001/6002)、PBS缓冲液(ZLI-9062)、 EDTA抗原修复液(ZLI-9067)和DAB显色试剂盒(ZLI-9018) 购自中杉金桥公司;Annexin V-FITC/PI细胞凋亡试剂盒(50 TWLA001b)购自万类生物科技有限公司;RIPA裂解液(强)购自赛尔斯生物技术有限公司;PageRuler Prestained Protein Ladder购自Thermo Scientific;NEDD1 小干扰RNA(NEDD1 small interfering RNA, si-NEDD1) 5’-GGGCAAAAGCAGACAUGUGTT-3’购自Sigma;Transwell 小室购自BD;细胞周期检测点蛋白抗体(#9917)购自Cell Signaling Technology。
3 实验方法
3.1免疫组织化学染色 石蜡包埋组织切片,置于60 ℃烤箱烤2 h,二甲苯溶液常温脱蜡2次,每次20 min,梯度乙醇充分水化,每梯度5 min,PBS洗3次,每次5 min,3%过氧化氢封闭10 min,使用EDTA抗原修复液修复3 min,自然冷却。4% 山羊血清封闭20 min,滴加 I 抗,浓度为1∶100,4 ℃孵育过夜。次日室温复温30 min,PBS洗 3次,每次5 min,滴加 II 抗,室温孵育 30 min,滴加DAB观察染色情况,苏木精染核,盐酸乙醇分化,流水返蓝15 min,中性树脂封片,室温下显微镜观察。
3.2流式细胞术检测细胞凋亡 细胞接种于6孔板中,培养到次日细胞约30%~40%融合,分别转染si-NEDD1(实验组)及空白对照小干扰RNA(control siRNA, si-Con)(对照组),48 h后PBS洗涤1次,胰蛋白酶消化,收集细胞,1 000 r/min离心5 min,弃上清,PBS洗涤 1 次,加500 μL缓冲液重悬细胞,加入5 μL Annexin V-FITC 混匀,加入5 μL Propidium Iodide, 1 h内上流式细胞仪检测。
3.3流式细胞术检测细胞周期 收集细胞,PBS 漂洗后,用1 mL 70% 的乙醇重悬,-20 ℃固定过夜,次日1 500 r/min离心 5 min沉淀细胞,用预冷PBS 漂洗后,加入100 μL RNA酶重悬,37 ℃水浴30 min, 加400 μL Propidium Iodide染色液混匀,4 ℃避光30 min,上流式细胞仪检测。
3.4平板集落形成实验检测细胞增殖 细胞转染24 h后收集细胞并计数,按每培养皿约1 000个细胞的密度接种于10 cm细胞培养皿,常规培养2周后去掉上层培养基,PBS洗涤, 4%的多聚甲醛固定30 min,PBS洗2次,结晶紫染色10 min,流水冲洗,干燥。
3.5Western blot检测蛋白表达 RIPA试剂裂解细胞30 min,期间每10 min摇匀1次。加入loading buffer后95 ℃煮蛋白变性 10 min, 4 ℃ 冷却,待用。行10%的 SDS-PAGE分离蛋白,200 mA,90 min 恒流转移到 PVDF 膜,用含 5% BSA的 TBST室温封闭2 h。加入 I抗4 ℃孵育过夜;次日TBST 洗膜3次,每次10 min,加入HRP标记的山羊抗兔IgG 4 ℃孵育2 h。洗膜3 次,每次15 min,ECL曝光成像。 数据用ImageJ软件分析条带灰度值,以GAPDH 为内参照。
3.6Transwell小室实验检测细胞的迁移能力 将Transwell小室放入24孔板中,上层分别加入纯RPMI-1640培养基重悬的实验组和对照组细胞各100 μL,浓度约为108/L,小室下层加600 μL 含20% FBS 的RPMI-1640培养基,每组3个平行孔,37 ℃、5% CO2培养20 h后取出小室,棉签擦拭上层,4%多聚甲醛固定30 min,结晶紫染色10 min,PBS清洗3 min,观察并计数。实验重复3次。
4 统计学处理
用SPSS 21.0软件对数据进行统计分析。Log-rank 检验进行生存分析,两组间比较满足正态分布采用独立样本t检验,不满足正太分布采用秩和检验,计量数据以均数±标准差(mean±SD)表示,以P<0.05为差异有统计学意义。
结 果
1 NEDD1在肺癌组织中表达升高
为明确NEDD1在肺腺癌组织中的表达情况,应用免疫组化法检测了15例肺癌与癌旁正常组织中NEDD1的表达水平,结果显示,与正常肺组织相比,肺腺癌组织中NEDD1表达明显增多,而正常肺组织则低表达甚至不表达,见图1A;分析TCGA数据库资料也显示NEDD1在肺腺癌组织中表达高于正常组织(P<0.01),见图1B,说明NEDD1表达可能与肺癌发生发展相关。进一步分析TCGA数据库资料预后显示NEDD1低表达患者预后良好,而高表达者预后较差(P<0.01),见图1C,表明NEDD1在肺癌组织中高表达与预后不良有关,可以作为肺癌的诊断与预后指标。
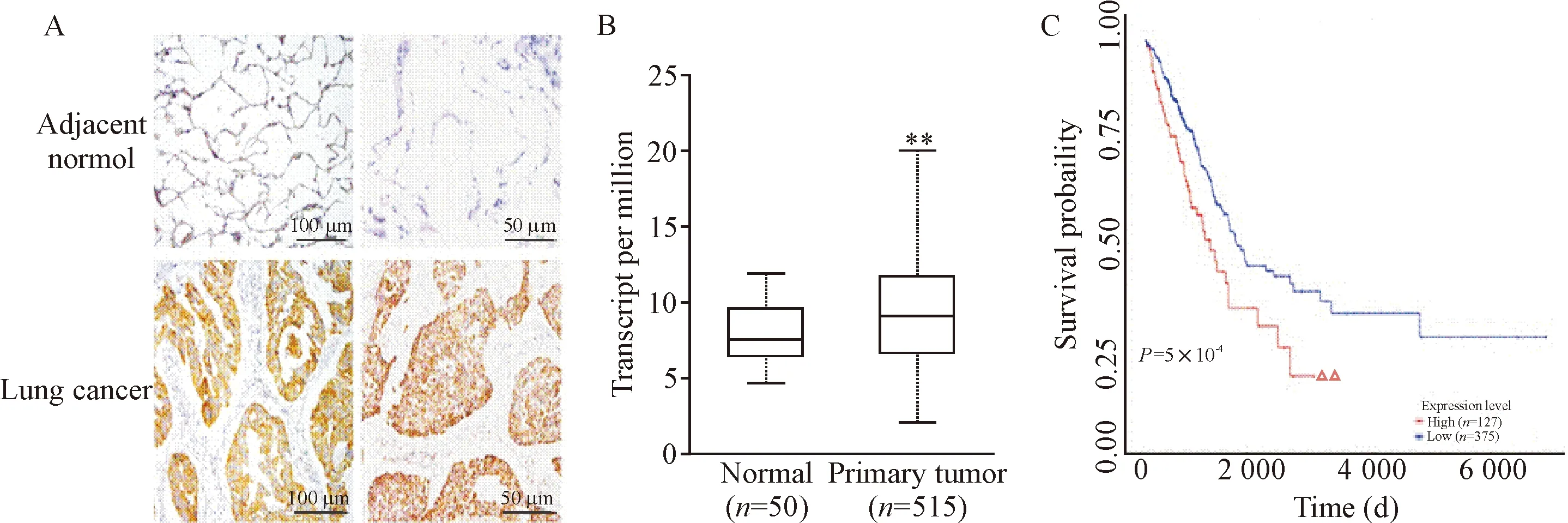
Figure 1. The expression of NEDD1 in lung cancer and adjacent normal tissues and its correlation with prognosis. A: the expression of NEDD1 in the lung cancer and adjacent normal tissues; B: the expression of NEDD1 in LUAD from TCGA; C: database analyze showed the effect of NEDD1 expression on the survival of LUAD patients. Mean±SD.**P<0.01vsnormal group;△△P<0.01vslow expression group.
图1 NEDD1在肺癌及癌旁正常组织中的表达及NEDD1表达与预后的相关性分析
2 敲减NEDD1 表达抑制A549细胞增殖
为检测NEDD1对肺腺癌细胞生长增殖的影响,转染si-NEDD1及si-Con 48 h后,光镜下观察细胞生长,可见实验组转染si-NEDD1后细胞增殖速度明显减低(P<0.01),见图2A,Western blot实验结果显示小干扰RNA可显著下调NEDD1表达(P<0.01),见图2B。平板集落形成实验结果进一步显示,敲减NEDD1表达后,A549细胞的集落形成能力降低(P<0.01),见图2C。以上结果表明敲减NEDD1的表达抑制肺癌细胞增殖。
3 敲减NEDD1表达促进细胞凋亡,抑制细胞迁移
细胞凋亡率的高低可以影响细胞的增殖速度,为检测NEDD1对细胞凋亡的作用,将A549细胞转染si-Con及si-NEDD1后,流式细胞术检测细胞凋亡情况,发现对照组的凋亡率为9.4%,实验组的凋亡率上升至26.5%(P<0.05),见图3A。肿瘤细胞的恶性表型还表现在侵袭转移方面,细胞迁移实验结果显示,敲低NEDD1表达后,实验组较对照组迁移至Transwell小室膜的细胞数明显减少(P<0.01),见图3B,说明敲减NEDD1表达后A549细胞的迁移能力减弱。以上实验结果表明敲减NEDD1表达促进细胞凋亡,抑制细胞迁移。
4 敲减NEDD1表达阻滞细胞周期
除影响细胞凋亡之外,有些具有促癌作用的蛋白质还可以通过参与调控细胞周期影响细胞的增殖速度,为明确NEDD1是否能够影响细胞周期进程,敲低A549细胞NEDD1表达后,流式细胞术检测细胞周期,结果显示,实验组 G0/G1期的比例(76.96%)较对照组(61.54%)显著升高,S期比例却呈下降趋势(P<0.01),表明A549细胞周期被阻滞在G0/G1期,见图4A。为探讨相关机制我们进行了Western blot实验和数据库的数据分析,发现p-Rb、CDK2和cyclinD1的蛋白水平降低,p-p53、p-Chk1和p-Chk2表达均上调(P<0.05),且通过对TCGA数据库中肺腺癌组织中相关蛋白mRNA表达水平分析发现CDK2的表达与NEDD1呈正相关(P<0.05),见图4B、4C,表明敲减NEDD1表达可影响细胞周期进程。
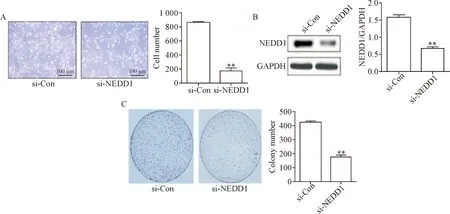
Figure 2. Effect of knock-down of NEDD1 expression on the proliferation of A549 cells. A: the cells were observed under inverted microscope after the transfection with si-NEDD1; B: the protein expresssion of NEDD1 after knock-down ofsiNEDD1expression; C: the results of colony formation assay of A549 cells after transfected with si-NEDD1. Mean±SD.n=3.**P<0.01vssi-Con group.
图2 敲减NEDD1表达对A549细胞增殖的影响
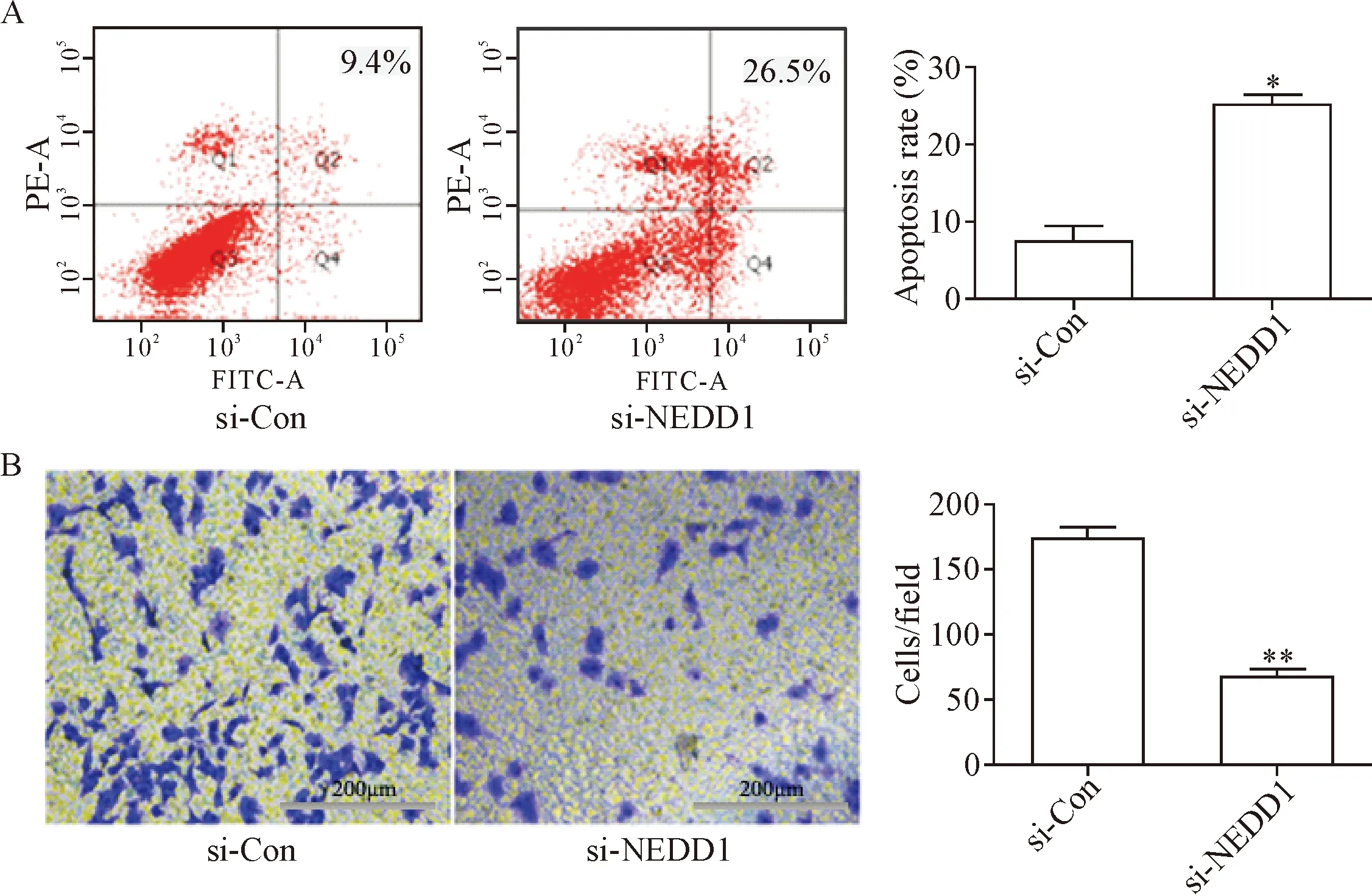
Figure 3. Effect of knock-down of NEDD1 expression on apoptosis and migration ability of A549 cells. A: flow cytometry analysis was used to test the apoptosis in the A549 cells after transfeced with si-NEDD1; B: the number of migratiing cells after treatment with si-NEDD1. Mean±SD.n=3.*P<0.05,**P<0.01vssi-Con group.
图3 敲减NEDD1表达对A549细胞凋亡和迁移能力的影响
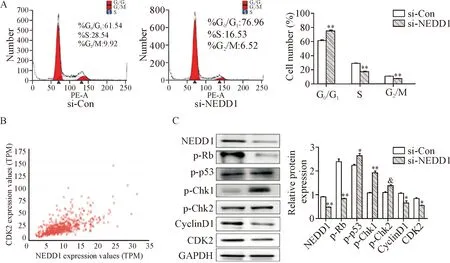
Figure 4. Effect of knock-down of NEDD1 expression on cell cycle and related protein levels. A: the results of flow cytometry for analyzing the cell cycle distribution; B: the correlation in gene expression betweenNEDD1andCDK2; C: the representative results of Western blot for determining the related protein levels. Mean±SD.n=3.*P<0.05,**P<0.01vssi-Con group.
图4 敲减NEDD1表达对细胞周期及相关蛋白水平的影响
讨 论
NEDD1最初发现于小鼠的神经前体细胞,同期被发现的NEDD4和 NEDD9等都被证实参与了肿瘤的发生发展。现阶段NEDD1的研究主要集中在细胞有丝分裂过程中纺锤体和中心体形成方面,NEDD1的羧基末端结构域经过Cdk1、Pik1和Nek9次序磷酸化后可与γ-tubulin相互作用[6-10],并将其募集到中心体,与其它蛋白质形成一个大的复合物,即γ-微管蛋白环状复合体(γ-tubulin ring complex,γ-TuRC)[11-12],因此NEDD1是中心体微管成核、纺锤体组装以及中心粒复制相关的蛋白质,对细胞正常有丝分裂起到非常重要的作用。NEDD1的众多研究都显示了其在细胞有丝分裂中的重要作用[13]。
已知,几乎所有肿瘤的发生都与细胞异常分裂有关,细胞有丝分裂相关蛋白异常表达也是一个普遍的现象。有研究显示腹腔注射靶向NEDD1的小干扰RNA,可明显延长胃癌腹腔转移模型鼠的生存期,提示 NEDD1有可能参与肿瘤的发生发展[14]。本研究发现NEDD1在肺癌组织中的表达明显高于正常组织,这与数据库资料的分析结果一致,并且大数据分析结果还显示NEDD1低表达的患者预后良好,而高表达者的预后较差。在接下来的功能研究中,我们发现NEDD1具有促进肺癌细胞株A549增殖、抑制凋亡,加速细胞周期进程,并促进细胞迁移的作用,表明NEDD1有可能作为促肿瘤因子参与了肺癌的发生发展过程,并可能作为肺癌诊断和评估预后的新靶标。
为揭示NEDD1促进A549细胞增殖的机制,我们在敲减NEDD1表达后,检测了细胞周期检测点相关蛋白的表达,发现p-Rb和cyclinD1下调,p-Chk1和p-Chk2升高。同时对数据库中基因表达数据分析发现,在肺腺癌组织中,NEDD1与CDK2的表达呈现出正相关。CDK2作为细胞周期的影响因子能够明显促进细胞生长,使细胞顺利通过G1期,与本研究中敲减NEDD1将肺腺癌细胞阻滞于G1期结果一致,提示NEDD1有可能通过调节CDK2的表达影响了细胞周期进程,甚至细胞凋亡和细胞增殖。p-Chk1和p-Chk2富集于G2期,但在流式细胞术中并未表现出G2期的阻滞,除此之外p-Chk1和p-Chk2还可作为ATM/ATR的下游信号分子参与经典的细胞DNA损伤通路,Inanç等[15]将NEDD1 作为检测DNA损伤的参考蛋白,敲减NEDD1表达后p-Chk1和p-Chk2的蛋白水平升高可能与DNA的损伤有关,p-P53 升高更加验证了这一点。
另外,NEDD1的N末端为WD40重复结构域,折叠成β-螺旋样结构。同样含有WD40重复结构域的蛋白质WDR5可抑制p53泛素化而上调p53蛋白从而影响肺癌细胞的增殖和凋亡[16],NEDD1同家族的NEDD4和NEDD8都与蛋白质泛素化降解途径有密切关系[17-20],NEDD1是否能够通过调控p53的泛素化进而调控细胞的增殖和凋亡有待于进一步的研究,NEDD1是否还与其它蛋白质通过WD40结构域相互作用,并参与其它尚未知的肿瘤生物学行为调控也是值得关注的问题。
总之,我们的数据表明,干扰NEDD1的表达可抑制肺癌A549细胞的增殖,促进细胞凋亡,阻滞细胞周期并抑制细胞迁移,而其高表达与肺癌患者预后不良密切相关,因此,NEDD1有可能成为新的肺癌诊断、预后的标记分子及治疗的新靶点。
