醒脑静注射液溶血性研究
2019-10-23刘勤王璐张红宇
刘勤 王璐 张红宇


【摘 要】 目的:对市场上流通的醒脑静注射液在溶血性方面进行考察研究。方法:参考《中国药典》2015年版四部生物检查法及注射剂安全性检查法应用指导原则和中药、天然药物刺激性和溶血性研究的技术指导原则,对市售所有厂家的34批醒脑静注射液分别制备成3个浓度进行溶血试验研究,并采用肉眼观察法和分光光度法判定溶血结果,比较两种方法的差异性。结果:相同厂家不同批次、不同厂家间醒脑静注射液的溶血率存在差异,另外,在溶血率为5%~15%时,肉眼观察法存在漏判现象。结论:在临床使用和实验室监测中应该高度重视醒脑静注射液溶血的不良反应,建议在其现行标准中增加“溶血与凝聚”安全性检查项目,并采用分光光度法测定溶血率。
【关键词】 醒脑静注射液;溶血性;肉眼观察法;分光光度法
【中图分类号】R965.3 【文献标志码】 A【文章编号】1007-8517(2019)14-0013-04
醒腦静注射液是一种常用的复方中药急救制剂,是由传统名方“安宫牛黄丸”改制而成的新型水溶性中药注射液,具有清热解毒,凉血活血,开窍醒脑的作用,静脉注射后可通过血脑屏障直接作用于中枢神经系统[1]。随着中药注射剂在临床应用愈来愈广泛,出现了诸多不良反应事件,使中药注射剂的安全有效性和全面质量控制引起了社会的广泛关注[2],醒脑静注射液作为急症用药不良反应也是屡见不鲜[3]。溶血与凝聚作为评价注射剂安全性的重要指标之一,在醒脑静注射液现行的质量标准中未收载 [4]。对于注射剂溶血项目的检测,《中国药典》 2015 年版规定采用肉眼观察法对注射剂的溶血进行检测和判定[5],此方法简便、易行,适于溶血明显的样品,但对于溶血不明显或肉眼无法判定的情况,检验人员的主观误差影响较大。为了更加准确的判断结果,需要寻找一种更有效、 简便的方法。根据《药物研究技术指导原则》 [6]以及文献报道[7-8],对于注射剂溶血的检测,有红细胞计数法、 紫外分光光度法、 体内溶血试验法以及乳酸脱氢酶活性测定法。结合注射剂生产企业实验室的情况和判断的准确性,笔者采用肉眼观察法和紫外分光光度法对醒脑静注射液的溶血与凝聚进行系统性考察。
1 材料与仪器
1.1 材料 34批醒脑静注射液,A药业15批,B药业4批,C药业15批;规格:5mL、2mL、10mL;氯化钠注射液批号:C181219A,昆明南疆制药有限公司产品。
1.2 试验动物 家兔,体重2.5~3.0kg。
1.3 仪器 TGL-16M高速台式冷冻离心机,长沙湘仪离心机仪器有限公司; UV-2550PC分光光度计,日本岛津;Grant SUB28恒温水浴,Grant Instruments (Cambridge)Ltd; ZH-2型旋涡混合器,天津药典标准仪器厂。
2 试验方法
2.1 红细胞悬液的制备 每次取兔心脏血约10mL,置含玻璃珠的烧杯中振摇约10min,除去纤维蛋白原使成脱纤血液,加入约10倍量氯化钠注射液,摇匀,1500r·min-1离心15min,弃上清液,沉淀的红细胞再用氯化钠注射液同上法洗涤3次,上清液不显红色。取沉淀红细胞4mL用氯化钠注射液稀释至200mL,配成2%的红细胞悬液供试验用,用时摇匀。
2.2 供试液的制备 根据“注射剂安全性检查法应用指导原则”中对“溶血与凝聚检查法中设定限值”的规定,应以无溶血和凝聚的最大浓度的1/2作为限制浓度,如果注射剂原液无溶血和凝聚反应则以原液浓度为限值。本试验分别以醒脑静注射液原液、氯化钠注射液稀释的2倍、5倍稀释液为供试液,研究醒脑静注射液的溶血性。
2.3 试验方法
2.3.1 肉眼观察法 每1批样品取洁净试管3支编号,1、2号管为相应的供试液管,3号管为供试品对照管,另取2支试管编号为4号管和5号管,分别为阴性对照管、阳性对照管。按表1所示依次加入2%红细胞悬液、氯化钠注射液、蒸馏水及供试品,立即混匀,置(37±0.5)℃恒温水浴中保温,3h后观察溶血和凝聚反应。按表2标准肉眼判断有无溶血与凝聚现象出现。
2.3.2 按2.3.1项下方法 进行处理样品后,各管1500r·min-1离心15min,取上清液,置紫外分光光度仪中,在200~800nm波长间扫描,结果显示在545nm波长处有最大吸收。以氯化钠注射液为阴性对照,蒸馏水为阳性对照,测定各管的OD值,按公式[溶血率(%)=(供试品管OD值-阴性对照管OD值)/(阳性对照管OD值-阴性对照管OD值)×100%]计算溶血率,以溶血率>5%表示有溶血发生。
3 试验结果
分别以3个厂家的原液、2倍稀释液、5倍稀释液为检查浓度,进行溶血与凝聚检测,用肉眼观察和紫外分光光度的方法观察判断样品溶血与凝聚现象。
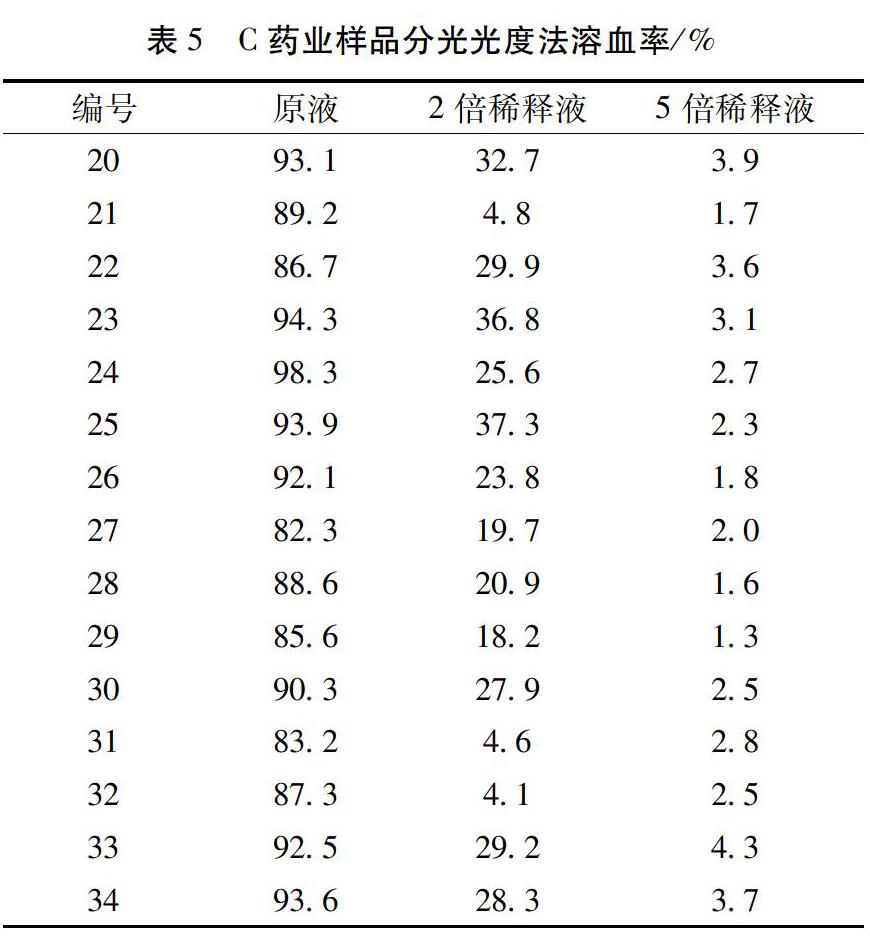
溶血率表示溶血发生的程度,大于5%即表示溶血发生。从表3、表4和表5可以看出,34批样品用分光光度法判断溶血,原液均引起溶血,C药业的溶血率为80%~100%,A药业及药业的溶血率为40%~80%。样品在2倍稀释液时,其中20批有溶血现象发生,样品在5倍稀释液时,所有样品都未有溶血现象发生。将34批样品的肉眼观察法和紫外分光光度法的溶血结果进行对比,结果见表6。
从表6 可以看出,34批样品以原液和5倍稀释液为检查浓度时,肉眼观察和紫外分光光度法判断的结果是一致的,都没有溶血现象发生。以2倍稀释液为检查浓度时,肉眼判断有14批发生溶血,分光光度法判断有20批发生溶血,两者判断有差异的6批样品的紫外分光光度测定的溶血率大致在5%~15%之间,肉眼观察很难发现。
4 讨论
本法是将一定量供试液与2%兔红细胞混悬液混合,温育一定时间后,观察其对红细胞的溶血与凝聚反应以判定供试品是否符合规定。供试品不合格表明注射剂中污染超过正常存在的溶血性物质,或污染致血细胞凝聚,临床用药后将可能产生有关不良反应。溶血与凝聚作为评价注射剂安全性的重要指标之一,在醒脑静现行标准中未收载,因此建议应对醒脑静注射液的现行标准进行提高,并增加溶血与凝聚检查项。
实验结果表明,相同厂家、不同批次以及不同厂家间的醒脑静注射液在溶血性方面存在较大的差异。对于相同厂家的醒脑静注射液,生产工艺相对稳定,差异可能来自原辅料来源的稳定性,原料药及輔料来源不同其中所含各组分的比例及杂质成分都可能有差异,中药材的产地、采收期不同也会对中药注射剂的质量不稳定性产生很大影响。对于不同厂家的醒脑静注射液,受生产工艺和原辅料的来源不同等多重因素影响[9],造成差异进一步加大。醒脑静注射液的主要成分为麝香、郁金、冰片、栀子,辅料为聚山梨酯80和氯化钠。据了解,C厂家在生产该品种时使用了天然麝香和天然冰片,而A、B厂家使用的是人工麝香和人工冰片,据文献报道,不同厂家、不同浓度的麝香[10]和冰片[11]溶血作用有明显差异,人工的和麝香、冰片之间的溶血性差别有待进一步试验验证。醒脑静注射液的辅料聚山梨酯80中的山梨醇、山梨醇酐和异山梨醇酐3种成分也均具有溶血性[12-13]。
同时,笔者从试验结果发现,在2倍稀释液检查溶血时,肉眼判断有14批溶血,而分光光度法则判断有20批溶血,其中6批分光光度法判为溶血的溶血率为5%~15%,肉眼观察没有发现,当用2倍稀释液作为限值时,若有目测法会引起漏判。而红细胞破裂释放出来的血红素在可见光波长段具有最大吸收,采用分光光度法测定中药注射剂的溶血程度,具有准确、操作简便,稳定性好,能消除常规试管法带来的主观误差等缺点,故判断结果时建议采用分光光度法。
参考文献
[1]陈晓旭,董改英.醒脑静注射液上市后安全性再评价研究[J].天津中医药,2015,32(5):312-313.
[2]赵燕,石上梅,王旭,等.中药注射剂国家药品标准提高及进展情况分析[J].中国药事,2017,31(8):861-876.
[3]刘宏明,许莉莉,崔冉,等. 66例醒脑静注射液不良反应的文献分析[J].中国药物警戒,2016,13(2):107-110.
[4]国家食品药品监督管理局.国家药品标准(修订)颁布件[S].2003年颁布.北京: WS3-B-3353-98-2003.
[5]国家药典委员会.中华人民共和国药典(四部)[M].北京:中国医药科技出版社,2015:159.
[6]国家食品药品监督管理局.药物研究技术指导原则(中药.天然药物刺激性和溶血性研究的技术指导原则)[M].北京:中国医药科技出版社,2005:230.
[7]程宾,张红宇,王莉,等.紫外分光光度法测定溶血率的研究[J].中国民族民间医药,2016,25(24):31-32.
[8]黄炜忠,蔡泽府,张清明,等.紫外分光光度法测定注射剂溶血的方法研究[J].今日药学,2016,26(10):713-720.
[9]王莉,张红宇,赵祎,等.血塞通注射液溶血性考察与研究[J].华西医学,2010,25(12):2225-2227.
[10]武少馨,师新颖,李晓利.复方麝香注射液的非临床安全性检查[J].中国药房,2015,26(13):1788-1790.
[11]李畅,涂家生. 聚山梨酯80 组分与其溶血性的关系[J].中国药科大学学报,2012,43(3):231-235.
[12]吴仁荣,彭文勇,涂家生. 聚山梨酯80 各组分溶血性的研究[J].药物生物技术,2016,23(1):39-43.
(收稿日期:2019-06-16 编辑:陶希睿)
