烟草提取物对牙周炎小鼠Th17/Treg细胞免疫平衡及相关转录因子表达的影响
2019-10-23吴琳
吴 琳
(浙江特殊教育职业学院,杭州310023)
牙周炎属于临床常见慢性口腔炎症疾病,调查显示,牙周炎发病率高达70%,若不及时治疗则会发展为牙龈炎、牙槽骨吸收甚至牙齿脱落,严重影响患者日常生活[1]。烟草中含有尼古丁、乙醛及丙醛等多类有害物质,研究发现烟草中有害物质可导致牙槽骨吸收,是引发牙周炎、种植体失败的主要原因[2]。牙菌斑生物膜是导致牙周炎的重要起因,目前多数研究认为牙周组织炎性反应及免疫应答与牙周炎的发生发展密切相关[3]。Wang等[4]研究认为辅助性T细胞17(T helper cell 17,Th17)、调节性T细胞(Regulatory T cells,Treg)比例失衡所导致的自身免疫反应是导致牙周炎发生的重要原因。然而烟草是否影响牙周炎所引发的免疫失衡,目前尚不明确。本研究通过制备牙周炎小鼠,给予烟草提取物(Cigarette smoke extraction,CSE)处理,以观察CSE对牙周炎小鼠Th17/Treg细胞免疫平衡的影响,以期为牙周炎的发病机制研究提供一定的参考。
1 材料与方法
1.1材料
1.1.1实验菌株以及动物 P.gingivalis 菌株购于上海北诺生物科技有限公司,置于BHI血琼脂培养基,放置37℃、5%CO2培养箱中培养。SPF级BALB/cJ小鼠,6周龄,60只,体重29~33 g,由河南省实验动物中心提供,许可证号:SCXK(豫)2017-0004。小鼠均在22~25℃室温、50%~60%湿度、12 h光照、无致病菌环境中统一饲养,室内保持通风良好,小鼠自由饮水、摄食,饲养1周后用于模型制备。
1.1.2试剂与仪器 BHI固体、液体培养基、Ⅳ型胶原酶(Sigma,美国);兔抗鼠白介素-17(Interleukins-17,IL-17)、视黄酸相关孤儿受体(Retinoid-related orphan receptors,RORγt)、IL-10、又头框转录因子P3(Forkhead box P3,FoxP3)(Abcam,英国);β-actin、山羊抗兔HRP标记IgG抗体(CST,美国);封闭液(Gibco,美国);PVDF膜、亚甲基蓝(索莱宝,中国北京);蛋白提取试剂盒(Omega,美国);BCA蛋白测定试剂盒(碧云天,上海);苏木精-伊红(HE)染色试剂盒(Azer Scientific,美国);电泳仪与配套设备、凝胶成像仪(Biorad,美国);光学显微镜(奥林巴斯,日本)。
1.2方法
1.2.1模型制备[5]P.gingivalis菌株培养5 d后,置于BHI固体培养基,筛选单个菌落,纯化菌株,置于液体培养基中培养48 h,收集菌液,调整细菌密度为1×108CFU。小鼠制备前腹腔注射3 ml/kg 10% 水合氯醛进行麻醉,采用4/0丝线绕牙颈部,于腭侧打结,将丝线推入龈沟中,1周后,于小鼠牙龈内接种制备好菌悬液,模型制备成功:小鼠牙周出现一定程度的炎症,且伴有附着丧失,X射线检测发现牙槽骨出现不同程度的吸收,牙齿松动等。模型制备成功小鼠共48只。对照组小鼠丝线结扎牙颈部后,牙龈内仅注射生理盐水。
1.2.2CSE制备 帝豪牌香烟,每支含焦油量12 mg,烟气烟碱量1.0 mg,烟气一氧化碳量13 mg,参照Chapman等[6]CSE制备法进行制备,封闭滤嘴后,置于抽吸装置内点燃香烟,使烟雾均匀通过10 ml 生理盐水,共吸取10只香烟,将烟雾水溶液过滤后收集CSE。此时CSE含量记为100%,添加生理盐水分别稀释至总含量的40%、20%、10%。
1.2.3实验分组与给药 将模型小鼠随机分为模型组(Model组)、CSE低、中、高剂量组(CSE-L、CSE-M、CSE-H),另设置对照组(Control),每组均12只小鼠。CSE各组小鼠在模型制备后于牙龈内龈沟底部注射10%、20%、40% CSE,每天1次;Control、Model组于牙龈内龈沟底部注射等量生理盐水,每天1次。各组连续处理7 d。
1.2.4牙龈指数(Gingival index,GI)测定 小鼠麻醉后,采取仰卧位,用牙周探针探查小鼠牙龈情况,参照Lobene评定标准[7]从牙龈炎症、颜色、水肿、出血等方面,对GI进行评定。
1.2.5牙槽骨吸收评价 各组随机选取6只小鼠,颈椎脱臼法处死小鼠后,获取上颌骨组织,将上颌骨在100℃沸水中处理5 min,剥离软组织清洗后晾干,添加0.1%亚甲蓝染色1 min,将上颌骨置于体视显微镜,测定第一磨牙到第三磨牙处釉牙骨质界(Cemento-enamel junction,CEJ)到牙槽嵴顶(Alveolar bone crest,ABC)的距离。
2.1 3组麻醉苏醒时间比较 A组、B组、C组麻醉苏醒的平均时间分别为(7.60±2.51)min、(7.75±2.50)min及(8.98±2.53)min。A、B两组的麻醉苏醒时间明显短于C组(F=3.6300,P=0.029 5;tAB=-0.3775,PAB>0.05;tAC=3.4726,PAC<0.05;tBC=3.0951,PBC<0.05)。
1.2.6HE染色观察小鼠牙周组织变化情况 各组随机选取6只小鼠,颈椎脱臼法处死小鼠后,收集上颌骨组织,部分置于4%多聚甲醛中过夜固定标本,修正标本仅保留牙周组织,加入脱钙液中处理6 d,添加醋酸锂中和12 h,流水冲洗后置于梯度乙醇中脱水后,在二甲苯中脱蜡处理后,参照HE染色试剂盒对组织标本进行染色,置于显微镜下观察牙周组织病理形态学变化。
1.2.7牙周组织中Th17、Treg细胞检测 将1.2.6中另一部分上颌骨组织参照Kobayashi等[8]方法制备牙周组织单细胞悬液,将牙周组织剪为小块,加入Ⅳ型胶原酶消化组织1 h,采用不锈钢网过滤组织收集细胞原液,添加Ficoll分离液分离牙周组织单细胞,加入RPMI1640培养基重悬细胞,对细胞进行计数并调整为 5×105ml-1,添加20 μl FITC标记兔抗小鼠CD3+、APC标记兔抗小鼠CD4+抗体,避光孵育20 min,加入固定穿膜剂,避光孵育15 min,经固定洗涤后,加入IL-17抗体,4℃孵育30 min,清洗后添加缓冲液,上机检测。采用Cellsquest软件分析检测结果,以CD4+直方图区分Th17细胞,以IL-17染色表示Th17,统计Th17细胞比例变化情况。
1.2.8牙周组织中Treg细胞检测 收集牙周组织单细胞悬液,添加20 μl FITC标记的兔抗小鼠CD4+、PE标记兔抗小鼠CD25+抗体,避光孵育20 min,洗涤后,加入Foxp3抗体,4℃孵育25 min,清洗后添加缓冲液,上机检测。采用Cellsquest软件分析检测结果,以CD25+直方图区分Treg细胞,以Foxp3染色表示Treg,统计Treg细胞比例变化情况。
1.2.9Western blot检测心肌中IL-17、RORγt、IL-10、Foxp3蛋白表达 牙周组织脱钙处理后添加RIPA裂解液裂解组织,抽提总蛋白,取20 μg等量蛋白置于12%SDS-PAGE凝胶电泳分离蛋白,转膜反应后添加封闭液封闭2 h,添加IL-17、RORγt、IL-10、Foxp3、β-actin一抗稀释液(1∶500),4℃过夜孵育。洗涤后添加HRP标记二抗(1∶5 000),室温孵育1 h。ECL发光显影后于光凝胶成像仪中成像,以β-actin为内参蛋白,Image-plus系统分析IL-17、RORγt、IL-10、Foxp3表达情况。

2 结果
2.1CSE对小鼠GI的影响 与Control组相比,Model组GI显著升高(P<0.05);与Model组相比,CSE各组GI均显著升高(P<0.05)。见表1、2。
2.2CSE对小鼠牙槽骨吸收的影响 与Control组相比,Model组 CEJ到ABC距离显著升高(P<0.05);与Model组相比,CSE各组 CEJ到ABC距离均显著升高(P<0.05)。见图1。



Groups GIControl group0.23±0.02Model group1.13±0.191)CSE-L group1.44±0.162)CSE-M group1.76±0.122)CSE-H group1.93±0.142)
Note:Compared with Control group,1)P<0.05;compared with Model group,2)P<0.05.
2.3CSE对牙周组织病理形态学的影响 HE染色显示,与Control组相比,Model组第二磨牙表面软组织退缩,牙槽骨表面出现部分骨吸收,固有层伴有大量炎症细胞浸润,胶原纤维排列紊乱、变性、断裂。CSE各组第二磨牙牙周组织骨吸收程度增加、炎症细胞浸润数量增多,随着处理剂量的升高,牙周病变程度逐渐加重。见图2。
2.4CSE对牙周组织Treg/Th17细胞比例的影响 与Control组相比,Model组 Th17细胞比例显著升高,Treg细胞比例显著降低,Th17/Treg比值显著升高(P<0.05);与Model组相比,CSE各组 Th17细胞比例显著升高,Treg细胞比例显著降低,Th17/Treg比值显著升高(P<0.05)。见图3,表3。
2.5CSE对牙周组织IL-17、RORγt、IL-10、Foxp3表达的影响 与Control组相比,Model组IL-17、RORγt蛋白表达升高,IL-10、Foxp3蛋白表达显著降低(P<0.05);与Model组相比,CSE各组IL-17、RORγt蛋白表达升高,IL-10、Foxp3蛋白表达显著降低(P<0.05)。见图4,表4。

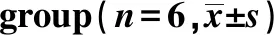

Groups4 week(mm)Control group0.21±0.03Model group0.40±0.041)CSE-L group0.45±0.082)CSE-M group0.51±0.092)CSE-H group0.73±0.072)
Note:Compared with Control group,1)P<0.05;compared with Model group,2)P<0.05.

图1 牙周组织亚甲基蓝染色Fig.1 Methylene blue staining of periodontal tissue
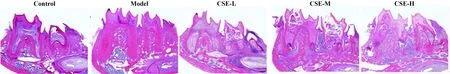
图2 HE染色观察牙周组织形态学变化(×100)Fig.2 Observation of periodontal histomorphological changes by HE staining(×100)

图3 流式细胞术检测牙周组织单细胞Th17、Treg细胞比例变化Fig.3 Flow cytometry was used to detect proportion of Th17 and Treg cells in periodontal tissue

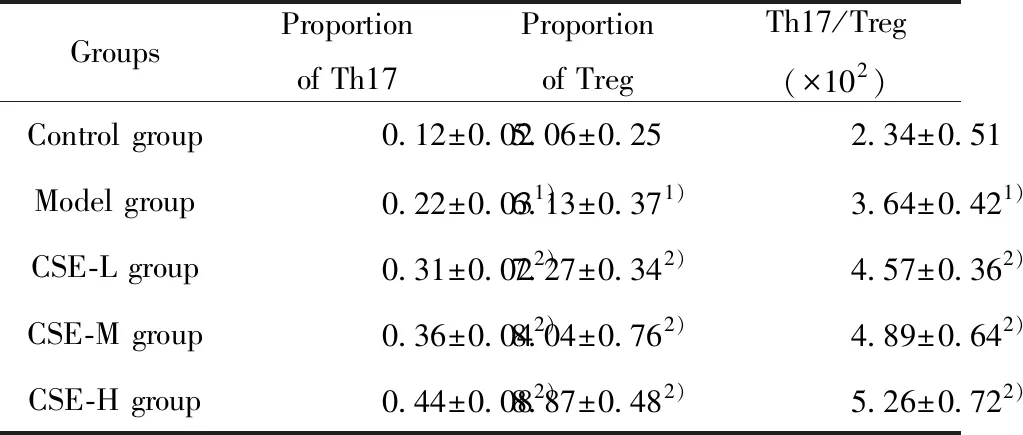
GroupsProportion of Th17Proportion of TregTh17/Treg(×102)Control group0.12±0.025.06±0.252.34±0.51Model group0.22±0.031)6.13±0.371)3.64±0.421)CSE-L group0.31±0.022)7.27±0.342)4.57±0.362)CSE-M group0.36±0.042)8.04±0.762)4.89±0.642)CSE-H group0.44±0.082)8.87±0.482)5.26±0.722)
Note:Compared with Control group,1)P<0.05;compared with Model group,2)P<0.05.
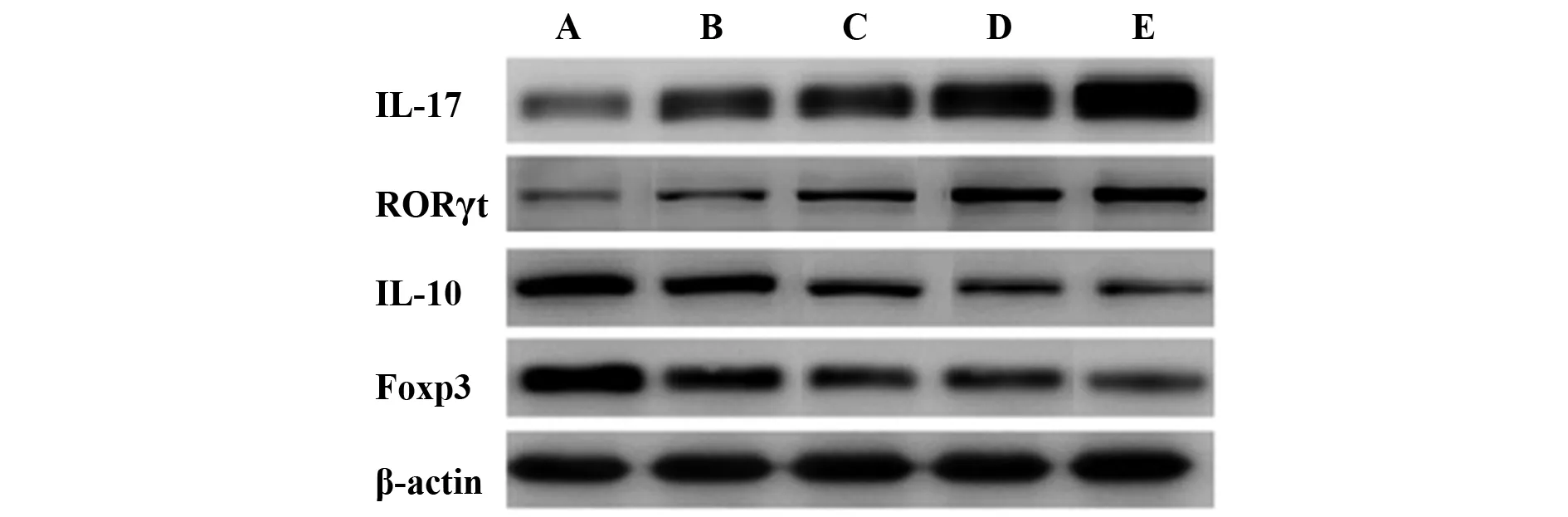
图4 WB检测IL-17、RORγt、IL-10、Foxp3蛋白表达Fig.4 WB detection of IL-17,RORγt,IL-10,Foxp3 protein expressionNote: A.Control group;B.Model group;C.CSE-L group;D.CSE-M;E.CSE-H group.
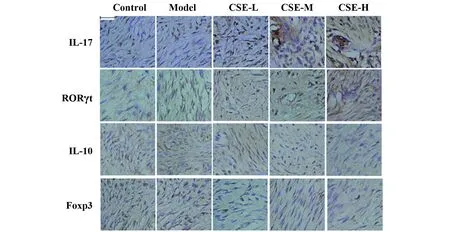
图5 免疫组化检测IL-17、RORγt、IL-10、Foxp3蛋白阳性表达(×200)Fig.5 Immunohistochemical detection of positive expre-ssion of IL-17,RORγt,IL-10 and Foxp3 proteins(×200)


Groups IL-17RORγtIL-10Foxp3Control group0.32±0.060.16±0.030.92±0.060.95±0.11Model group0.44±0.081)0.21±0.061)0.78±0.071)0.78±0.061)CSE-L group0.62±0.092)0.30±0.092)0.54±0.062)0.63±0.032)CSE-M group0.81±0.082)0.36±0.072)0.42±0.092)0.58±0.062)CSE-H group1.04±0.152)0.41±0.052)0.29±0.042)0.38±0.172)
Note:Compared with Control group,1)P<0.05;compared with Model group,2)P<0.05.


Groups IL-17RORγtIL-10Foxp3Control group7.26±0.3812.21±0.4738.17±2.5626.95±2.26Model group13.64±1.091)20.45±1.151)28.36±2.161)19.29±2.131)CSE-L group20.31±2.132)24.42±2.232)19.59±1.562)12.63±1.662)CSE-M group23.45±1.482)28.33±2.162)14.43±1.852)10.26±1.452)CSE-H group26.63±1.362)30.24±4.392)12.32±2.112)9.44±1.172)
Note:Compared with Control group,1)P<0.05;compared with Model group,2)P<0.05.
2.6CSE对牙周组织IL-17、RORγt、IL-10、Foxp3蛋白阳性表达的影响 与Control组相比,Model组IL-17、RORγt蛋白阳性表达显著升高,IL-10、Foxp3蛋白表达显著降低(P<0.05);与Model组相比,CSE各组IL-17、RORγt蛋白阳性表达显著升高,IL-10、Foxp3蛋白表达显著降低(P<0.05)。见图5,表5。
3 讨论
小鼠牙周组织与人相似,多数研究采用牙颈部结扎结合接种牙周炎致病菌复制牙周炎模型,显示小鼠牙周组织病理表现与人牙周炎表现相似[9]。本研究结果显示与Control组相比,Model组GI升高、CEJ到ABC距离升高,病理学检测发现Model组第二磨牙表面软组织退缩,牙槽骨表面出现部分骨吸收,伴有大量炎症细胞浸润,胶原纤维排列紊乱、变性、断裂,提示牙周组织出现明显炎性反应以及牙槽骨吸收,符合牙周炎小鼠模型基本特征[10],提示牙周炎模型小鼠制备成功。
尼古丁为CSE中的生物碱成分,Mikiko等[11]研究发现尼古丁可通过降低牙龈中免疫细胞数量,降低机体防御功能,引发牙龈血管痉挛,造成牙周病。临床研究发现停止吸烟患者微循环功能恢复正常,牙周炎性反应显著降低[12]。以上研究均表明烟草能够损伤牙周组织引发牙周炎。本研究发现与Model组相比,CSE处理后各组GI、CEJ到ABC距离进一步升高,病理学检测发现CSE各组牙槽骨骨吸收以及炎症细胞浸润程度加重,提示CSE可加重牙周炎小鼠病情进展,然而具体作用机制,目前尚不清楚。CD4+T细胞介导的免疫反应在牙周炎获得性免疫反应中发挥重要调控作用。CD4+T细胞主要分化为Th1、Th2、Th17、Treg T细胞,通过作用于靶细胞后介导炎性反应,破坏牙周组织。以往多数研究认为,牙周炎的发生中Th1/Th2细胞免疫应占有主导作用[13]。最新证据显示Th17/Treg细胞比例的失衡与牙周炎的发生、发展密切相关[14]。因此探究CSE对牙周组织中Th17/Treg细胞的作用,对于探究CSE破坏牙周组织机理十分重要。
Th17细胞属于新型T细胞亚群,其能够分泌IL-17A,进一步提高IL-6水平,激发T细胞增殖,扩大炎性反应,进而激活STAT信号通路,诱导RORγt蛋白表达促进Th17细胞分化[15]。de Aquino等研究发现IL-17水平升高与牙周炎严重程度相关[16]。IL-17与牙周组织损伤程度有关,其表达升高能够激活髓过氧化物酶、中性粒细胞蛋白酶活性,促进趋化因子的分泌,加速局部炎性反应[17]。Behfarnia等[18]研究发现牙周炎患者血清中Th17转录因子RORγt以及细胞因子IL-17水平显著高于健康者,而IL-17引发炎性反应可进一步刺激Th17细胞分泌更多炎症因子,进一步加重牙周组织炎症反应。本研究检测每组6只小鼠牙周组织Th17细胞比例变化,结果显示Model组牙周组织中Th17细胞比例显著升高,且其转录因子RORγt与分泌因子IL-17蛋白表达显著升高,经CSE干预后,牙周组织中Th17细胞比例、RORγt、IL-17蛋白表达进一步显著升高,表明在牙周炎的发展中,Th17细胞不断分泌RORγt、IL-17作用牙周组织,加重牙周组织炎性反应,提示CSE可能通过调控Th17细胞加重牙周组织炎性反应。
Treg细胞属于CD4+T细胞亚群之一,主要通过抑制自身免疫、调控免疫应答来降低炎性反应,FoxP3为其特异转录因子,IL-10为其主要分泌因子。Parachuru等[19]研究显示牙周组织中FoxP3、IL-10蛋白表达明显高于健康对照组,表明Treg细胞可能是通过分泌FoxP3、IL-10参与牙周炎的发生。 Dong等[20]通过给予牙周炎小鼠注射GITR抗体,结果发现牙周组织Treg细胞活性明显降低,且组织中FoxP3、IL-10表达显著降低,而γ-干扰素、TNF-α mRNA表达显著升高,小鼠的牙槽骨缺损加重。Glowacki等[21]通过给予牙周炎小鼠局部注射CCL22诱导Treg细胞活性,结果发现Treg细胞活性显著升高,且小鼠牙周炎炎症程度明显降低,牙槽骨的吸收也减少。本研究对每组的6只小鼠牙周组织同时进行Treg细胞比例检测,结果显示Model组牙周组织中Treg细胞比例显著降低,FoxP3、IL-10蛋白表达显著降低,经CSE干预后,牙周组织中Treg细胞比例、FoxP3、IL-10蛋白表达进一步显著降低,提示CSE可能通过抑制Treg细胞活性,进而抑制FoxP3、IL-10表达,加重牙周组织炎性反应。进一步分析发现CSE干预后,牙周组织中Th17/Treg细胞比例比值显著升高,表明牙周组织Th17/Treg细胞平衡破坏,免疫抑制作用减弱,牙周组织朝向炎性反应方向发展,提示CSE可通过破坏Th17/Treg细胞平衡加重牙周组织炎性反应。
综上所述,CSE可加重牙周炎病情程度,其可能是通过破坏牙周组织Th17/Treg细胞平衡,引发自身免疫反应,进而加重牙周组织炎症反应。然而牙周炎的发生、发展机制较为复杂,本研究仅以小鼠为研究对象进行研究,而CSE是否在人牙周组织中发挥同样的作用,这还有待后期深入探究。