循环微粒水平对急性呼吸窘迫综合征的预后价值
2019-10-22葛文品王导新
葛文品 戚 迪 王导新 何 婧 赵 燕 邓 旺 朱 涛
(1 重庆三峡医药高等专科学校,重庆 404120;2 重庆医科大学附属第二医院呼吸与危重症医学科,重庆 400010)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是以弥漫性肺泡-毛细血管膜损伤和非心源性肺水肿为病理特征,以顽固性低氧血症和呼吸窘迫为特征性表现的临床常见呼吸危重症,重度ARDS病死率仍高达46%[1]。ARDS作为一种存在明显异质性的综合征,目前针对其有效临床干预手段主要集中于肺保护性通气和避免液体过负荷等支持治疗,尚未证明ARDS药物治疗能够降低近期或远期病死率,故而在个体化精准治疗时代,仍需更多创新性研究优化临床治疗方案,降低ARDS患者病死率[2]。循环微粒(microparticles,MP)是细胞活化、损伤、凋亡时,由细胞释放的具有膜结构的囊泡样结构的统称,是机体面对急性应急刺激时的内源性产物。本研究主要探讨循环MP水平对急性呼吸窘迫综合征患者预后评估的临床价值。
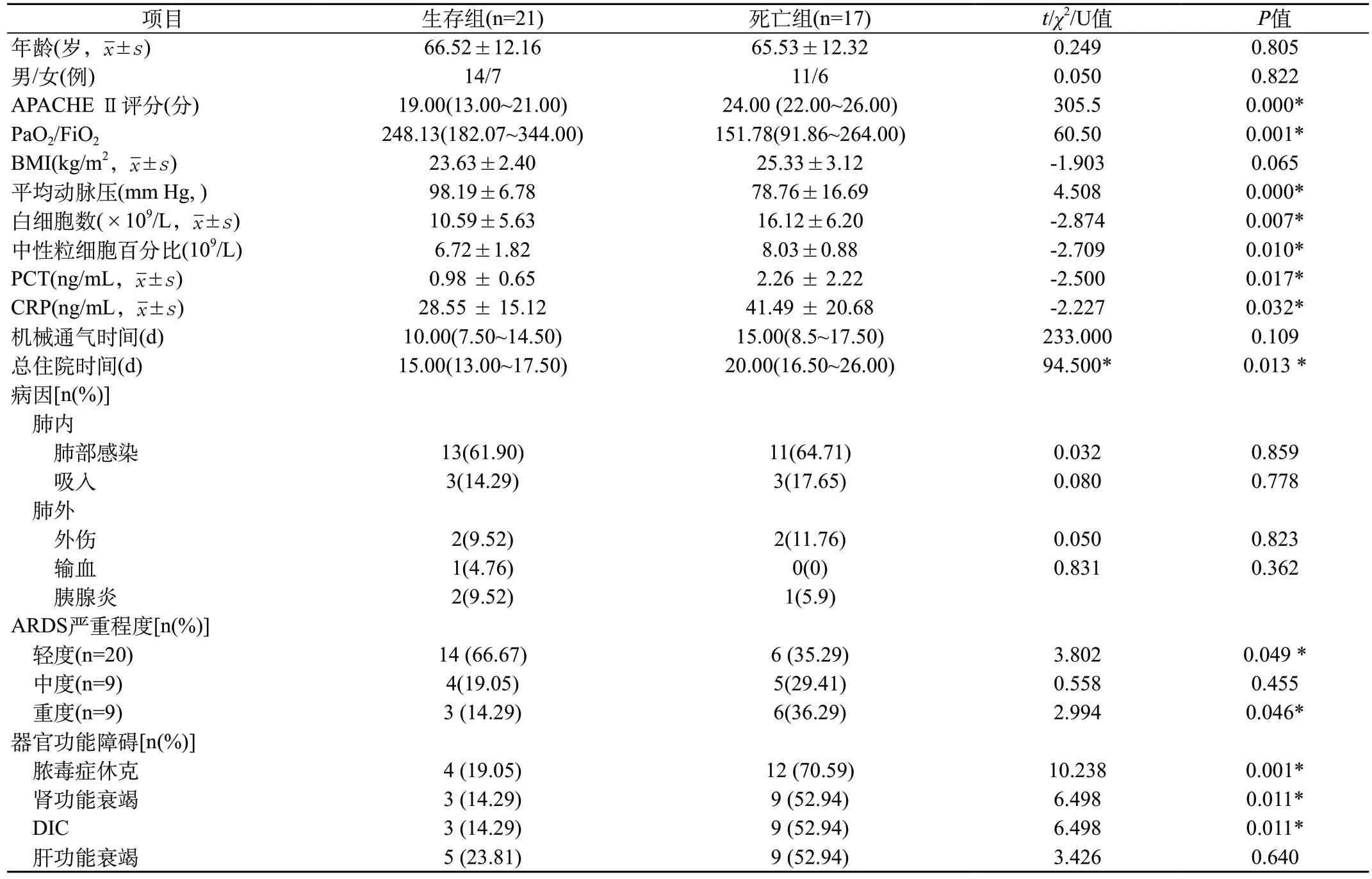
表1 两组ARDS患者一般资料比较
1 资料与方法
1.1 一般资料:选取2017年2月至2018年2月,重庆三峡医药高等专科学校附属医院(16例)及重庆医科大学附属第二医院(22例)呼吸与危重症医学科加强治疗病房(Respiratory Intensive Care Unit,RICU)收治的共38例ARDS患者。纳入标准:符合2012年由欧洲危重病医学会(European Society of Intensive Care Medicine,ESICM)与美国胸科学会(American Thoracic Society,ATS)联合委员发布的柏林定义[4]:①起病时间:从已知临床损害或新发或原有呼吸系统症状加重后7 d内;②胸部影像学:X线或CT扫描示双肺浸润影,不能用胸腔积液、肺叶塌陷或结节完全解释;③肺水肿原因:无法用心力衰竭或体液超负荷完全解释的呼吸衰竭,如无相关危险因素,需要进行客观评估(例如超声心动图)以排除静水压增高型肺水肿。排除标准:①年龄未满18岁;②妊娠;③已经确定或高度怀疑恶性肿瘤;④接受免疫抑制剂治疗;⑤胸壁手术或创伤。同时连续分层随机纳入38名健康受试者作为对照组。本研究通过重庆三峡医药高等专科学校附属医院和重庆医科大学附属第二医院伦理委员会审批,并征得患者及家属同意并签署知情同意书后进行。
1.2 方法
1.2.1 临床资料收集:收集并记录纳入患者人口学资料及相关临床资料,包括年龄、性别、肱动脉血压、急性生理及慢性健康评分Ⅱ(Acute Physiology and Chronic Health Evaluation Ⅱ,APACHEⅡ)、合并症、体质量指数(body mass index,BMI)、空腹血糖、血脂、血常规、肝肾功、ARDS病因、并发症、降钙素原(procalcitonin,PCT)、C反应蛋白(C-Reactive protein,CRP)等,同时记录ARDS患者诊断确立时氧合指数(PaO2/FiO2),并根据柏林定义将患者分为轻度(n=20):呼吸末正压(PEEP)或持续气道正压(CPAP)≥5 cm H2O,200 mm Hg< PaO2/FiO2≤300 mm Hg);中度(n=9):(PEEP≥5 cm H2O时,100 mm Hg< PaO2/FiO2≤200 mm Hg);重度(n=9):(PEEP≥5 cm H2O时,PaO2/FiO2≤100 mm Hg);(1 cm H2O=0.1kPa,1 mm Hg=0.133 kPa)。依据入院28 d存活情况分为生存组(n=21)和死亡组(n=18)。
1.2.2 标本收集:ARDS诊断确立后24 h内,采用金黄色分离胶管采集患者空腹外周静脉血5 mL,翻转后静置30 min以上至血液凝集完全,3000 r/min 4 ℃离心15 min(离心半径8 cm),收集上层血清,1.5 mL EP管分装后,冻存于-80 ℃超低温冰箱内待后续相关检测。
1.2.3 循环微粒水平检测:差速离心法收集循环微粒,循环微粒捕获法(microparticle capture)检测循环微粒总数。1500×g 4 ℃离心15 min(离心半径8 cm),弃细胞沉渣,收集上清后,再次13000×g 4 ℃离心2 min,收集上清。以稀释液稀释上清液后,加至包被有链霉素及生物素标记Annexin V(一种膜联蛋白)的微量滴定板内,37 ℃孵育1 h。洗板后,依次加入显色剂及底物,37 ℃孵育10min显色,2%枸橼酸终止显色。以空白孔调零,酶标仪测定405 nm波长各孔的吸光度(OD值)。将MPs定义为直径<1 μm,且Annexin V阳性。以稀释液为阴性对照。
1.2.4 研究终点:以ARDS患者28 d死亡或生存情况作为主要终点。患者机械通气时间、RICU入住时间、总住院时间作为次要研究终点。
1.2.5 统计学方法:统计学分析采用SPSS19.0软件,作图采用GraphPad Prism 5.0软件。对于服从正态分布的连续性变量,如年龄、BMI、平均动脉压、循环微粒数、白细胞数、中性粒细胞百分比、PCT、CRP,结果以均数±标准差表示,应用t检验行两组间比较,单因素方差分析行三组间比较;对于服从偏态分布的连续性变量,如APACHEⅡ评分、PaO2/FiO2、机械通气时间、总住院时间,结果以中位数(四分位间距)表示,应用曼-惠特尼U检验行两组间比较;对于计数资料,结果以例数(%)表示,费舍尔精准检验行两组间比较。正态分布的连续性变量资料采用皮尔森相关分析,偏态分布的连续性变量资料采用史匹曼等级分析探讨循环微粒水平与ARDS患者各临床指标相关性。使用逻辑回归确定预后指标的独立预测因素。采用受试者工作特征曲线(ROC)及曲线下面积(AUC)分别评估循环微粒数水平ARDS 28 d病死率的预测值、敏感度和特异度。以P<0.05为差异有统计学意义。
2 结果
2.1 ARDS患者人口学及临床特点:两组间患者性别、年龄、病因等比较差异均无统计学意义,资料均衡、可比。与生存组比较,死亡组APACHEⅡ评分、PCT水平更高,氧合指数(PaO2/FiO2)则相对更低。肺部感染为本研究ARDS患者的最常见病因。与生存组比较,死亡组总住院时间均显著高于生存组,且更易伴发脓毒症休克、急性肾功能衰竭等器官衰竭。见表1。
2.2 两组ARDS患者循环微粒水平比较:ARDS患者死亡组循环微粒水平显著低于生存组,差异有统计学意义[(3.16±1.92)µmol/L,(5.80±2.06)µmol/L;t=4.04,P=0.00)],如图1A。轻度、中度、重度ARDS患者的循环微粒水平分别分为(6.08±2.45)µmol/L、(4.09±1.91)µmol/L,(2.81±1.96)µmol/L,差异有统计学意义(F=7.32,P=0.02)。其中重度ARDS患者的循环微粒水平显著低于轻度组,差异有统计学意义[(2.81±1.96)µmol/L,(6.08±2.45)µmol/L;t=3.65,P=0.03],见图1B。
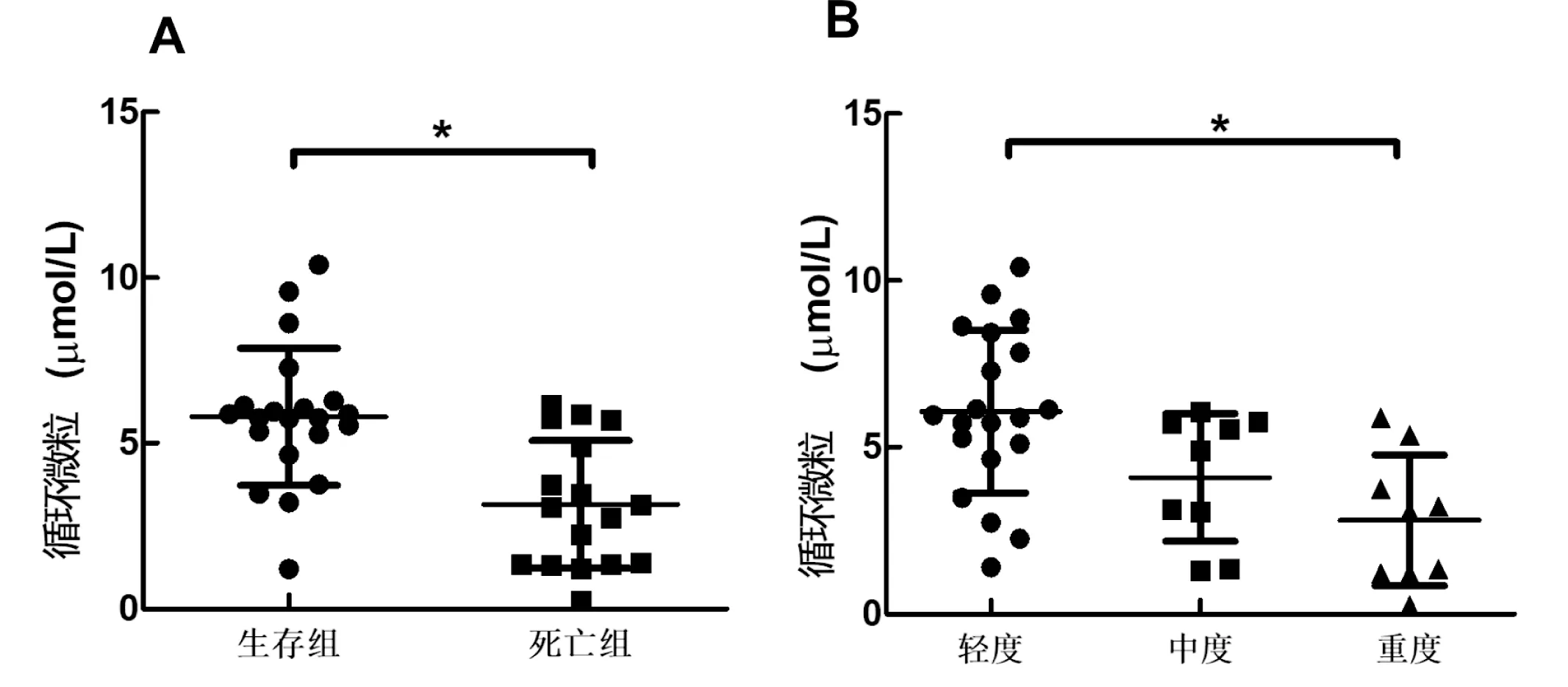
图1 两组急性呼吸窘迫综合征患者循环微粒水平比较(*P<0.05)
2.3 循环微粒水平与ARDS其他临床预测指标及预后的相关性分析:循环微粒水平与及ARDS患者机械通气时间呈显著负相关(y=19.45-1.57x,F=66.59,P=0.000),与氧合指数呈显著正相关(y=44.25+40.76x,F=74.37,P=0.000),但与APACHE Ⅱ评分、PCT、CRP、总住院时间未见显著相关性,见图2。
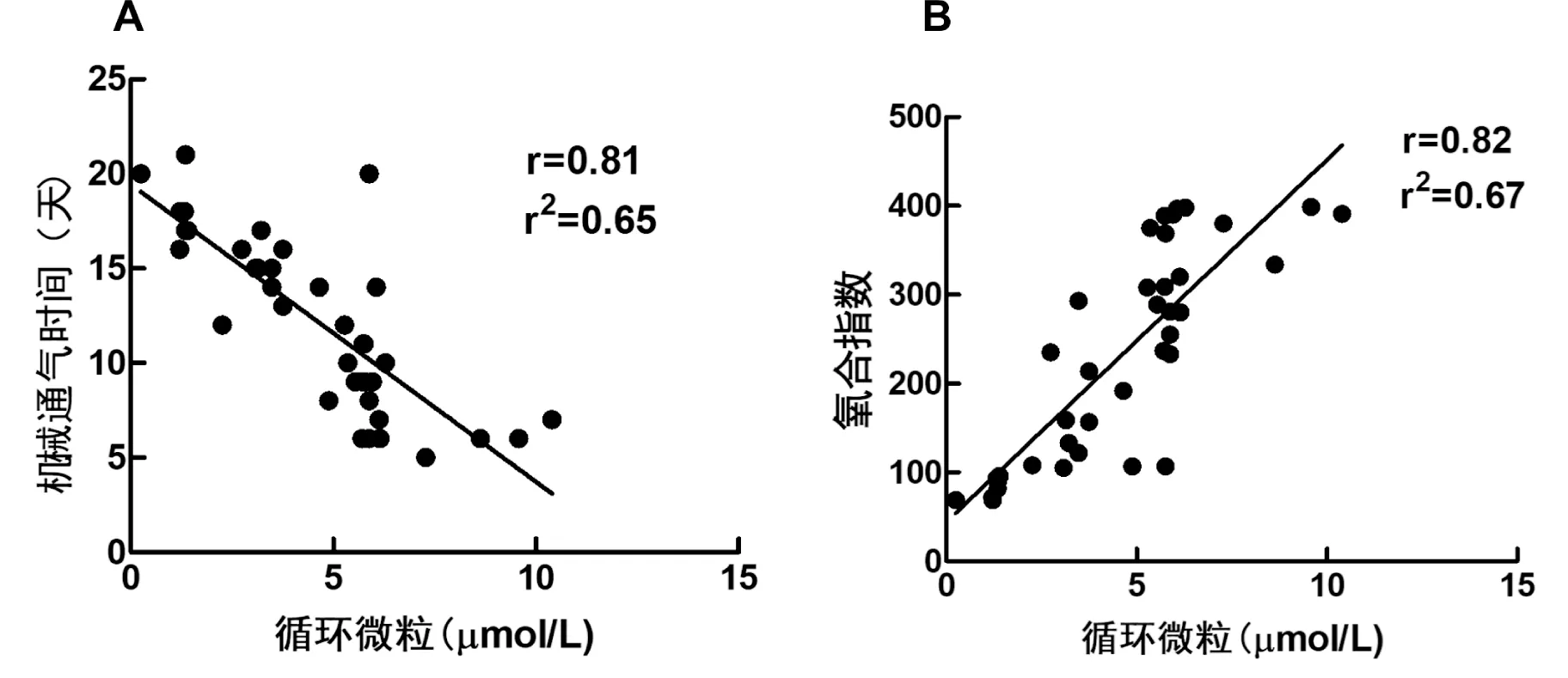
图2 急性呼吸窘迫综合征患者循环微粒水平与机械通气时间及氧合指数的相关性分析
2.4 循环微粒数对ARDS 28 d病死率的预测能力评价:多因素logistic回归分析结果示,MP和APACHEⅡ评分2个自变量的回归系数均有统计学意义(分别为P=0.017,P=0.016),回归方程为:LogitPi=-0.83-1.13×MP+0.62×APACHE Ⅱ,见表2。循环微粒水平预测ARDS 28d病死率的受试者曲线下面积(AUC)为0.82[95%CI:0.680~0.958],有显著统计学意义(P=0.001),说明循环微粒水平对ARDS 28d病死率有预测价值,见图3。根据约登指数筛选最优截点结果示,循环微粒数为3.28 µmol/L以下时,ARDS 28 d病死率明显升高,预测ARDS 28 d病死率的敏感度为59.0%,特异度为95.0%。

表2 急性呼吸窘迫综合征患者28 d病死的独立预测因素分析

图3 循环微粒水平预测急性呼吸窘迫综合征患者28 d病死率的ROC曲线
3 讨 论
循环MP是细胞活化、损伤、凋亡时,由细胞释放的各种具有膜结构的囊泡样结构的统称,直径为100~1000nm,根据其大小、内容物组成、生物发生机制可进一步划分为外泌体、微粒和凋亡小体[3-4]。正常状态下,健康成人血液中即存在少量细胞微粒,参与凝血、炎性反应等生物过程,包括凝胶溶素、氨磷脂移位酶、翻转酶、磷脂混杂酶和钙蛋白酶的多种酶可参与细胞膜磷脂不对称性的稳态维持。当细胞活化、凋亡、损伤时,内质网释放钙离子增多,细胞内钙离子水平的升高导致凝胶溶素、磷脂混杂酶、钙蛋白酶的活化,同时抑制氨磷脂移位酶的活化,打破细胞膜磷脂不对称性的稳态平衡,细胞膜内侧的磷脂酰丝氨酸转移到细胞膜外层,并伴随细胞骨架重构,以出芽方式,包裹起源细胞的microRNA(微小RNA)、mRNA、线粒体DNA、脂质、蛋白等成分形成微粒,脱落、释放至外周循环血液中,成为循环微粒[5]。由于释放入循环外周血的微粒可携带供体细胞的特异细胞质成分,且能随外周血液循环至远隔靶器官实现长距离信号传递,故而形成一种重要的细胞间物质传递、信息传导系统,对机体组织间稳态的维持发挥至关重要的作用[6-7]。目前可以确认微粒广泛参与心血管、神经系统、肿瘤的病理生理过程,与冠状动脉粥样硬化、静脉血栓栓塞症、糖尿病微血管病变等多种疾病的发生、发展密切相关,是当今生物医学的研究热点[8-10]。
近年来越来越多的研究揭示微粒在包括慢性阻塞性肺疾病、哮喘、肺间质疾病、肺癌等多种肺脏疾病扮演重要角色。但目前,其与ARDS的研究尚处于初步探索阶段[11]。正常情况下,健康成人外周循环血液中即存在少量细胞微粒,参与凝血、炎症等生理反应。由于微粒及其内容物对感染、缺氧、氧化应激等非常敏感,组织受损情况下,相关细胞激活或凋亡加速,循环中细胞微粒水平、内容物成分及来源比例均会迅速发生特异性改变。前期研究通过比对ARDS患者机械通气患者、非肺部疾病机械通气患者及自主呼吸患者的肺支气管肺泡灌洗液(BALF)及动脉血浆中不同细胞来源的MP,发现ARDS患者BALF中白细胞来源微粒(LeuMP)和粒中性粒细胞来源微粒(NeuMP)与对照组相比显著提高。亚组分析进一步比对ARDS发病第1天的外周循环血,发现生存组循环LeuMP、血小板来源微粒(PMP)水平较死亡组显著升高;免于机械通气天数>5 d的亚组患者循环LeuMP、PMP水平较免于机械通气天数<5 d的亚组患者水平显著升高;循环LeuMP >60 elements/µL与ARDS患者28 d生存率提高相关。其原因或许为循环中MP不仅有具有抗炎保护效应,还对血管低张力导致的微循环障碍有改善效应[12]。但研究还发现,与心源性肺水肿患者相比,ARDS患者肺水肿液中细胞微粒水平显著升高,且这些微粒中因富含组织因子表现出更高的促凝活性。亚组分析提示,生存组患者肺泡灌洗液中微粒浓度显著低于死亡组,这可能有赖于微粒在激活凝血系统中的重要作用,使得肺泡纤维素沉积增多,不利于氧合[13]。但目前,微粒与ARDS的相关研究甚少,故而亟待更多深入研究。本研究发现死亡组ARDS患者循环微粒水平显著低于生存组,结合前期研究报道,提示低水平的循环微粒往往反映机体免疫抑制状态,应对急性应激损伤时囊泡形成障碍,因而低水平微粒的ARDS患者更易合并感染、多器官衰竭,故预后更差,病死率更高。
本研究尚存在以下不足:微粒根据细胞来源可进一步分为内皮细胞微粒、血小板微粒、白细胞微粒及滋养层微粒等,并携带特异性组分,表达不同的表面标记蛋白。本研究样本量较小,未对循环微粒的细胞来源及内容物组分进行具体分析。其次,未对ARDS不同预后患者入院后循环微粒水平进行动态监测和分析。随着生物技术的革新突破和疾病异质性的认识深化,在今后的研究中,我们将进一步探究不同细胞来源的微粒在ARDS整个病程中扮演的不同角色,及其可能涉及的具体分子生物学机制,以期为基于细胞微粒的ARDS精准医疗提高理论基础。综上结果提示,ARDS患者急性期循环微粒水平显著提高,其水平与ARDS患者病情严重程度及预后显著相关。
