细胞角蛋白18的基因克隆及其对Hep G2肝癌细胞增殖迁移的影响
2019-10-22孙达权周莉莉薛殿婷徐莹莹
孙达权,周莉莉,石 松,薛殿婷,徐莹莹
(贵州医科大学 基础医学院,贵州 贵阳 550025)
细胞角蛋白(cytokeratin,CK)又叫角蛋白,主要存在于上皮细胞中,是参与固定细胞核和维持细胞形态的重要成分[1-2]。上皮细胞中的角蛋白有20种以上的CKs亚型,其表达主要依赖于上皮细胞的分化程度和类型[3]。在肝脏中,细胞角蛋白8(CK8)和细胞角蛋白18(CK18)最为常见,它们均由中央α-螺旋杆状结构域与非α-螺旋N-末端头部和C-末端尾部结构域组成[4-5]。不同细胞角蛋白间可以形成非共价杂聚物,聚集成长丝并产生维持细胞完整性的细胞质丝网络[6]。在非癌性组织胚胎发育过程中,CK18不是广泛性表达的,而是随着上皮细胞发育的阶段不同而特异性表达的,如CK18在正常腺上皮细胞、移行上皮细胞和肝细胞中表达,但不在鳞状上皮分化而来的上皮细胞中表达[7-10]。
在肿瘤诊断中,CK18作为肿瘤标志物广泛用于细胞癌性诊断[11]。研究表明,CK18在不同类型的肿瘤中扮演的角色各有差异。在乳腺癌或结直肠癌中,CK18与肿瘤预后较差相关[12-13]。在口腔癌和尿道移行细胞癌中,CK18表达上调与不良预后相关[14]。这些研究结果暗示在不同类型的肿瘤中,CK18功能可能各不相同,要确定CK18在某一种肿瘤中的具体作用需要对其进行具体研究和分析。
本研究通过构建CK18单克隆稳转Hep G2肝癌细胞株,观察CK18对Hep G2肝癌细胞增殖和迁移的影响。
1 材料与方法
1.1 主要材料 Hep G2细胞购自中科院上海细胞库(中国)。新生牛血清购自杭州四季青(中国)。RPMI-1640细胞培养基、Trizol、Lipofectamine 2000购自Invitrogen(美国)。pEBFP-C1保存于本实验室。无内毒素质粒中量制备试剂盒、感受态DH5均购自北京天根生物(中国)。高保真反转录试剂盒、DNA 琼脂糖凝胶回收试剂盒及限制性核酸内切酶XhoI和EcoR I、T4 DNA ligase 购自大连宝生物(中国)。一抗抗体CK18和BFP、内参抗体GAPDH、ECL显色液、CK18 PCR引物和DNA测序由北京博迈德完成(中国)。实时无标记细胞分析仪 (xCELLigence RTCA S16)和E-Plate L16购自艾森生物(中国)。
1.2 细胞培养 Hep G2细胞用含10%新生牛血清RPMI-1640培养基在37℃、5% CO2的培养箱中培养。
1.3 Hep G2细胞总RNA抽提及反转录合成 Hep G2细胞按60%接种至6cm培养皿中培养过夜,PBS清洗3次,用Trizol按说明书抽提细胞总RNA,紫外分光光度法测定RNA浓度,并用1%琼脂糖凝胶电泳分析RNA质量。以总RNA为模板,用RT-PCR反转录CK18基因。
1.4 基因扩增与重组真核表达载体构建 以cDNA 为模板,用CK18参照序列(NM_000224)设计的CK18引物对(上游引物:5'-tCTCGAGACAGCATGAGCTTCACCACTCGCT-3';下游引物:5'-tGAATTCGGCTTAATGCCTCAGAACTTTGGTGTC-3')经高保真PCR扩增获得CK18的蛋白编码区,扩增条件如下:预变性(94 ℃ 2.5 min)、循环扩增(94℃ 30 s,60℃ 30 s,72℃ 2 min;32 cycles)、稳定(72 ℃ 7 min)。PCR扩增产物经1%琼脂糖凝胶电泳分离后纯化,纯化产物用限制性核酸内切酶XhoI和EcoR I进行双酶切,酶切产物再次回收,插入同样双酶切线性化的真核表达载体pEBFP-C1中,经转化、卡那霉素筛选培养、单克隆菌落扩大培养、质粒抽提、双酶切鉴定和DNA测序鉴定,获得无任何突变的重组质粒pEBFP-CK18。
1.5 细胞转染 DNA抽提获得无内毒素质粒pEBFP-CK18和对照质粒pEBFP-C1并进行细胞转染。转染前1 d,将肝癌细胞Hep G2均匀地铺于六孔板中,密度为0.48×106/孔。转染前30 min将细胞培养基更换为无血清的DMEM培养基,并按Lipofectamine 2000说明书转染pEBFP-CK18和对照质粒pEBFP-C1。转染后6 h将转染液更换为含10%新生牛血清的RPMI-1640培养基。转染后72 h在荧光显微镜下观察细胞荧光。
1.6 单克隆稳转Hep G2肝癌细胞筛选 细胞转染后4d,用600 μg/mL G418对转染的Hep G2进行筛选培养。7 d后,将G418浓度降低至200 μg/mL,继续培养直至单克隆细胞集落形成,荧光显微镜下挑取单克隆细胞株并扩大培养。
1.7 蛋白质免疫印迹 收集适量的细胞,细胞裂解并蛋白定量后,加入上样缓冲液,沸水浴煮沸5 min,蛋白样品冷却离心后,上清液经SDS-PAGE 电泳和电转移至PVDF 膜上后,用5% BSA封闭PVDF膜。一抗抗体CK18按1∶2 000稀释、BFP抗体按1∶5 000稀释、内参抗体GAPDH按1∶8 000稀释,一抗抗体4 ℃孵育过夜,TBST清洗3次,每次10 min。HRP标记的羊抗兔或者羊抗鼠二抗按1∶5 000稀释,37℃孵育2 h。TBST清洗3次,每次10 min。ECL液显色成像。
1.8 细胞增殖检测 在E-Plate L16检测板中加入含10%新生牛血清的RPMI-1640培养液100μL。将E-Plate L16放到xCELLigence RTCA S16上自动扫描,检查基线值,确认孔板接触良好。消化细胞并制成密度2×104/mL的细胞悬液,E-Plate L16中每孔接入100 μL细胞悬液。放入RTCA检测仪中37℃培养120 h,以检测时间(hour)为横坐标,细胞指数(cell index)为纵坐标(代表细胞数量),检测细胞增殖速率。
1.9 细胞划痕-愈合实验 将细胞按90%铺于12孔板,待细胞完全融合后,用10 μL 加样枪头沿直尺垂直于孔板轻轻划“|”,PBS 轻柔清洗两次,洗去脱落的细胞,加入无血清细胞培养基培养,显微镜下分别记录不同时间段细胞图片,并对图片中细胞划痕的宽度进行测量和记录,用公式{细胞迁移率(%)=(原划痕距离-现划痕距离)/原划痕距离×100%}分别计算Hep G2肝癌细胞24 h和48 h迁移率。实验重复3次,并用统计学进行分析。
1.10 统计学分析 实验数据用SPSS 21.0软件进行统计学分析。样本间比较采用独立样本t检验,P<0.01为差异有统计学意义。
2 结果
2.1 成功构建重组真核表达载体pEBFP-CK18 如图1A所示,重组真核表达载体pEBFP-CK18经XhoI和EcoR I双酶切和1%琼脂糖凝胶电泳验证,重组质粒中CK18 DNA片段大小与预期一致。DNA正反测序结果显示,pEBFP-CK18中的CK18蛋白编码区序列无任何突变,可以与标签蛋白EBFP在细胞内融合表达,其质粒图谱如图1B所示。
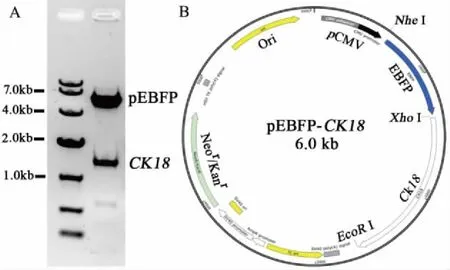
A:Xho I和EcoR I双酶切鉴定分析pEBFP-CK18; B:pEBFP-CK18质粒图谱。图1 质粒pEBFP-CK18图谱及其酶切鉴定
2.2 CK18单克隆稳转肝癌细胞内高表达外源融合蛋白BFP-CK18 肝癌细胞Hep G2稳定性转染pEBFP-CK18后,经细胞筛选、单克隆挑选与扩大培养后,荧光显微镜下细胞胞质呈现蓝色荧光,提示单克隆稳转肝癌细胞(St. cell)可以表达外源融合蛋白BFP-CK18,细胞形态改变(见图2)。为进一步验证细胞内是否表达外源目的蛋白,对单克隆稳转肝癌细胞进行蛋白免疫分析,与对照细胞相比,发现St. cell中高表达BFP-CK18(见图3),证明单克隆稳转肝癌细胞株构建成功。
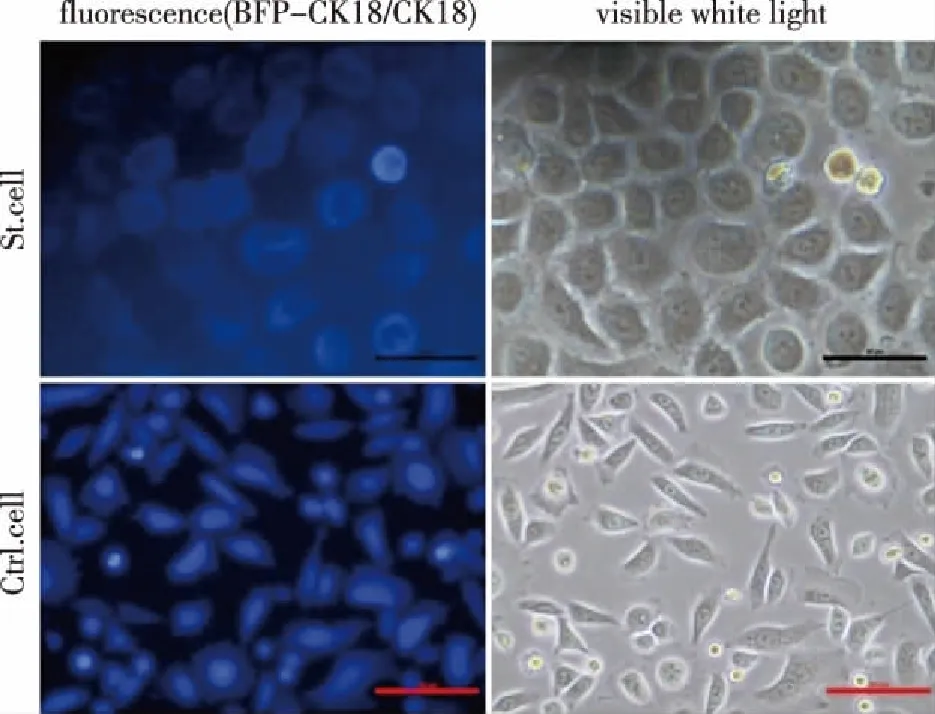
St. cell:表达外源融合蛋白BFP-CK18的稳转Hep G2肝癌细胞;Ctrl. cell:表达外源BFP蛋白的稳转Hep G2肝癌细胞。图2 单克隆稳转Hep G2肝癌细胞呈蓝色荧光

图3 外源融合蛋白BFP-CK18在单克隆稳转Hep G2肝癌细胞中表达
2.3 CK18抑制肝癌细胞Hep G2的细胞迁移 利用RTCA对单克隆稳转Hep G2肝癌细胞的生长速率进行实时检测,发现高表达外源CK18蛋白的Hep G2细胞的生长速度并未发生显著变化(见图4A)。用划痕-愈合实验对肝癌细胞迁移能力进行分析,发现肝癌细胞内表达外源CK18后,细胞的迁移能力增强,统计学意义差异明显(P24h=0.003,P48h=0.007)(见图4B、C)。
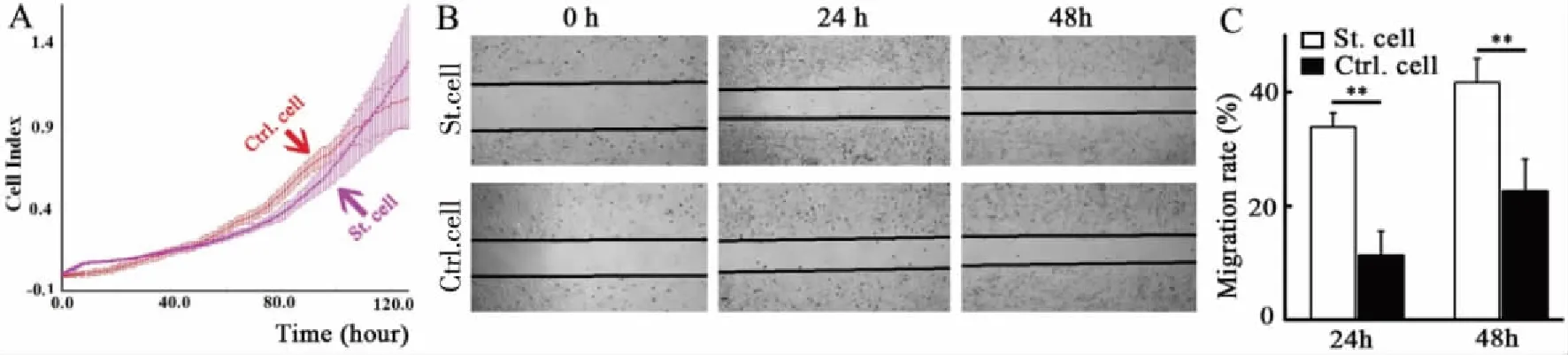
A:单克隆稳转肝癌细胞的增殖速率;B:单克隆稳转肝癌细胞迁移率;C:单克隆稳转肝癌细胞迁移率数据分析;**:P<0.01。图4 单克隆稳转Hep G2肝癌细胞的增殖和迁移
3 讨论
CK18是存在于上皮组织中的多功能中间丝蛋白,参与细胞内骨架结构的形成[1-3]。有研究发现,肿瘤细胞内CK18与波形蛋白共表达可导致细胞内骨架蛋白之间作用增加,促进黑色素瘤细胞迁移[14]。另外,在约25%的非典型增生细胞和50%的食管癌细胞中均有观察到CK18蛋白与其伴侣蛋白CK8的共同积累,而在正常的食管鳞状上皮不存在这种现象,因此,CK18过度表达被认为与恶性肿瘤相关[7, 15]。在其他恶性肿瘤如口腔癌[14]、头颈部癌[16]和尿道移行癌[8]中也报道了类似的现象。与之相反的是,在一些腺癌如人乳腺癌和结直肠癌中,CK18与CK8的表达反而随着肿瘤发展进程而表达逐步下调[17-18]。这些矛盾的结果显示CK18的表达与肿瘤的恶性程度因肿瘤类型不同而有所差异。
本研究中,发现肝癌细胞中CK18高表达不影响细胞的增殖能力,但肝癌细胞形态改变,这是因为CK18是细胞骨架的重要组成部分,其表达、分布等变化均可使细胞形态改变[19]。同时,高表达CK18后,肝癌细胞迁移的能力增强,这与人肺腺癌[20]、人黑色素瘤细胞[14]和小鼠L细胞[21]的研究结论基本一致。但是,也有学者发现在人乳腺癌细胞中导入外源CK18基因后,其肿瘤恶性程度显著降低[22]。产生如此大的差异可能是因为CK18本身与恶性转化并不直接相关,它可能是通过其他间接方式如促进上皮-间质转化而实现的。也有研究表明,癌基因可以通过激活转录因子而活化Ras信号通路,刺激CK18基因表达[23]。但这种CK18的表达变化仅反映癌细胞内癌基因被激活的现象而已,与CK18直接致癌或抑癌的理论不无直接关系。尽管现阶段对于CK18对不同肿瘤的作用已有一定的认识,但其背后深藏的具体机制有待于继续发掘。在本研究中,成功克隆人细胞角蛋白CK18基因并构建真核表达载体pEBFP-CK18,并利用脂质体稳定转染和G418药物筛选成功构建了高表达外源蛋白CK18的单克隆稳转Hep G2肝癌细胞株,细胞形态改变,细胞迁移能力增强,为下一步探索CK18促进肝癌细胞Hep G2迁移的分子机制和信号通路奠定实验基础。
