淫羊藿苷通过上调PPARα/γ信号通路改善无高脂饮食SHR单纯性脂肪肝
2019-10-22曾凡群李晓彤李叶丽杨丹莉
曾凡群,岳 云,李晓彤,李叶丽,杨 华,杨丹莉
(1. 遵义医科大学 基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室,贵州 遵义 563099;2. 遵义医科大学第二附属医院 病理科,贵州 遵义 563099)
脂肪肝是脂肪酸入肝过多而脂蛋白合成代谢发生障碍,脂肪酸氧化不足时脂质沉积于肝脏的一种常见病理改变。包括酒精性脂肪肝与非酒精性单纯性脂肪肝(Nonalcoholic simple fatty liver, NAFL),后者是脂肪肝中肝细胞脂肪变性最轻的一种,可逐步发展为非酒精性脂肪性肝炎[1]。过氧化物酶体增殖物激活受体家族(Peroxisome proliferators-activated receptors, PPARs)是由Green和Issemann在1990年首先发现并报道的,是Ⅱ型核激素受体家族中的一员,是一类由配体激活的核转录因子。PPARs的3种亚型为PPARα、PPARβ/δ和PPARγ,它们的组织分布不同,所具备的生物功能也不尽相同,可调节肝脏三酰甘油的聚集且调节可逆性脂肪变性转化为不可逆性脂肪变性的过程[2]。但能否通过调控PPARs改善单纯性脂肪肝还应继续深入研究。自发性高血压大鼠(Spontaneously hypertensive rats, SHR)是目前公认的筛选抗高血压药物的理想动物模型,已广泛应用于原发性高血压及其并发症的发病及防治研究。在SHR肝脏病理中可观察到肝细胞肿大,偶见有肝细胞坏死现象[3]。Xing等[4]研究发现SHR出现单纯性脂肪肝。
淫羊藿又名仙灵脾,系小檗科淫羊藿属(Epimediuml.)植物,其主要活性成分之一是淫羊藿苷(Icariin, ICA),具有增强免疫系统、改善心脑血管功能(如高血压心脏病、阿尔兹海默症)等作用[5]。ICA对单纯性脂肪肝的改善作用鲜有文献报道。故本研究拟观察无高脂饮食的条件下,SHR的肝脏病理是否出现单纯性脂肪肝;ICA是否具有抗SHR大鼠单纯性脂肪肝的作用,以及该作用是否与调控PPARα/γ的表达有关。
1 材料与方法
1.1 药品与试剂 ICA(纯度≥98 %,批号:FY17420615,购于南京泽朗医药有限公司);PPARα兔抗大鼠抗体(货号:15540-1-AP);PPARγ兔抗大鼠抗体(货号:16643-1-AP);GAPDH鼠抗大鼠抗体(货号:10494-1-AP),二抗抗鼠(货号:5A00001-1);二抗抗兔(货号:5A00001-2)均购于Proteintech公司;免疫印迹化学发光试剂(ECL,上海七海生物有限公司)。
1.2 仪器 Supply Mini-Protean3电泳仪;PowerLab多导生物信号采集分析系统(澳大利亚AD公司);Olympus光学显微镜及照相系统(日本Olympus公司);Eppendorf 5417R离心机(德国Eppendorf公司);Mini Trans-Blot转移系统(美国BIO-RAD公司);冰冻切片机(美国Thermo公司);CCD成像系统(美国BIO-RAD公司)。
1.3 实验动物及分组 13周龄的雄性SHR大鼠28只及正常对照雄性魏-凯二氏大鼠(Wistar-Kyoto rats, WKY)7只,所有实验大鼠均为无特定病原体动物(specific pathogen-free animal, SPF),体质量260~300 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。所有大鼠均于SPF级动物房适应性喂养1周,喂养条件:相对恒定室温(20~24 ℃)和湿度(58%~62%),所有实验动物均自由饮水和进食(饲料为Co60辐照实验鼠维持饲料,购于江苏省协同医药生物工程有限责任公司出品。生产许可证号:苏饲证(2014)01008。其中主要成分(每千克饲粮含量)为水分(g)≤100;粗蛋白(g)≥180;粗脂肪(g)≥40;粗纤维(g)≤50;粗灰分(g)≤80;钙(g):10~18;总磷(g):6~12;钙:总磷=1.2∶1~1.7∶1;赖氨酸(g)≥8.2;蛋氨酸+胱氨酸(g)≥5.3。不含高脂饮食成分)。将SPF级的7只WKY大鼠做正常对照组,SPF级的28只SHR大鼠随机均分为4组,具体分组如下:①正常对照组(WKY大鼠);②模型组(SHR);③ICA低剂量组(10 mg/kg);④ICA中剂量组(20 mg/kg);⑤ICA高剂量组(40 mg/kg)。ICA低、中、高剂量组分别给予ICA混悬液(10、20、40 mg/kg.ig, bid),模型组SHR大鼠和对照组WKY大鼠均同样给药方式(ig)给予等体积ddH2O,至26周龄。
1.4 实验方法
1.4.1 大鼠血压测量 采用Kent Scientific CODA系统测量14周龄至26周龄时SHR大鼠和WKY大鼠安静避光状态下的血压值。每两周测量1次血压。
1.4.2 HE染色 给药12周后,禁食12 h,7%水合氯醛(0.35 g/kg)经腹腔注射麻醉成功后,取各组大鼠肝脏组织约3 mm,固定于4%中性甲醛,固定48 h后脱水、包埋、切片后、进行HE染色,Olympus光学显微镜下观察肝脏病理学变化。
1.4.3 冰冻切片的制备及脂肪染色 给药12周后,禁食12 h,7 %水合氯醛(0.35 g/kg)经腹腔注射麻醉成功后,摘取肝脏。切取一块肝组织,大小约1 cm3,于-20 ℃下行冰冻切片,切片厚度为8 μm,以沾有明胶的玻片粘片。将切片放入70 %酒精固定1 min,苏丹Ⅲ浸染1~2 min,用70 %酒精稍洗,苏木素复染,水洗,蓝化,甘油明胶封片,光镜下观察肝组织脂滴的变化。
1.4.4 Western blot检测各组大鼠肝组织PPARα和PPARγ蛋白水平 取各组大鼠冰冻肝脏组织约100 mg,用组织剪剪碎后放入1 mL RIPA 裂解液中,加入10 μL PMSF溶液,于冰上匀浆后静置30 min,4 ℃离心20 min,转速为12 000 rpm,取其上清液,待测样品中的总蛋白浓度采用BCA法进行测定。每孔上样量为30 μg进行电泳。完成电泳过程后采用 Bio-Rad Mini Trans-Blot转移系统聚偏氟乙烯(PVDF)膜进行转膜操作,5 %蛋白封闭液封闭2 h,TBST洗膜10 min×3次,一抗结合:PPARα(1∶1 000)、PPARγ(1∶1 000)、GAPDH(1∶5 000),4 ℃过夜; TBST洗膜10 min×3次,室温孵育二抗(1∶5 000)1 h、TBST洗膜5 min×3次,ECL化学发光显色,Bio-Rad CCD成像系统获取图像。
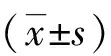
2 结果
2.1 SHR血压变化情况 与WKY组相比,SHR组收缩压(systolic blood pressure, SBP)和舒张压(diastolic blood pressure, DBP)明显升高(P<0.05),给予ICA-L、ICA-M、ICA-H后均可降低SHR的SBP(P<0.05),且以ICA-H降压效果最为显著。与ICA-L组相比,ICA-H组降低SBP和DBP的作用差异有统计学意义(P<0.05,见图1)。
# vs WKY,P<0.05;* vs SHR,P<0.05; ▲ vs ICA-L,P<0.05。图1 每组大鼠血压值的变化(数据以
2.2 肝脏组织病理变化 WKY组可见肝血窦和肝索排列整齐。SHR组部分肝细胞水肿,胞浆疏松化,个别细胞气球样病变,可见细胞核固缩、核碎裂,核溶解性消失,肝血窦狭窄,以中央静脉周围细胞最为明显。ICA中、高剂量组上述病变均有所改善,以ICA高剂量组改善最为显著(见图2)。
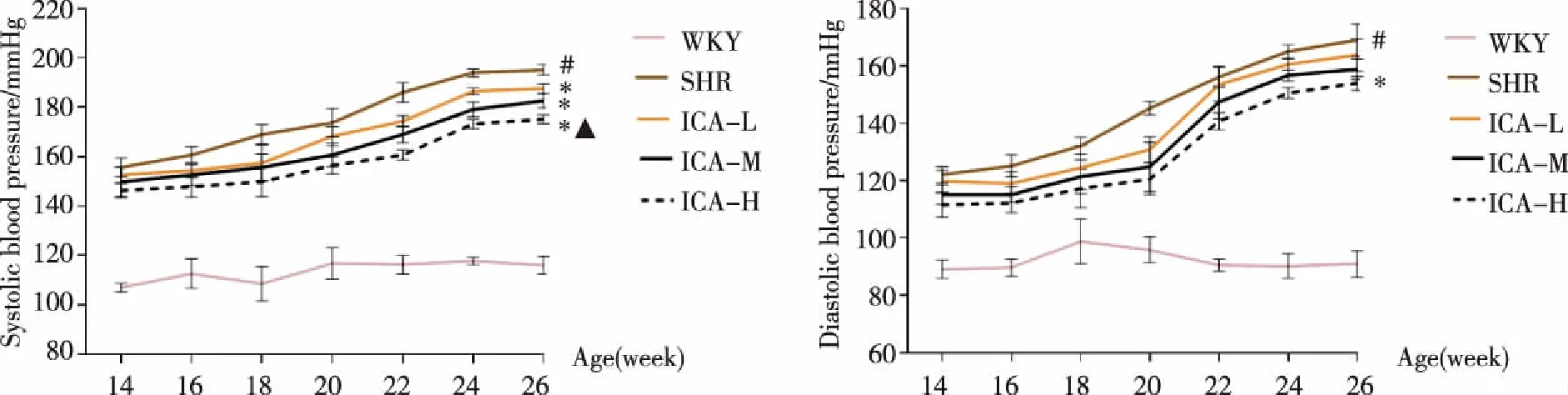
2.3 肝脏脂肪染色结果 WKY组与SHR组细胞核呈蓝色,WKY组肝小叶结构完整,无明显的脂肪变性,SHR组肝细胞体积增大、胞浆中存在大小不等染成桔黄色的脂肪滴,大者可充满整个肝细胞,中央静脉周围或肝小叶脂肪变性,即成片组织脂肪变性,以中央静脉周围的细胞最为明显。ICA中、高剂量组细胞核呈蓝色,脂滴分布不均,脂滴量少而散在,无明显的向心性改变、以ICA高剂量组改善最为显著(见图3~4)。

图2 ICA对SHR肝脏病理变化的影响(标尺:100 μm, 放大倍数:200倍)

图3 ICA对SHR肝脏脂肪染色的影响(标尺:100 μm, 放大倍数:200倍)
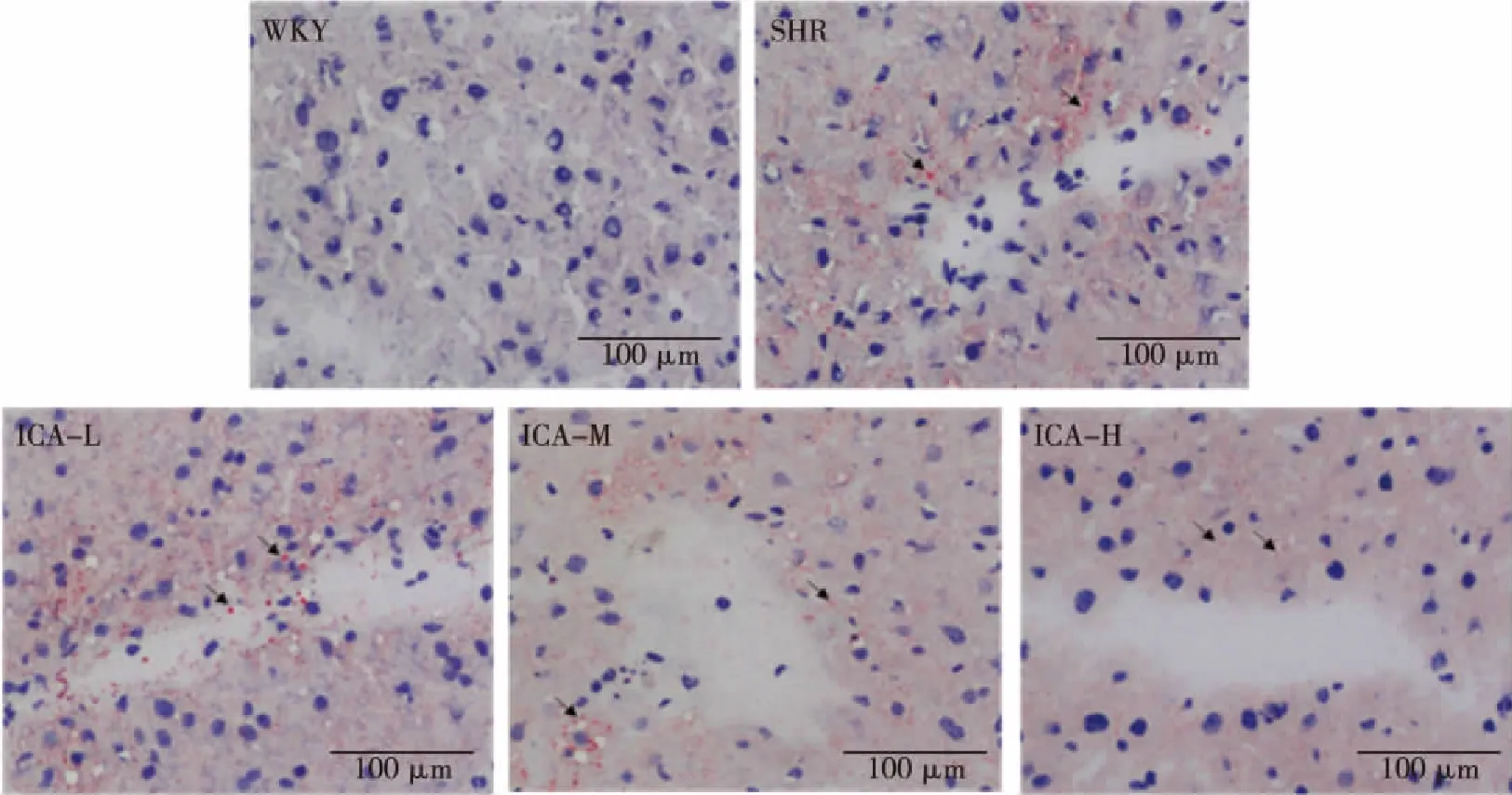
图4 ICA对SHR肝脏脂肪染色的影响(标尺:100 μm, 放大倍数:400倍)
2.4 ICA对SHR肝脏组织中PPARα、PPARγ的影响 Western blot法检测了SHR肝脏组织。结果发现,与WKY组相比,SHR组PPARα、PPARγ表达明显下调(P<0.05);与SHR组相比,ICA中、高剂量组PPARα、PPARγ表达明显上调(P<0.05)。以ICA高剂量组改善程度最为明显(见图5~6)。
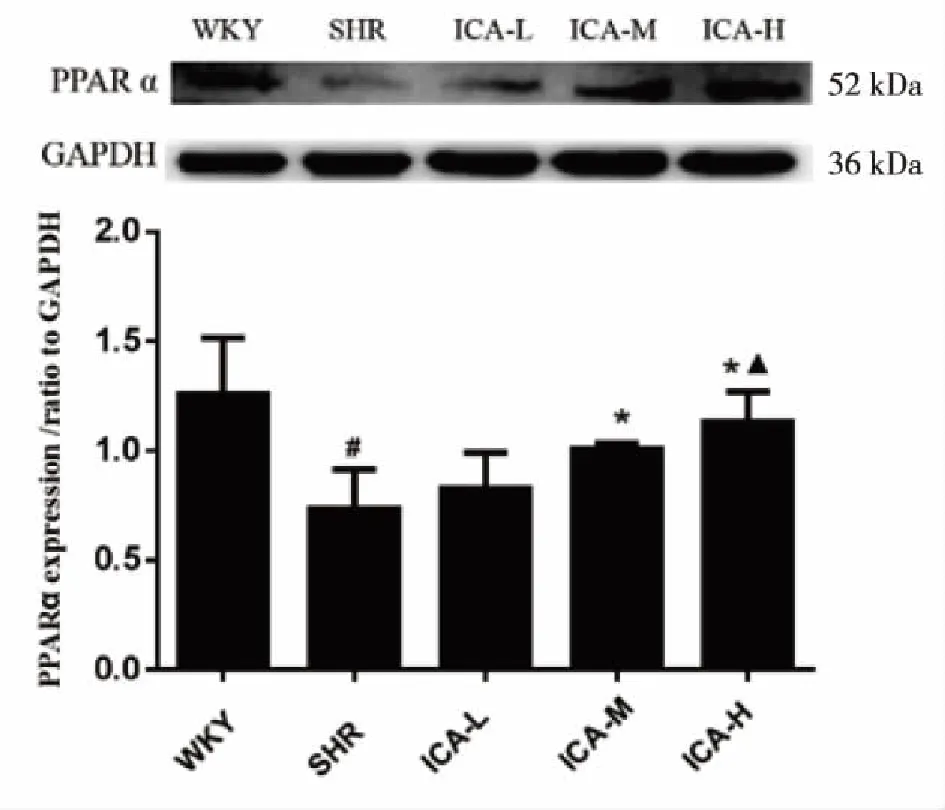
# vs WKY,P<0.05;* vs SHR,P<0.05; ▲ vs ICA-L,P<0.05。 图5 ICA对SHR肝脏PPARα表达的影响(数据以表示, n=4)
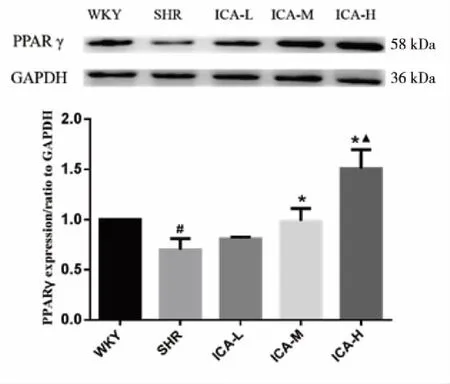
# vs WKY,P<0.05; * vs SHR,P<0.05; ▲ vs ICA-L,P<0.05。 图6 ICA对SHR肝脏PPARγ表达的影响(数据以表示,n=4)
3 讨论
ICA是淫羊藿系小檗科淫羊藿属植物的主要活性成分之一,具有增强免疫系统、改善心脑血管功能(如高血压心脏病、阿尔兹海默症)等作用,还具有补肾壮阳、抗衰老等功效。但ICA是否通过作用于PPARα、PPARγ改善无高脂饮食SHR脂肪变作用尚不清楚。
单纯性脂肪肝是指肝细胞发生脂肪变性,并无明显的炎症、坏死及纤维化的一类疾病,主要病理表现为大泡性脂肪变性并含有散在脂肪球的肝细胞[6]。脂肪肝是当代人常见的慢性病理改变之一。单纯性脂肪肝与高血压、高血脂症、肥胖、2型糖尿病等代谢综合征密切相关[7]。SHR的高血压心血管并发症、外周血管阻力变化等都与人类高血压患者相似,是筛选抗高血压药物的理想动物模型[8]。研究结果显示,SHR组肝细胞体积增大、胞浆中存在大小不等染成桔黄色的脂肪滴,大者可充满整个肝细胞,中央静脉周围或肝小叶脂肪变性,即成片的肝脏组织脂肪变性,以中央静脉周围的细胞最为明显。这与Xing等[4]研究发现SHR可引起单纯性脂肪肝的发现一致。说明本研究中SHR单纯性脂肪肝模型造模成功。同时,本研究结果发现,ICA-H组无高脂饮食SHR血压明显降低,肝血窦和肝索排列较SHR组整齐,桔黄色的脂肪滴较SHR组明显减少。表明ICA能改善无高脂饮食SHR肝脏结构紊乱,改善肝组织脂肪样病变作用。
PPARs作为一种配体激活型的核受体,包含三个亚型,分别是PPARα、PPARβ/δ和PPARγ,并且由各自不同的基因编码[9]。文献报道噻唑烷二酮类(TZDs)和非TZDs药物激活PPARs后,能够改善胰岛素抵抗、纠正脂质代谢紊乱[10];PPARα主要在脂代谢能力强的组织中表达,例如肝脏、骨骼肌、棕色脂肪组织,使肝脏氧化脂肪酸能力加强,进一步调节人体的能量代谢平衡(如葡萄糖和脂类代谢)[11]。有研究表明,硒元素上调PPARα的表达改善大鼠NAFL[12]。白藜芦醇通过调控PPARα通路改善脂质代谢和氧化还原稳态,从而保护NAFL[13]。因此,当脂质沉积于肝脏诱发脂肪肝时,PPARα通过调控编码肝脂肪酸结合蛋白、载脂蛋白AⅠ/AⅡ等基因的转录和活化,从而影响脂肪酸的摄取、结合及脂质转运过程,对脂肪性肝病起到一种保护作用。PPARγ主要在肝脏、脂肪组织中高表达,而在肾、脾、肺、脑和血管为低水平表达[14]。桑叶黄酮上调肝组织PPARγ改善2型糖尿病并发单纯性脂肪肝[15]。此外,PPARα/γ的新型配体异苯酮和辅酶Q10具有逆转脂肪肝发病的
能力[16]。因此,通过调控PPARα/γ的表达至少可能对脂肪性肝病有保护作用。本研究结果发现,ICA能抑制SHR单纯性脂肪性肝组织中PPARα、PPARγ蛋白表达的下调。故ICA具有改善SHR所致单纯性脂肪性肝病作用,其作用机制可能与其上调PPARα/γ的蛋白表达有关。
