丹东地区常见鱼类水霉菌的分离、纯化、鉴定及拮抗菌的筛选
2019-10-21冯春明杨笑谈马德利
冯春明 杨笑谈 马德利
摘要:水霉病是一类全球分布的鱼类疾病,目前池塘养殖尚没有有效、安全的防治方法。为探究水霉病的生物防治方法,以丹东地区发生水霉病的鱼体分离出的水霉致病菌为指示菌,对从土壤、水样中分离纯化获得的62株放线菌、17株细菌进行平板对峙实验,获得2株对水霉致病菌抑制效果最好的拮抗菌,经分子生物学鉴定,分别为淡紫灰链霉菌(S.lavendulae)及特基拉芽孢杆菌(B. tequilensis),均对鱼类无毒力。
关键词:鱼类;水霉;拮抗菌
水霉病是由霉菌的侵入感染导致的真菌性鱼病,常见的病原菌为水霉属和绵霉属的一些种类,一年四季均可发生,是一类全球分布的鱼类疾病[1],给养殖业造成了不可估算的危害。当鱼体表面因外界因素导致伤口时,霉菌在水中产生的游动孢子便随机侵入鱼体,形成菌丝寄生于坏死组织中,分泌消化酵素分解周围组织,使鱼体组织溃烂、坏死,最终导致鱼类死亡。
避免人为操作损伤是预防水霉病的主要手段,此外观赏鱼水霉病可采用升温、提高盐度等方法抑制[2-4],但池塘养殖鱼类仍没有有效、安全的防控方法。本研究旨在分离纯化水霉病致病菌,筛选拮抗菌,研究水霉病的生物防治方法。
1材料与方法
1.1试验材料
患病鲤鱼、泥鳅取自丹东市宽甸满族自治县某养殖场和东港椅圈镇某养殖场,经充氧运输回实验室,进行解剖和水霉菌分离。
1.2水霉菌分离培养基
马铃薯葡萄糖琼脂培养基(PDA):土豆0.20 kg、葡萄糖0.02 kg,琼脂粉0.015~0.020 kg,蒸馏水1 L,用于水霉病病原菌的分离、纯化培养。
1.3水霉病病原菌的分离纯化
无菌状态下,取病鱼胸鳍、尾鳍、背鳍、肌肉组织的患病部分,接种到马铃薯葡萄糖琼脂培养基上,在25 ℃的培养箱中培养2~3 d,观察水霉病病原菌的菌丝生长情况,取无污染培养基转接纯化1~2次。
1.4病原菌观察
用接种环挑取适量菌丝,用美兰染色液进行染色,3~4 min后在显微镜下镜检,观察并记录菌落形态。
1.5分子生物学鉴定
真菌模板制备:取50 μL真菌PCR裂解液于灭菌的离心管中,用无菌接种环或移液枪头挑取单个菌落,放置于裂解液中震荡数次后取出。80 ℃的水浴锅中热变性15 min,采用低速离心(5 000 r/min)10 min,PCR反应的模板为裂解后的上清液。
PCR反应体系为 50 μL:Premix Taq(EX Taq Version 2.0) 25 μL, 模板DNA(裂解上清液)2 μL,引物Forward primer (10 μmol/L) ITS1(5-TCCGTAGGTGAACCTGCGG-3)1 μL ,Reverse primer (10 μmol/L) ITS4(5-TCCTCCGCTTATTGATATGC-3)1 μL,dd H2O加21 μL。
PCR反应条件为:94 ℃预变性4 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸50 s,共35个循环;72 ℃终延伸10 min,4 ℃保存。
1.6水霉拮抗菌分离、筛选
共采集20份土壤、水样品,采用平板稀释分离法,分离纯化获得放线菌62株、细菌17株。以分离纯化的水霉菌为指示菌,采用平板对峙法,篩选拮抗效果良好的拮抗菌。
1.7水霉拮抗菌鉴定
对筛选出来的拮抗菌的16S rDNA片段进行扩增、测序,序列比对,结合其形态学特征及16S rDNA序列系统发育分析结果,最终确定拮抗菌种类。
1.7.1拮抗菌16S rDNA序列扩增采用通用引物(27f: 5-AGA GTT TGA TCM TGG CTC AG-3;1 492 r:5-TAC GGY TAC CTT GTT ACG ACT T-3)进行16 S rDNA的PCR扩增,扩增体系(50 μL):1×Taq PCR Master Mix 25 μL,DNA模板1 μL(0.1~10 ng),引物(10 μmol/L)各2 μL,dd H2O 20 μL。PCR反应条件为:94 ℃预变性4 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,30个循环;72 ℃延伸10 min,4 ℃终止反应。扩增产物经1%琼脂糖凝胶电泳检测后于-20 ℃冰箱保存。
1.7.2拮抗菌16S rDNA序列测定扩增产物送至生工生物工程(上海)有限公司进行纯化,双向测序并拼接输出全序列。
2结果
2.1菌落
分离的水霉病病原菌单菌落,见图1。
2.2水霉病病原菌显微形态
在显微镜下,水霉呈现交错纵横的丝状结构,在菌丝中有很多个细胞核,中间不存在横隔,相当于一个多核细胞,见图2。
2.3水霉病病原菌DNA序列
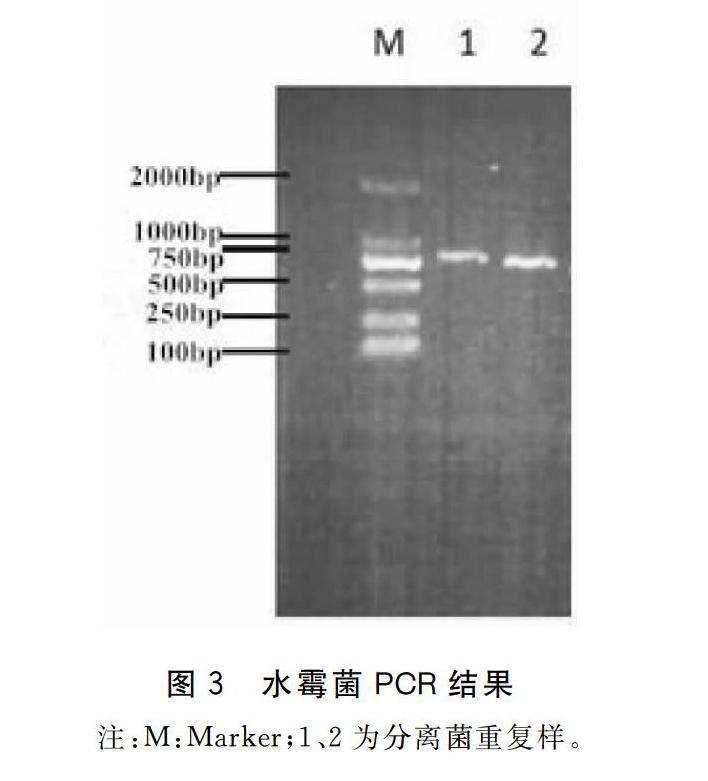
以分离菌DNA为模板,ITS1和ITS4为引物扩增了长度约为1.1 kbp的目的片段,见图3。
2.4水霉病病原菌测序比对结果
分离菌序列在GeneBank数据库中进行Blast比对分析,与寄生水霉(Saprolegnia parasitica)序列相似程度达98.80%。
2.5水霉拮抗菌分离筛选结果
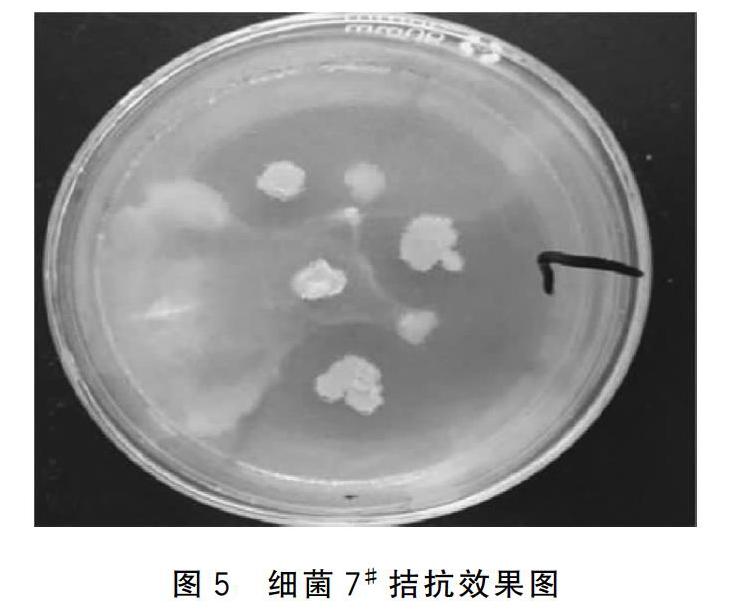
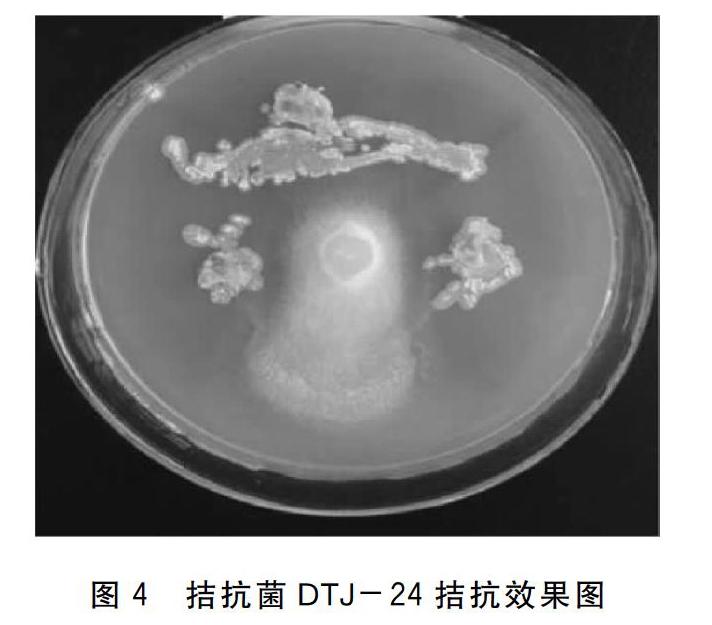
试验筛选获得2株拮抗效果良好的拮抗菌:DTJ-24和7#,拮抗效果见图4、图5。
2.6水霉拮抗菌鉴定
根据拮抗菌DTJ-24和7#的16S rDNA片段序列,使用Genebank数据库进行Blast比对分析,确定水霉拮抗菌DTJ-24为淡紫灰链霉菌(Streptomyces lavendulae); 7#为特基拉芽孢杆菌(Bacillus tequilensis)。
3讨论
对患病的鲤鱼、泥鳅体表及肌肉进行致病菌分离,均获得较纯的致病菌,经美兰染色显微镜观察和分子生物学鉴定,显示该致病菌均为寄生水霉(S. parasitica),说明丹东地区水霉病致病菌主要为寄生水霉。
水霉病是水产养殖影响最广泛的一种疾病,多发生在养殖生物受伤后。大部分水产养殖生物在受伤后可自愈,说明水环境中微生物对水霉在鱼体表的寄生有一定的拮抗性。近年来,微生态制剂对水产动物疾病的预防与治疗作用也受到越来越多的关注[5-6]。生物防治方法避免了利用药物治疗引起的药物残留、急性应激等方面问题。
本研究以分离出的水霉致病菌为指示菌,通过平板对峙试验筛选出两株拮抗效果良好的细菌,鉴定得知两株菌分别为淡紫灰链霉菌(S. lavendulae)及特基拉芽孢杆菌(B. tequilensis)。我们对泥鳅鱼进行了两种拮抗菌的高浓度浸泡及注射感染试验,泥鳅鱼无死亡,确定分离的拮抗菌对鱼类无毒力,可用于防控鱼类水霉病。
参考文献:
[1] 张钰.鱼类水霉病的发生及防治措施[J].黑龙江水产,2017(2):45-46.
[2] 李明丽.新法防治水霉病[J].黑龙江水产,2004(2): 14-15.
[3] 王烈华.禁用孔雀石绿—水霉病如何防治[J].渔业致富指南,2002(21):44-45.
[4] 刘士奇.水霉病的防治方法[J].水产养殖,2010(1): 30-31.
[5] 贺凤,许德麟,张其中.水霉拮抗菌的筛选及其拮抗活性物质稳定性初步研究[J].微生物学通报,2015(6):1067-1074.
[6] 张书俊,杨先乐,李聃,等.水霉拮抗菌的筛选及其拮抗作用的初步研究[J].水生生物学报,2008(3):301-307.
