杠板归提取物体外抗柯萨奇病毒B3作用机理初探
2019-10-21雷湘周峰陈科力杨珍
雷湘 周峰 陈科力 杨珍
【摘 要】目的:本文旨在初步研究杠板归提取物抗病毒作用的机理。方法:用不同处理方法得到的药物样品采用不同的作用方式作用柯萨奇病毒(CVB3)感染的Hep-2细胞,72h后MTT法测定细胞活性;利用体外培养的小鼠腹腔巨噬细胞,加入不同的药物样品,检测巨噬细胞分泌的γ-干扰素量的变化,以此判断杠板归提取物对小鼠免疫功能的影响。结果:S2样品具有直接杀死CVB3作用,还可以抑制CVB3病毒的生物合成并且具有明显的刺激巨噬细胞产生γ-干扰素的作用;S1样品具有一定的直接杀死CVB3作用,但其他作用机制不明显。结论:杠板归不同提取部位抗病毒效力不同,机理也不同。S2样品可以直接杀死病毒,对于进入细胞内的病毒,可通过调节机体的免疫能力,抑制病毒在细胞内的生物合成来发挥抗病毒的效力;S1抗病毒作用不强。
【关键词】杠板归提取物;抗病毒作用;γ-干扰素;巨噬细胞;
【中图分类号】R47 【文献标識码】A 【文章编号】1672-3783(2019)01-0082-02
杠板归为一种蓼科一年生草本植物,主要有清热止咳、散瘀解毒、止痛等作用,广泛用于治疗疱疹,溃疡,疟疾,水肿,湿疹,痢疾,百日咳,丹毒,毒蛇咬伤等,疗效确切[2-3]。文献显示杠板归具有较好的抗病毒的作用,但是其抗病毒作用的有效成分是什么,抗病毒机理是什么,亟待解决,我们选择两种不同的提取方法获得的杠板归提取部位作为实验药物样品进行抗病毒研究,以期发现活性较高的有效部位。科萨奇病毒在人群中感染十分普遍,与多种疾病都有关系,是病毒性心肌炎的主要病因,能引起心肌细胞的各种炎症反应,影响心脏功能,目前国内外还没有有效的治疗CVB3药物,我们前期预实验发现杠板归提取物具有一定的抗CVB3的作用,但作用有效成分和机理还未确定。本实验为后期深入研究其抗病毒作用奠定了基础。
1 材料
CO2恒温细胞培养箱(上海博讯实业有限公司医疗设备厂);超净工作台(上海博讯实业有限公司医疗设备厂);XD-30倒置显微镜(宁波舜宇仪器有限公司);AG22331HAMBURG高速冷冻离心机(德国Eppendorf有限公司);RPMI-1640(GIBCO公司);小牛血清(GIBCO公司);四甲基偶氮唑盐(MTT)(Amresco公司);Hep-2细胞,由武汉大学基础医学院病毒研究所保存,细胞生长液为含10%小牛血清的RPMI-1640,细胞维持液为含2%小牛血清的RPMI-1640;CVB3(Nancy株),由武汉大学医学院病毒所保存。病毒经Hep-2细胞活化增殖,细胞病变达75%以上时收获,反复冻融3次,3000rpm离心30min,上清液分装后-20℃保存备用。在Hep-2细胞上测定其TCID50为10-5。实验中使用的感染剂量为100TCID50;IFN-γ试剂盒(QuantoBio 公司);KM种小鼠,雄性,体重(20±2)g,购于湖北省疾病控制中心。
2 方法
2.1药物样品制备 杠板归提取物由湖北中医学院中药资源国家重点实验室提供,样品S1、S2分别为不同处理方法得到的不同提取部位的干燥粉末。具体提取方法如下:将杠板归切小段,10倍体积水煮3次,合并水液,浓缩成相当于0.5~1g×ml-1原药材的原液。用70%乙醇沉淀,取上清液回收乙醇,干燥,保存,作为S1样品;上述扛板归水提取醇沉淀后的沉淀干燥,保存作为S2样品。
2.2药物样品对细胞的毒性测定 96孔培养板上培养Hep-2细胞,使其生长成单层细胞后,弃去培养液,分别加入含有不同浓度药物样品的细胞维持液,使每组药物终浓度分别为1、2、4、8、16、32mg·mL-1,37℃,5%CO2培养,每12h观察一次细胞形态,并以正常细胞作对照,72h后MTT法检测细胞活性,计算出药物对细胞的TC50。每一药物浓度均重复4孔。
2.3药物样品体外抗柯萨奇病毒试验根据2.2药物样品对细胞毒性的实验结果,在半数毒性浓度下确定高、中、低3个浓度梯度,以培养液对药物样品进行溶解和稀释,分别用这三种不同浓度的药物样品对细胞进行处理。
2.3.1药物样品抗病毒吸附组 将含有不同浓度的药物样品的培养液0.1ml加入生长完好的单层Hep-2细胞96孔培养板中(每孔细胞数目大致相同),37℃,5%CO2孵育1.5h后,弃去含药培养液,再加入0.1ml病毒液,37℃,5%CO2孵育1.5h后,弃去病毒液,再加入普通细胞维持液继续培养。
2.3.2 药物样品对病毒直接作用组 将含有不同浓度的药物样品的培养液0.1ml和病毒液0.1ml混合,37℃,5%CO2孵育1.5h后,再加入到生长完好的单层Hep-2细胞96孔培养板中,37℃,5%CO2孵育1.5h后,弃去含药含病毒培养液,再加入普通细胞维持液继续培养。
2.3.3 药物样品抗病毒生物合成组 将0.1ml病毒液加入生长完好的单层Hep-2细胞96孔培养板中,37℃,5%CO2孵育1.5h后,弃去病毒液,再加入含有不同浓度的药物样品的维持液继续培养。
以上三个实验组经过处理后,37℃,5%CO2继续培养72h~120h,参照正常细胞对照组,病毒对照组,每12h观察细胞生长情况及相应CPE程度,72h~120h细胞对照组生长正常,病毒对照组出现75%以上典型CPE时采用MTT法检测细胞活性。
2.3.4细胞活性测定和试验数据处理 MTT法、细胞存活率和病毒抑制率的计算方法
MTT法测定药物细胞毒性:96孔板弃去含药维持液,每孔加入5%MTT溶液50ul,继续培养4h,终止培养,弃去MTT液,每孔加入100ulDMSO,振荡10min,使结晶物充分溶解,选择570nm波长在酶联免疫检测仪上测定各孔的光吸收值。
细胞存活率= 药物组平均OD值/细胞对照组平均OD值×100%;
病毒抑制率=(药物组平均OD值-病毒对照组平均OD值)/(正常细胞对照组OD值-病毒对照组OD值)×100%;
半数细胞毒性浓度TC50为使药物组OD值比正常细胞对照组降低50%的药物浓度;
半数病毒抑制浓度IC50为保护50%的细胞免受病毒破坏的药物组浓度。
用 SPSS 11. 5软件来计算。采用治疗指 数(TI) 作为评价指标来衡量药物对病毒的抑制 效力。TI= TC50/IC50 。TI值越大,药物抑制病毒的作用越强。
2.4小鼠腹腔巨噬细胞培养 3d前向小鼠腹腔内注入无菌的液体石蜡1ml,引颈处死小鼠,消毒后置于无菌操作台内,剪开腹部,暴露出腹膜,用少许70%酒精轻擦腹膜壁后,注入5mlPBS液,然后用针头轻轻挑起腹壁,吸出腹液置于离心管中,1000rpm4℃离心10min,去上清,加入含20%小牛血清的RPMI-1640培养液,37℃,5%CO2培养2h后,弃去培养液,然后加入20%培养液,37℃,5%CO2培养24h后消化细胞,离心去上清,用PBS洗两次,将制备好的巨噬细胞悬液加入96孔培养板,并使每孔的细胞浓度控制在103ml-1中,37℃,5%CO2培养。
2.5将生长成单层巨噬细胞培养液弃去,分别加入含不同浓度药物样品的维持液,37℃、5%CO2培养,每12小时观察一次细胞形态,并与正常细胞作对照,24h后MTT法检测细胞活性,每一药物剂量均重复2孔,计算TC50。
2.6 药物样品对小鼠腹腔巨噬细胞功能的影响根据2.5的实验结果,在药物TC50范围内,确定高、中、低3个浓度梯度,加入到生长成单层的巨噬细胞96孔板中,37℃,5%CO2培养,24h后,用γ-干扰素试剂盒检测,在450nm处测定吸光度,根据公式释放率%=(样品OD值-阴性对照OD值)/阳性对照OD值×100%,计算得到药物样品的γ-干扰素释放率(阳性对照和阴性对照均为试剂盒内含)。
3 结果
3.1药物样品对Hep-2细胞的毒性 不同浓度的药物作用于Hep-2细胞72h后,用MTT法测定细胞活性。经过计算,得到S1样品TC50为2.9μg×ml-1,S2样品 TC50为3.4μg×ml-1。
3.2 药物样品抗CVB3病毒的作用
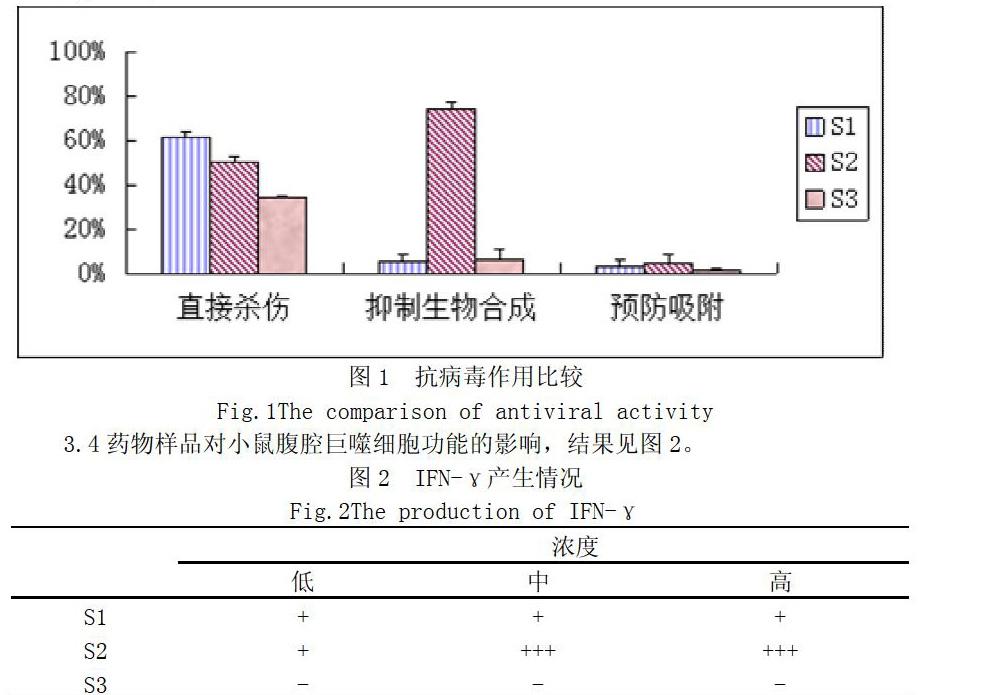
3.2.1药物样品抗病毒吸附组 两种药物样品与Hep-2细胞事先作用1.5h再接种病毒后72h内,都没有显现出对感染CVB3的细胞具有保护作用,各孔细胞均出现典型的病毒病变,即CPE症状:细胞生长紊乱,细胞状态发生变化,变圆或细长,颗粒增多,折光性增加,最后脱落死亡,说明CVB3在Hep-2细胞中的繁殖不受抑制,药物样品均无抗病毒吸附作用。
3.2.2 药物样品对病毒直接作用组 药物和病毒直接作用后再感染Hep-2细胞,结果显示S1、S2均有有一定的直接杀死作用。
3.2.3 药物样品抗病毒生物合成组 感染了CVB3病毒的Hep-2细胞药物样品进行处理,结果显示S2具有比较好的抗病毒生物合成的作用,S1没有该作用。
3.3药物对小鼠腹腔巨噬细胞毒性实验,不同浓度的药物作用于小鼠巨噬细胞24h后,用MTT法测定细胞活性。经过计算,得到S1TC50为2.7μg×ml-1,S2 TC50为3.0μg×ml-1,
3.4药物样品对小鼠腹腔巨噬细胞功能的影响,结果见图2。
4 讨论
本部分实验通过柯萨奇病毒感染的Hep-2细胞为体外实验细胞,发现三种不同提取方法获得的不同杠板归提取部位,对柯萨奇病毒具有不同的抗病毒效果,其中,S1样品的直接杀死作用较强,达到了61.6%,S2抑制病毒生物合成的作用较强,达到了73.4%,而S3基本没有作用。说明不同提取部位中所含成分不一样,这对我们今后研究杠板归药物的抗病毒活性部位的筛选提供了实验数据。
本实验第一部分已经进行了体外抗病毒实验,发现杠板归提取物具有一定的抗病毒作用,特别是S2样品,能显著抑制病毒在细胞内的生物合成,但是作用机理还不能确定,激活免疫细胞,提高机体的免疫能力,就是非常重要的一种抗病毒途径。
病毒感染机体以后,会激活机体的免疫系统产生应答,将病毒感染的细胞处理掉,机体免疫系统的激活,其实就是免疫细胞的激活,包括巨噬细胞、NK细胞,T细胞、B细胞等等。其中巨噬细胞起着非常重要的作用,他们吞噬病原体,激活T细胞,释放各种细胞因子。IFN-γ就是巨噬细胞释放的一种重要的细胞因子,发挥着重要的抗病毒作用。干扰素具有广谱的抗病毒活性(它对乙肝病毒DNA及丙肝病毒RNA的复制有一定抑制作用)、抗肿瘤活性及免疫调节作用,可治疗多种肿瘤病毒病,一般病毒病和若干肿瘤等疾病,并且在1982年,γ-干扰素已在E.COLI或者Saccharomyces cerevisiae(酿酒酵母)中表达成功。[12]
本实验第二部分,以小鼠腹腔巨噬细胞为研究对象,利用药物作用巨噬细胞一段时间后,测定巨噬细胞分泌的γ-干扰素的量是否有变化,以此来研究药物的抗病毒机理。本文通过药物影响巨噬细胞产生γ干扰素的模型,把杠板归抗病毒机理进行了初探,对于对于研究杠板归作用机理具有重要的意义。
参考文献
[1] 张荣林,孙晓翠,李文欣等.杠板归化学成分的分离与攀定[J].沈阳药科大学学报,2008,25(2):105-107.
[2] 瞿自明.徐方舟。兽医中草药大全[M].北京,中国农业科技出版社. 1996。396.
[3] 江苏新医学院.中药大辞典(上册)[M].上海:上海科学技术出版社,2000:869—871.
[4] 章永红.抗癌中药大全[M].江蘇南京:江苏科学技术出版社, 2000 :217.
[5] 扶亚祥,何湘容,李俊超等。扛板归化学成分分析及抗菌效果研究[J].动物医学进展,2008,29(9):45-49
[6] 李嫣,稀文谋。杠板归外敷加围针治疗带状疱疹[J]。海峡医学,1997,9(3):75
[7] 张长城,黄鹤飞,周志勇等。杠板归提取物抗单纯疱疹病毒-I型的药理作用研究[J].时珍国医国药2010年第21卷第11期。
[8] 谢董芳.苗药蛇倒退治疗复发性口腔溃疡14例疗效观察[J]。贵州医药,2008,32(1):63
[9] 隆万玉,李玉山.杠板归抗炎止咳作用的实验研究[J].临床合理用药杂志,2010年3卷18期
[10] 顾汉冲。杠板归水溶液止咳祛痰作用的实验研究[J].江苏中医1996年第17卷第4期
[11] 李冰.干扰素的作用方式和相关技术应用,跨世纪[J],2008年4月第16卷第4期,122-123
[12]周德庆。微生物学教程(第二版)[M],2002.5:335