卵泡膜细胞-纤维瘤伴囊变的MR影像学分型及相关因素分析
2019-10-18张思斯王媚媚李芸菲赵小虎
张思斯 王媚媚 刘 浩 李芸菲 赵小虎
卵泡膜细胞-纤维瘤是一类起源于卵巢性索间质的良性肿瘤,占卵巢肿瘤的4%[1]。组织学上肿瘤主要由卵泡膜细胞和成纤维细胞组成,病理学上精确分类困难,WHO将其称为卵泡膜细胞瘤-纤维瘤组肿瘤[2]。这类肿瘤大多含有纤维成分[3],MR典型表现为单发实性肿块,T1WI呈等信号,T2WI呈等或稍低信号,增强后无强化或轻度强化。囊变是其最常见的退行性改变[4],是引起误诊的重要因素之一。根据位置及形态对囊变进行分型,对该肿瘤的诊断及鉴别诊断具有重要意义。据研究报道将囊变分为瘤外囊变和瘤内囊变[5],我们在临床研究中发现个别病例表现为囊性肿块,因此本研究将囊性肿块纳入实性肿块伴囊变的分型中,扩展和补充了同类研究的不足,并进一步分析可能影响肿瘤囊变的临床及影像学相关因素,对该疾病的诊断和鉴别诊断具有重要意义。
方 法
1.临床资料
收集同济大学附属同济医院2015-2018年影像及临床资料完整,经手术切除病灶,经病理证实的38例卵泡膜纤维瘤。年龄22~92岁,平均年龄(51.53±14.7)岁,绝经患者 22 例(57.89%),未绝经16例(42.11%)。临床表现主要有腹胀腹痛(12例),绝经后阴道出血(2例),月经紊乱并经期延长(2例),无症状检查发现(22例)。实验室检查:CA125升高9例,CA199升高1例、CEA升高1例,AFP升高1例,HE4升高1例。
2.检查方法
采用Philips 3.0T超导型MRI系统,对盆腔三维定位后行MRI平扫及增强检查。扫描序列:TSE-T2WI(TRA/SAG):TR/TE 3500ms/80ms,层厚4mm,层间隔0.8mm;矩阵350×220(TRA)、220 ×220 (SAG);TSE-T1WI(TRA/SAG):TR/TE 600ms/14ms,层厚4mm,层间隔0.8mm,矩阵同TSE-T2WI;T1WI脂肪抑制序列(TRA):TR/TE 3500ms/80ms,层厚4mm,层间隔0.8mm,矩阵350×220。增强扫描:经肘静脉注射对比剂钆喷酸葡胺(Gd-DTPA) 0.1mmol/kg,注射流率为2.5 ml/s,静脉注药后25s开始扫描。扫描序列:TSET1WI (TRA/SAG) TR/TE 600ms/14ms,层厚4mm,层间隔0.8 mm,矩阵350×220(TRA)、220×220 (SAG)。
3.图像分析
由两位有经验的放射科医师分析影像资料,意见不同时共同讨论决定。主要评估以下几方面:①病灶定位及大小测量:在T2WI FSE序列矢状位图像上测量肿瘤最长径线,以最长径线为标准衡量肿瘤的大小;②病灶成分的判定和分类:本研究将囊变定义为圆形或椭圆形的T1低信号,T2高信号改变。根据是否伴囊变分为实性肿块及实性伴囊变肿块。根据囊变位于肿瘤外或肿瘤内分为瘤外囊变和瘤内囊变,后者细分为周围型、弥漫型及中央型囊变。瘤外囊变也称为外生型囊变,其囊变位于病灶实性成份外,与实性成分形成夹角;根据囊变位置不同,进一步将瘤内囊变分为周围型(囊变位于病灶周围)、中央型(囊变位于病灶中央)、弥漫型(囊变散在分布于肿瘤各部位)。示意图见图1。
4.病理学检测
所有患者均为手术切除病灶,行常规石蜡包埋切片、HE染色,显微镜下观察组织学形态,对其中的32例患者行免疫组化检查,包括Vimentin,Inhibin-α,Calretinin,CD99,Ki-67。
5.统计分析方法
采用SPSS20.0软件进行统计学分析,定量资料(年龄、肿瘤最大径)以均值±标准差表示,计数资料以百分比表示。将肿瘤分为实性和实性伴囊变肿瘤,用fisher确切概率法分析肿瘤大小、组织细胞学类型及CA125水平在两组间的差异,P<0.05具有统计学意义。
结 果
1.手术与病理结果
35例患者行经腹腔镜肿瘤切除术,3例患者行经腹肿瘤切除术,术中发现15例病灶位于右附件,23例病灶位于左附件,5例肿瘤出现扭转。肿瘤的最大径 1.0 ~ 21.3cm,均值为(6.65±4.70)cm。术中大体形态表现为圆形或卵圆形肿块,部分边缘呈分叶状,大部分肿块形态规则、表面光滑,4个病灶形态欠规则,与MRI表现基本一致。镜下可见纤维瘤主要由成纤维细胞及纤维细胞构成,纤维卵泡膜细胞瘤除了含有上述组织外,还含有数量不等的卵泡膜细胞,部分区域出现玻璃样变性或透明样变性。本组病理结果证实纤维瘤14例,卵泡膜细胞瘤13例,卵泡膜纤维瘤11例。
2.肿瘤囊变分型
在本研究收集的38例病灶中,囊性病灶4例(图2),实性伴囊变病灶12例,包括瘤外囊变2例(16.67%)(图3)及瘤内囊变10例(83.33%),后者分为周围型4例(33.33%)(图4),弥漫型5例(41.67%)(图5),中央型1例(8.33%)(图6)。病灶中囊变的数目不定,由一个到多个,体积大小与囊变数量不成正比;囊变的形态包括类圆形、斑点状、裂隙状,同一病灶中可出现不同形态的囊变。
3.肿瘤囊变的影响因素
在本研究收集的38例病灶中,实性肿瘤22例,实性伴囊变的肿瘤12例,囊性肿瘤4例,统计分析时将囊性肿瘤纳入实性伴囊变肿瘤中,结果显示在实性肿瘤和实性伴囊变肿瘤之间最大径具有显著差异,组织学类型及CA125是否升高无显著差异,≥6cm的肿瘤囊变率为68.8%(11/16),<6cm的肿囊变率为27.3%(6/22)。该结果表明肿瘤大小是影响肿瘤发生囊性变的重要因素,肿瘤越大越易囊变。统计分析结果见表1。

表1 肿瘤囊实性影响因素分析结果

图1 为囊性肿块和实性伴囊变肿块的四种分型示意图,从右到左依次为囊性肿块、瘤外囊变、周围型、中央型、弥漫型囊变。白色区域表示囊变,灰色区域表示实性成分。
4.肿瘤的MR信号特点
肿瘤为实性肿块时,MR信号特点为T1WI上呈等信号或稍低信号,T2WI抑脂序列呈等信号或稍高信号,增强后病灶无强化或轻度强化;肿瘤为实性伴囊变时,实性成分T1WI上呈等信号或稍低信号,T2WI抑脂序列呈等或稍高信号,囊性成分T1WI上呈低信号,T2WI抑脂序列呈高信号或混杂信号,增强后实性部分轻度强化,囊性部分无强化;肿瘤为囊性肿块时,T1WI上呈低信号,T2WI抑脂序列呈高信号,增强后囊性成分无强化,部分病灶囊壁及间隔强化。
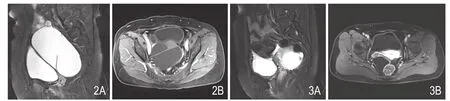
图2 A、B.分别为矢状位T2WI脂肪抑制序列、横断位T1WI增强序列。病灶呈囊性肿块,边缘可见壁结节,囊性成分T2WI脂肪抑制序列呈高信号,T1WI呈低信号,增强后无强化,间隔及囊壁轻度强化;壁结节T1WI呈等信号,T2WI呈低信号,轻度强化。图3 A、B.分别为矢状位T2WI脂肪抑制序列及横断位T1WI增强序列。病灶呈囊实性肿块,囊变类型为外生型;实性成分T2WI脂肪抑制序列呈稍高信号,T1WI呈等信号,增强后轻度强化;囊性成分T2WI脂肪抑制序列呈高信号,T1WI呈低信号,增强后无强化。
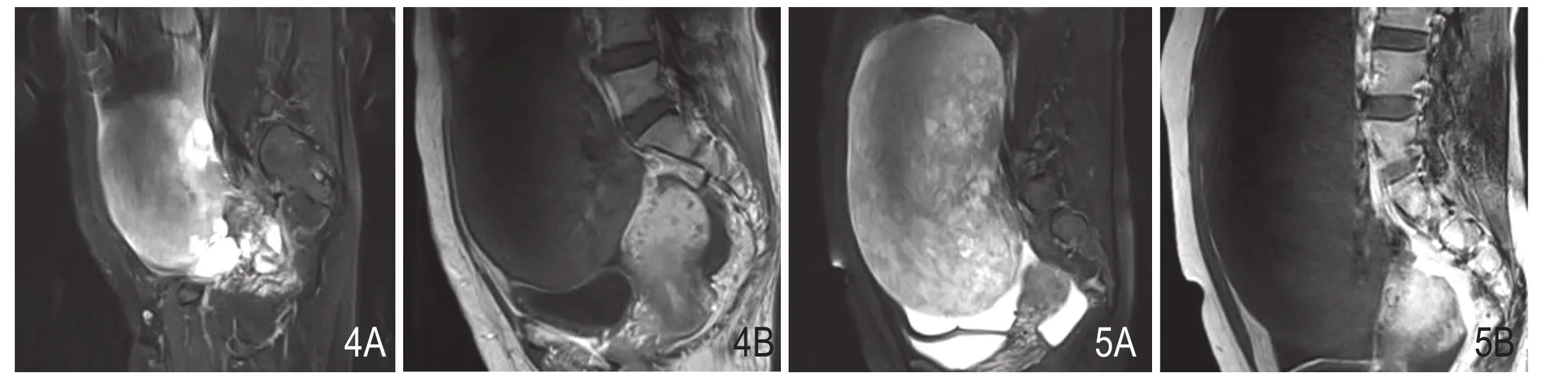
图4 A、B.4分别为矢状位T2WI脂肪抑制序列及T1WI增强序列。病灶呈实性肿块伴囊变,囊变类型为周围型;实性成分T2WI脂肪抑制序列呈稍高信号,T1WI呈等信号,增强后无强化;囊性成分T2WI脂肪抑制序列呈高信号,T1WI呈低信号,增强后无强化,囊壁轻度强化。图5 A、B.分别为矢状位T2WI脂肪抑制序列及T1WI增强序列。病灶呈实性肿块伴多发散在囊变,囊变类型为弥漫型;T2WI脂肪抑制序列病灶呈稍高信号,内见斑片状高信号囊变,T1WI病灶呈等-低信号,增强后无强化。
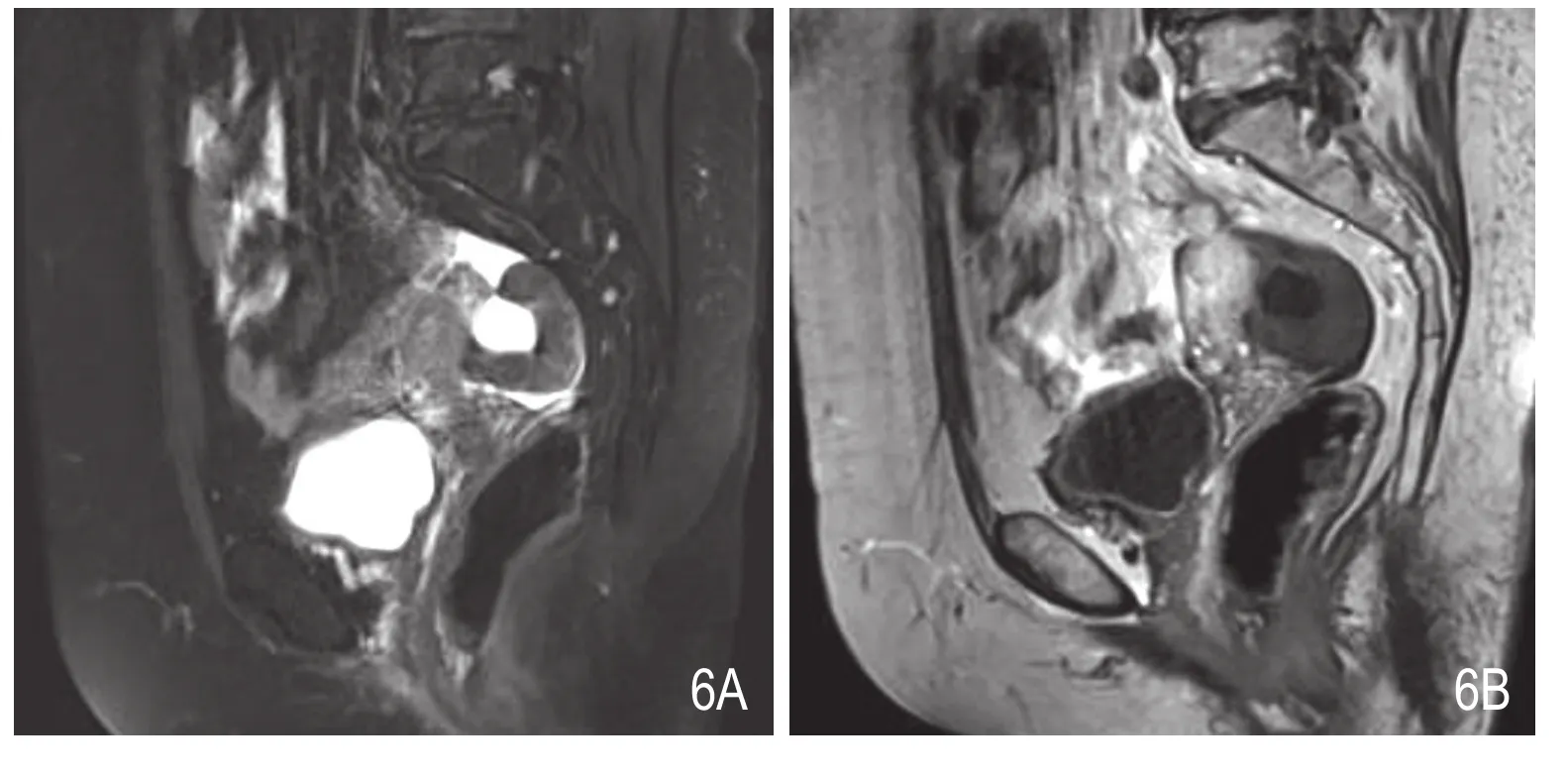
图6 A、B.分别为矢状位T2WI脂肪抑制序列及T1WI增强序列。病灶呈囊实性肿块,囊变类型为中央型;实性成分T2WI脂肪抑制序列呈等信号,T1WI呈等信号,增强后轻度强化;囊性成分T2WI脂肪抑制序列呈高信号,T1WI呈低信号,增强后无强化。
讨 论
1.卵泡膜细胞-纤维瘤的病理及临床特点
卵巢卵泡膜细胞-纤维瘤是一组起源于卵巢性索间质的肿瘤,占卵巢肿瘤的4%[1],占性索间质肿瘤的76.5%,该肿瘤大多数为良性,恶性罕见[6]。该肿瘤好发于老年女性,围绝经期及绝经后女性多见[7]。肿瘤多为单发,单侧卵巢发生多见,双侧罕见。本研究38例肿瘤均为单侧,肿瘤一般边界清楚,有包膜。其中6例边界欠清,可能与肿瘤较大发生扭转、渗出等有关。此类肿瘤常表现为腹痛、腹胀,肿瘤较大时出现腹部包块。据报道,卵泡膜细胞是位于卵巢髓质中的内分泌细胞[8],卵泡膜细胞分泌激素被认为是雌激素活性存在的原因。因此,患者可出现阴道不规则流血、月经紊乱、绝经后阴道流血等症状。此外,患者常伴有不同程度的腹水,大多数为少量或微量腹水,大量腹水少见,当同时出现胸腔积液时,称为Meig综合征,有文献报道其发生率为1%~3%[9]。患者同时伴有腹水及CA125升高时,易误诊为卵巢恶性肿瘤,因此需要结合临床及影像特征共同诊断。
2.影响肿瘤囊变的相关因素探讨
卵泡膜细胞-纤维瘤易继发退行性改变,如囊变、水肿、黏液样变性、出血坏死等,其中囊变最为常见[4],肿瘤可表现为囊实性或囊性肿块。先前的文献报道囊变率为76%(19/25)[10],本组肿瘤的囊变率为42.1%(16/38),较以往报道的囊变率低,导致结果不一致的原因可能与样本量不同有关,在以后的研究中可进一步扩大样本量,以得到更为可靠的囊变率。有研究提出[11],在直径≥6cm的肿瘤更可能显示为囊性或囊实性肿块,本研究经统计分析得出肿瘤大小是影响肿瘤囊变的重要因素,肿瘤越大越易囊变,本研究≥6cm的肿瘤囊变率高于<6cm的肿瘤,与文献报道一致。此外,本组病例统计分析得出肿瘤的组织学类型及CA125是否升高在实性肿瘤和囊变肿瘤之间无显著差异,因此我们推测,肿瘤指标CA125升高、肿瘤含有不同比例的纤维成分和卵泡膜细胞成分与肿瘤是否囊变不存在确切关系。
3.卵泡膜细胞-纤维瘤伴囊变的分型及MR影像学特征
卵泡膜细胞-纤维瘤的MR信号特点与其病理基础密切相关,纤维成分的存在是肿瘤实性部分表现为低信号的主要原因,常见的MR典型特征为T1WI及T2WI呈等信号或稍低信号。卵泡膜细胞-纤维瘤易继发退行性变,如囊变、水肿、黏液样变性、坏死等[12],当肿瘤发生囊变时,肿瘤表现为不典型的MR影像特征,术前诊断时易误诊为恶性肿瘤。本组有4例误诊为卵巢恶性肿瘤,3例误诊为囊腺瘤。因此,认识卵泡膜细胞-纤维瘤伴囊变的分型及MR影像表现尤为重要。
根据肿瘤囊变程度不同分为实性、囊实性及囊性肿块,囊实性肿块根据囊变是否位于肿瘤内分为瘤内囊变和瘤外囊变,根据囊变位置不同,将瘤内囊变分为周围型、中央型及弥漫型。囊变的数目不定,由一个到多个,体积大小与囊变数量不成正比;囊变的形态包括类圆形、斑点状、裂隙状,同一病灶中可出现不同形态的囊变。瘤外囊变较少见,并且与其他卵巢恶性肿瘤的囊实性肿块不同,瘤外囊变较大且位于实性成分之外,实性成分强化不明显。Kato等[5]提出周围型囊肿形成是卵巢卵泡膜细胞-纤维瘤的MR影像特征,本组肿瘤周围型及弥漫型囊肿较多见,与文献报道一致。此外,本研究认为瘤外囊变也是卵泡膜细胞-纤维瘤的MR影像特征。我们推测,肿瘤外周部分更易囊变是由于肿瘤周围供血不足,更易缺血所导致。我们发现4例囊性肿块并非均由囊变导致,其中一例较大的囊性肿块伴有小壁结节,部分较小的囊性肿块可能是肿瘤本身就为囊性,在未来的研究中可对表现为囊性的卵泡膜细胞纤维瘤做进一步研究。
卵泡膜细胞-纤维瘤伴囊变时实性成分T1WI呈等信号或稍低信号,T2WI抑脂序列呈等或稍高信号,囊性成分T1WI呈低信号,T2WI抑脂序列呈高信号或混杂信号,增强后实性部分轻度强化,4例囊性肿块在T1WI呈低信号,T2WI抑脂序列呈高信号,增强后囊性成分无强化,部分病灶囊壁及间隔强化,其中一例伴有小壁结节,T1WI呈等信号,T2WI呈低信号,轻度强化。有研究提出[3],肿瘤卵泡膜细胞成分较多时,T2WI呈稍高信号,本组4例卵泡膜细胞瘤及卵泡膜纤维瘤在T2WI呈稍高信号,纤维瘤T2WI未见稍高信号,与文献报道一致。增强扫描,卵泡膜细胞瘤-纤维瘤呈乏血供肿瘤的表现,一般为轻度强化或无强化,少数中度强化,部分呈延迟强化。其强化特点可能与肿瘤本身乏血供,且内部成分较为密实造影剂不易渗透有关[13]。卵泡膜细胞较纤维成分血供丰富,两者的比例不同可能是引起早期不同程度强化的原因[8],延迟强化则可能与纤维成分的强化延迟及水肿区开始强化有关[14]。本组肿瘤50%(19/38)呈轻度强化,34.2%(13/38)无强化,15.8%(6/18)呈中度强化,与文献报道一致。
4.本研究的局限性
本研究存在一些不足之处,作为一项回顾性研究,无法在外科手术切除前或切除中获得更多信息。其次,卵泡膜细胞-纤维瘤较为少见,因此研究样本量相对较小,未来的研究可以进一步收集总结病例资料,扩大样本量来增加研究结论的可靠性。但是,结合相关文献报道,我们认为囊实性卵泡膜细胞瘤-纤维瘤的外生型囊肿及周围型囊肿形成也具有一定特征。
综上所述,卵巢卵泡膜细胞-纤维瘤为性索间质来源肿瘤,肿瘤常见的影像表现为单发的实性肿块,T1WI及T2WI呈等-低信号,增强呈轻度强化或无强化。当肿瘤发生囊变时表现为囊实性或囊性肿,肿瘤的大小是影响肿瘤囊变的重要因素,直径越大的肿瘤越易囊变。根据囊变位置分为瘤内囊变和瘤外囊变,瘤内囊变包括周围型、中央型及弥漫型,其中周围型及弥漫型囊变较多见,外生型囊肿及周围型囊变具有一定特征性。本研究对卵泡膜细胞-纤维瘤伴囊变的MR影像表现进行分析,根据囊变位置不同进行分型,探讨影响囊变的因素,以提高对卵泡膜细胞-纤维瘤的认识及术前诊断准确率。
