计划性再手术在严重腹腔感染患者救治中的地位
2019-10-17杨学武田伟军
杨学武,田伟军
(天津医科大学总医院普通外科,天津300052)
腹部手术患者术后出现消化道瘘,极易继发严重腹腔感染,死亡率极高,有效控制瘘出量和感染程度是避免患者术后死亡的关键[1]。计划性再手术清理腹腔感染灶,术中瘘口及感染灶周围放置双套管,术后给予生理盐水持续冲洗负压吸引,减少毒素吸收,促进瘘口愈合,降低全身炎症反应程度。部分患者应用一次性封闭负压引流材料(VSD)行暂时性腹腔关闭,维持腹膜腔封闭性、完整性,大大降低了患者腹膜腔压力,促进胃肠功能恢复,应用术中所放置的空肠营养管给予肠内营养,保证充足的热量供给。我院普通外科于2015年9月-2018年11月对16例严重腹腔感染的危重症患者进行了计划性再手术,显著降低了死亡率。
1 资料与方法
1.1 一般资料 回顾分析2015年9月-2018年11月天津医科大学总医院普通外科腹部手术后出现消化道瘘(肠瘘、胆瘘、胰瘘)继发严重腹腔感染的16例患者,其中男性11例,女性5例,平均年龄(54.2±16.9)岁,其中 8例肠瘘、4例胆瘘、2例胰瘘、2例多源瘘并存,13例行2次手术,3例行多于2次手术并应用VSD暂关腹技术,平均住院时间(50.1±21.8)d,双套管持续冲洗(17.9±9.9)d,应用肠内营养共14例,开始时间(2.0±1.3)d。
1.2 制作方法
1.2.1 双套管制作方法 本文所用的双套管均自制,外套管用的是医用乳胶引流管作为外管,用一次性吸痰管作为内管,在外管距离管端2 cm处打孔,插入内管,前端平齐,外管前端打孔2~3处。内管冲洗出生理盐水,稀释消化道瘘出液及坏死组织,外管接负压持续吸引,外管与内管之间要有足够空间,0.2~0.3 cm间距,以利于坏死组织及液体吸出,该双管套可在严格无菌操作要求下现做现用,也可以用环氧乙烷消毒后备用。制作成品见图1。

图1 双套管Fig 1 Double cannula
1.2.2 双套管使用方法 手术当日即开始使用双套管。原则是持续冲洗,保证引流管通畅引流。冲洗量平均约为3 000 mL/d。冲洗液使用无菌生理盐水,无需加入抗生素[3],持续低负压吸引,负压值维持在10~20 KPa(约 75~150 mmHg)较为适宜[4]。根据引流的具体情况随时调整冲洗速度,必要时可在超声引导下调整管路深度。
1.3 实际操作
1.3.1 VSD暂关腹技术 多次手术腹腔清理患者使用VSD暂关腹技术,切口下方使用纱布垫保护胃肠道,外敷一次性封闭负压引流材料(VSD),常用材料为黑色聚氨酯泡沫海绵,单片规格为15cm×10cm,修剪处理成伤口面积的80%,间断缝合固定覆盖伤口,以无菌3M膜封闭,生理盐水持续冲洗,封闭负压吸引,计划性手术清理更换VSD,每周1~2次[5]。本文多次手术患者最多手术次数为18次。VSD暂关腹术后见图2。

图2 VSD暂关腹术后Fig 2 Postoperation of VSD temporary abdominal closure
1.3.2 根据腹腔感染引流液培养结果选用敏感抗生素。并给于奥曲肽或生长抑素等减少消化液分泌配合治疗。
1.3.3 观察指标 每次术前术后24 h内均测定血常规、血气分析、肾功能、生化等血化验指标,监测生命体征变化,如体温、心率、平均动脉压等,并进行APACHE II评分。
1.4 统计学分析 采用Graphpad prism 7.0软件进行统计分析。术前、术后数据对比采用配对t检验。P<0.05认为具有统计学意义。
2 结果
2.1 术前、术后APACHE II评分对比 如图3所示,APACHE II评分术后(5.5±4.3)较术前(9.1±4.5)显著下降,差异具有统计学意义(P<0.01)。
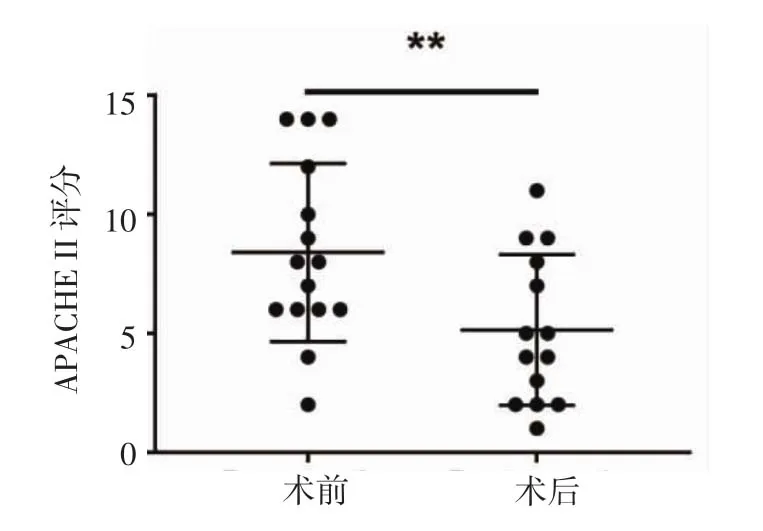
图3 16例患者术前、术后急性生理学及慢性健康状况评分对比Fig 3 Comparison of acute physiology and chronic health scores of 16 patients before and after operation
2.2 术前、术后最高体温对比 如图4所示,术后最高体温(36.9±0.36)℃较术前最高体温(38.4±0.42)℃显著下降,差异具有统计学意义(P<0.01)。

图4 术前、术后最高体温对比Fig 4 Comparison of the highest body temperature before and after operation
2.3 术前术后血常规白细胞数对比 如图5所示,监测血常规白细胞指标术后[(10.4±4.9)×109/L]较术前[(14.8±6.0)×109/L]显著下降,差异具有统计学意义(P<0.01)。
2.4 是否应用VSD暂关腹技术患者术前、术后APACHE II评分对比 本研究中应用VSD暂关腹技术患者(4例),术后 APACHE II评分(6.3±2.6)较术前(9.5±4.1)下降(P<0.05),差异具有统计学意义。相同治疗方法未应用VSD暂关腹技术患者(12例)术后 APACHE II评分(5.3±4.8)较术前(8.9± 4.8)下降,差异均具有统计学意义(P<0.05),见图6。
2.5 不同类型消化道瘘患者术前术后APACHE II评分对比 胆瘘患者术后APACHEII评分(6.0±4.9)较术前(9.0±6.0)下降,肠瘘患者术后评分(3.6±2.0)较术前(7.5±1.5)下降,二者差异具有统计学意义(P<0.05)。胰瘘患者术后评分(12.5±4.5)较术前(16.5±3.5)下降,多源瘘患者术后评分(5.0±4.2)较术前(8.0±5.7)下降,二者差异不具有统计学意义(P>0.05),见图7。
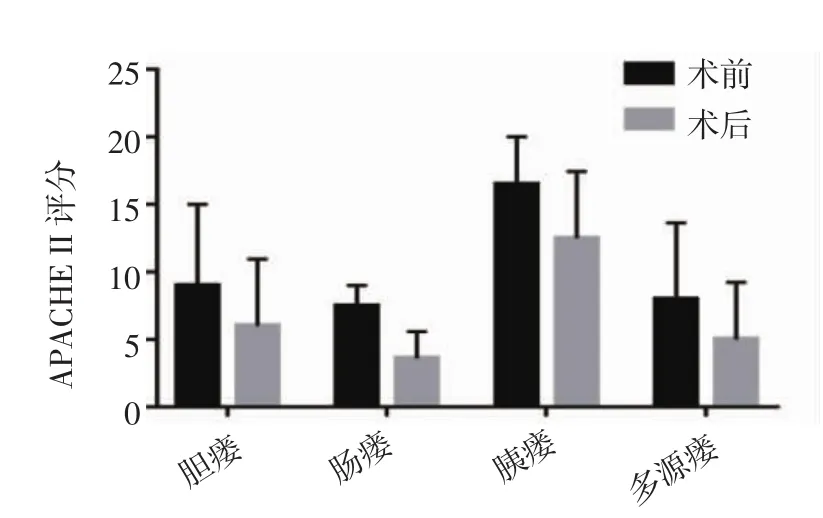
图7 不同类型疾病术前、术后APACHE II评分对比Fig 7 Comparison of APACHE II scores before and after operation for different diseases
全组患者通过计划性再手术,术后腹腔感染均逐渐控制,(APACHEⅡ)评分系统中年龄、慢性健康状况术前术后对比无显著变化,差异主要体现在手术前后急性生理学评分(APS)的变化上,而APS中最主要表现在血常规WBC及体温的变化。通过对比,其差异具有统计学意义(P<0.01)。同时,计划性再手术治疗方法对于是否应用VSD技术均有效(P<0.05)。16例患者中,1例患者因肝破裂术后多脏器功能衰竭死亡,余15例患者均腹腔感染消退,瘘口愈合,好转出院。相关文献报道,包括C级胰瘘在内的消化道瘘合并严重腹腔感染死亡率高达25%~33%[6-7,30],本组死亡率为6.3%,病死率显著下降。
3 讨论
腹部手术后出现的消化道瘘绝大部分为吻合口瘘,部分患者可同时出现多种类型消化道瘘,其危害主要在于消化液对腹腔组织的腐蚀导致局部感染和继发出血,不可控制的腹腔感染是导致患者死亡的主要原因[8]。原有的腹腔被动引流管术后很快被脓血块、脱落坏死组织或纤维素阻塞,不能有效引流感染坏死组织及液体[9]。腹腔感染持续加重,出现感染性休克、多脏器功能衰竭,最终可导致患者死亡。所以,早期彻底的腹腔清理冲洗和充分有效的腹腔引流是控制腹腔感染和促进瘘口愈合的关键[2]。
计划性再手术最核心的一点就是计划性,即根据病情,可以时间为计划,可以病情需求为计划,一般情况下24~48 h进行一次,最长不超过72 h,避免腹腔感染加重再次损害机体,在毒素尚未形成更大的危害的时候及时清理。赵允召等[10]认为计划性再手术的优势在于:对于血液动力学不稳定的腹腔严重感染患者,进行有效、快速、微创、计划性的多次手术清理腹腔感染灶,对于防止全身感染持续加重,出现多脏衰竭,效果显著,明显降低了病死率。纳入本研究16例患者,均存在严重腹腔感染,伴有消化道液持续漏出,单纯通过被动引流管及影像学引导的穿刺置管冲洗,已不能满足清除腹腔感染的需要。姜朝晖等[11]对46例消化道瘘患者分期手术治疗进行分析,认为早期再手术治疗的益处是:腹腔感染尚局限,消化道液对组织的腐蚀较轻,周围组织间的粘连易于分离,瘘口组织较新鲜,及时中止因瘘发生对患者全身情况的再次打击,全身内环境紊乱尚处于可调控范畴等。因此,在患者全身状况允许的前提下计划性的再手术,及时清理腹腔感染灶,冲洗腹腔各间隙,可更有效、更快速地缓解腹腔感染,最大程度地减少毒素吸收、稳定血液动力学指标。
黎介寿等[12]认为“有明显腹腔感染时不进行肠切除吻合或缝合”。而计划性再手术的主要目的并不是要修补消化道瘘口,而是要在瘘口周围的腹腔间隙建立有效、确定、充分的引流机制,清理瘘口周围渗漏积聚的胆汁、肠液、胰液、脓血块等,减少机体吸收腹腔感染灶产生的炎症因子及毒素,降低消化液对周围脏器组织的进一步腐蚀损害[13-14]。但瘘口局部条件允许的情况下可适当缝合暂时性的封闭瘘口,减少短期内的消化液瘘出量,争取术后控制感染、改善全身状况的宝贵时间窗。本研究中有3例患者因其高腹压、感染重、腹腔脏器严重水肿,强行关腹势必造成腹膜腔压力急剧上升,出现腹腔间隔室综合征。因而采用了一次性封闭负压引流材料(VSD)辅助的暂时性腹腔关闭(TAC)。计划性的手术清理腹腔感染灶,并更换VSD关腹材料。Navsaria等[15]与Bertelsen等[16]共报道121例VSD材料辅助完成TAC,认为该技术安全有效。VSD具有多重优势:(1)高效的引流促进感染的控制;(2)延展腹壁面积,有效保持腹腔封闭性;(3)减轻消化液对组织的腐蚀[17-20],腹腔感染控制、组织水肿消退后,每次更换VSD材料时逐渐缩小使用面积、长(每次1~3cm)、宽(每次3~5cm),最后当材料宽度缩小至5cm以内时,腹压<12 mmHg可直接关腹,若>12 mmHg或腹壁缺损,继续治疗至伤口合拢,再植皮封闭创面形成人工疝,6~12月再行腹壁确定性重建[5,21]。
计划性再手术的第二个目的即清理腹腔感染灶后在瘘口周围放置1~2根双套管,双套管旁留置多孔乳胶引流管一根伴随,术后持续由内管滴入生理盐水,外管开放的负压吸引能将感染腔隙中的细菌分泌物及消化液漏出物及时吸出,降低腔隙中的细菌量,减轻局部炎症反应,促进瘘口的新生血管生成和肉芽组织的形成[22-23]。经临床验证,当腹腔引流液达150 mg/kg时,细菌量由108/mL降至102/mL[24]。总之,持续双套管冲洗负压引流的特点是变以往的被动引流为主动吸引,可及时、彻底地排出脓腔积液及坏死组织,使创面及脓腔保持高效引流,一般使用3~5 d后,冲洗液中絮状物明显减少,转为清亮,感染控制后可采用间断冲洗及低负压吸引,引流量下降至<20 mL/d后,逐步往外退出双套管,窦道自然愈合。
再手术的第3个目的即留置空肠营养管。“肠道有功能且能安全使用时就应使用肠道”已经成为目前公认的营养支持治疗的原则,只要腹膜腔压力降低、肠蠕动恢复,应尽早试行肠内营养,这样有利于减少肠漏等消化道瘘的进一步加重,并促进瘘口的愈合[25-26]。本文所研究患者均为腹腔重大手术后创伤应激、肿瘤消耗,机体处于高度分解代谢状态,营养状况差。充足、合理的营养支持可使机体从分解代谢转为合成代谢状态,促进组织器官修复,改善临床结局,尤其在重症感染情况下,营养治疗尤为关键[27-28]。研究[29-30]表明长期肠外营养PN可导致肠黏膜功能及肠内生态异常并损伤免疫功能,肠内营养EN的众多优点可弥补PN的不足之处,只有当其无法满足机体需要时(<60%机体需要量)应考虑结合PN,可EN+PN联合供能。此外,EN在促进胃肠道供能恢复和缩短住院时间方面有显著效果[31]。本文除2例小肠第4组肠瘘患者给予肠内营养后漏出液增多,停用EN改以PN供能,其余高位或低位肠瘘及其他类型消化道瘘均主要依靠肠内营养,营养支持效果满意。
综上所述,对于消化道瘘伴腹腔感染的危重症患者,计划性再手术清理腹腔感染灶,可在最短的时间力挽狂澜,避免患者腹腔感染急剧加重出现脓毒血症、感染性休克、多重感染等感染不可控的情况,挽救患者进入多脏器功能不全,甚至衰竭、死亡的结局。再配合双套管持续负压冲洗吸引、VSD暂关腹技术、肠内营养支持等方法,可以显著降低死亡率,因此证实计划性再手术疗法对于腹腔感染的危重症患者切实有效。
