PPI联合FOLFOX方案在结肠癌术后化疗中对肠道黏膜屏障功能及生存质量的影响
2019-10-17张明惠杨丹丹姚光琳
张明惠,杨丹丹,姚光琳
(河南省直第三人民医院内科,郑州450000)
流行病学研究证实,结肠癌的发病率明显上升,可达(274~593)/10 万人[1]。临床上,结肠癌导致患者总体生存时间缩短,影响患者的3年及5年生存率[2]。手术治疗仍然是结直肠癌的主要治疗方式,术后联合静脉化疗,能够促进癌细胞的凋亡,抑制癌细胞的复发和转移[3]。奥沙利铂+亚叶酸钙+氟尿嘧啶(FOLFOX方案)是临床上应用较为广泛的静脉化疗方案,其能够显著改善患者术后高肿瘤负荷表现,改善患者的术后生存质量[4-5]。长期的临床随访观察研究发现,单纯FOLFOX方案化疗的临床效果仍然较为局限,其耐药的发生率仍然较高,患者体内的肠道黏膜损伤表现仍然较为明显[6]。质子泵抑制剂(proton pump inhibitor,PPI)能够通过对于肠道黏膜上皮细胞H+转运体的调控,稳定细胞膜内外的酸性环境,进而提高静脉化疗药物治疗的敏感性,提高FOLFOX方案的化疗效果[7]。部分研究者探讨了PPI联合FOLFOX方案治疗结肠癌术后患者的临床效果,认为PPI的联合治疗能够提高疾病的近期治疗有效率[8],但对于肠道黏膜屏障的改善作用研究不足。为了指导临床上结肠癌患者的术后化疗,本研究选取我院2015年3月-2017年3月收集的110例结肠癌患者,探讨了PPI联合FOLFOX方案治疗的临床效果,报道如下。
1 资料与方法
1.1 临床资料 选取我院2015年3月-2017年3月收集的110例结肠癌患者,所有患者均接受结肠癌根治手术,其中55例术后接受FOLFOX方案化疗(对照组),另外55例患者术后采用奥美拉唑联合FOLFOX方案治疗(观察组)。对照组,年龄34~72岁,平均(48.6±12.7)岁,男 32例、女 23例,TNM 分期:Ⅱ期25例,Ⅲ期30例;肿瘤分化程度:高分化18例,中分化26例,低分化11例;肿瘤位置:右半结肠35例,左半结肠20例。观察组,年龄32~75岁,平均(50.1±11.9)岁,男 35例、女 20例,TNM 分期:Ⅱ期21例、Ⅲ期34例;肿瘤分化程度:高分化15例,中分化29例,低分化11例;肿瘤位置:右半结肠31例,左半结肠24例。两组患者年龄、性别、TNM分期、肿瘤分化程度、肿瘤位置比较,差异无统计学意义(P>0.05)。
纳入标准:结肠癌患者的诊断标准参考《外科学》人民卫生出版社第8版中的标准;所有患者的诊断均以病理学结果作为标准;纳入研究对象的年龄19~75岁;在我院接受结肠癌根治手术治疗;符合2010年国际抗癌联盟/美国癌症联合委员会(UICC/AJCC)中TNM分期标准[4],属于Ⅱ~Ⅲ期的患者;KPS评分≥70分;有完整的随访资料;本研究获得研究对象的知情同意、医学伦理委员会的批准。
排除标准:转移性结肠癌;肝肾功能疾病;免疫系统疾病;血液系统疾病;对化疗方案严重不耐受,化疗周期不足2个周期。
1.2 治疗方法 对照组:采用FOLFOX方案治疗,奥沙利铂(国药准字H20064296厂家:江苏奥赛康药业股份有限公司),85 mg/m2,静脉滴注,亚叶酸钙(批号100252-201204湖州展望药业公司),400mg/m2,静脉滴注,氟尿嘧啶(批号:020802辰欣药业股份有限)400 mg/m2,静脉滴注,连续治疗21 d为一个疗程,连续化疗6~8个疗程。观察组在采用FOLFOX方案化疗的同时,联合奥美拉唑(国药准字H20174090海南海力制药有限公司),40 mg,静脉滴注,每日3次,化疗前24 h内使用。观察组FOLFOX方案连续治疗21 d为一个疗程,连续化疗6~8个疗程。
1.3 生存质量评价 生存质量评估采用欧洲癌症研究与治疗组织生命质量核心量表(EORTC-QLQC30)第3版[6],该量表主要包括5个功能量表:躯体功能、认知功能、角色功能、情绪功能、社会功能,3个症状子量表:乏力、疼痛、恶心/呕吐,6个单项测量项目和一个整体性生存质量评估项目,连续化疗6个周期进行生存质量的评估。
1.4 检测方法 采集入院后(或者化疗药物使用后24~48 h内)静脉血,1 000 r/min离心 5 min,离心半径10 cm,离心后收集上清液,采用紫外线分光光度法检测血乳酸值及DAO水平,采用高效液相色谱法检测乳果糖/甘露醇(L/M)值,配套试剂盒购自南京碧云天生物检测公司,微型离心机HITETIC购自上海精密仪器有限公司。
2 结果
2.1 两组患者化疗前后的肠道屏障功能指标对比 治疗前,观察组和对照组的血清DAO、血乳酸、L/M水平差异无统计学意义(P>0.05);治疗后,观察组患者的血清DAO、血乳酸、L/M水平均低于对照组(P<0.05),两组患者治疗后的血清DAO、血乳酸、L/M水平较治疗前均显著的升高(P<0.05),见表1。
2.2 两组患者化疗前后的生存质量对比 治疗前,观察组和对照组的各维度生存质量评分差异无统计学意义(P>0.05);治疗后,观察组患者的躯体功能、角色功能、认知功能、社会功能、整体生活质量评分均高于对照组(P<0.05),观察组的疲乏、恶心/呕吐、呼吸困难、失眠、食欲丧失、腹泻评分低于对照组(P<0.05),见表 2。
2.3 两组患者化疗毒副反应发生率比较 观察组患者的腹泻、恶心/呕吐发生率显著的低于对照组(P<0.05),两组患者的脱发、骨髓抑制、肝肾损害发生率差异不具有统计学意义(P>0.05),见表3。
表1 两组患者化疗前后的肠道屏障功能指标对比(±s)Tab 1 Comparison of intestinal barrier function indexes between two groups of patients before and after chemotherapy(±s)
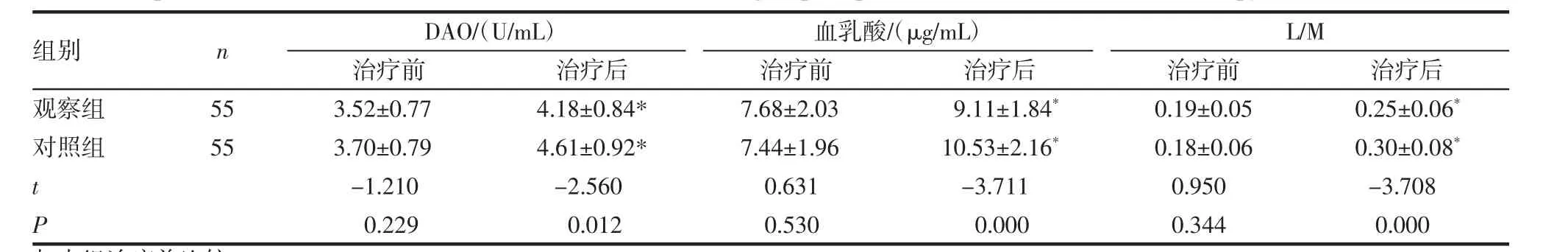
表1 两组患者化疗前后的肠道屏障功能指标对比(±s)Tab 1 Comparison of intestinal barrier function indexes between two groups of patients before and after chemotherapy(±s)
与本组治疗前比较*P<0.05
组别nDAO/(U/mL)血乳酸/(μg/mL)L/M治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组 55 3.52±0.77 4.18±0.84* 7.68±2.03 9.11±1.84* 0.19±0.05 0.25±0.06*对照组 55 3.70±0.79 4.61±0.92* 7.44±1.96 10.53±2.16* 0.18±0.06 0.30±0.08*t-1.210 -2.560 0.631 -3.711 0.950 -3.708 P 0.229 0.012 0.530 0.000 0.344 0.000
表2 两组患者化疗前后的生存质量对比(±s,分)Tab 2 Comparison of guality of life between the two groups before and after chemotherapy(±s,score)
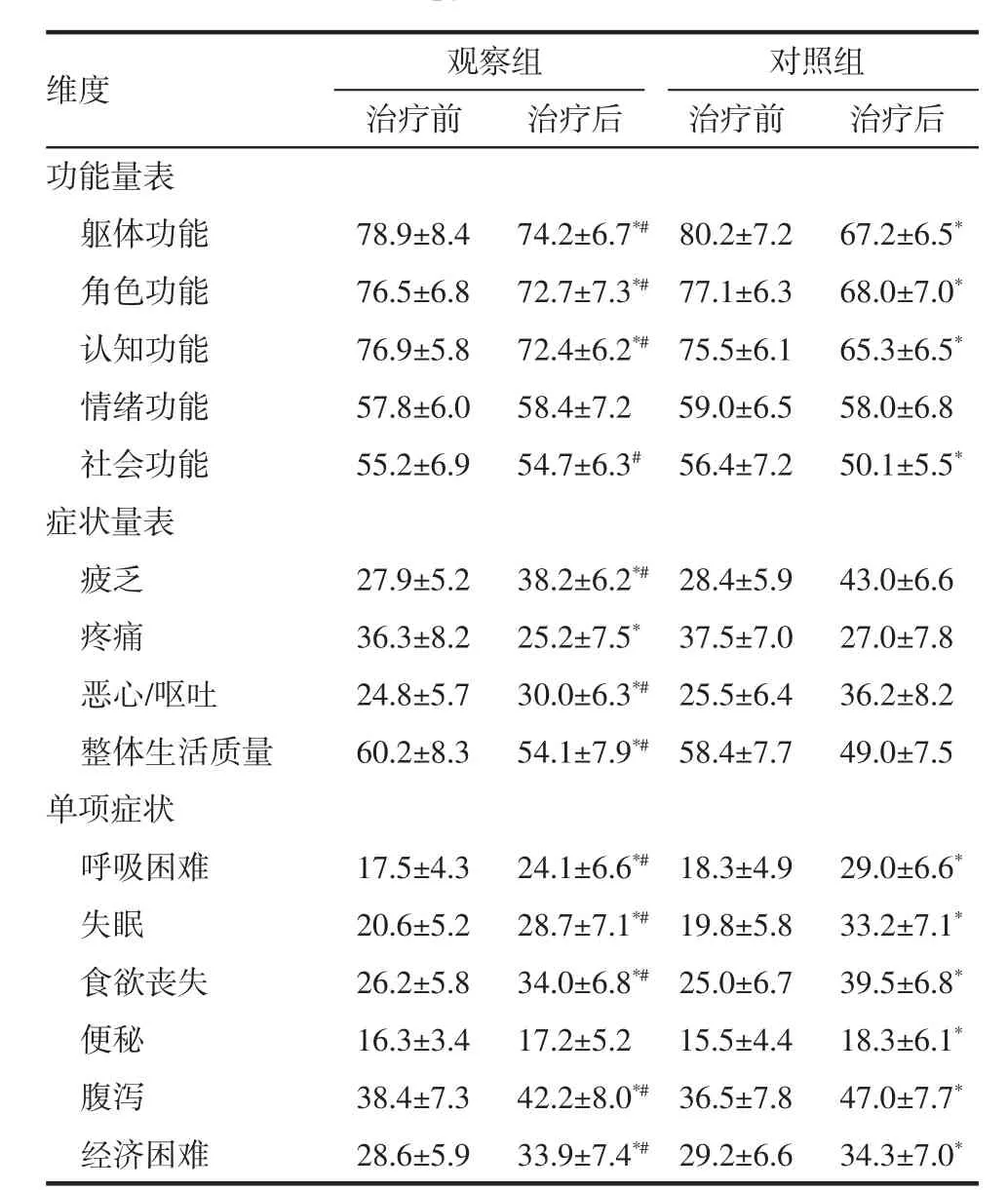
表2 两组患者化疗前后的生存质量对比(±s,分)Tab 2 Comparison of guality of life between the two groups before and after chemotherapy(±s,score)
与本组治疗前比较*P<0.05,与对照组比较#P<0.05
维度 观察组 对照组治疗前 治疗后 治疗前 治疗后功能量表躯体功能 78.9±8.4 74.2±6.7*#80.2±7.2 67.2±6.5*角色功能 76.5±6.8 72.7±7.3*#77.1±6.3 68.0±7.0*认知功能 76.9±5.8 72.4±6.2*#75.5±6.1 65.3±6.5*情绪功能 57.8±6.0 58.4±7.2 59.0±6.5 58.0±6.8社会功能 55.2±6.9 54.7±6.3# 56.4±7.2 50.1±5.5*症状量表疲乏 27.9±5.2 38.2±6.2*#28.4±5.9 43.0±6.6疼痛 36.3±8.2 25.2±7.5* 37.5±7.0 27.0±7.8恶心/呕吐 24.8±5.7 30.0±6.3*#25.5±6.4 36.2±8.2整体生活质量 60.2±8.3 54.1±7.9*#58.4±7.7 49.0±7.5单项症状呼吸困难 17.5±4.3 24.1±6.6*# 18.3±4.9 29.0±6.6*失眠 20.6±5.2 28.7±7.1*# 19.8±5.8 33.2±7.1*食欲丧失 26.2±5.8 34.0±6.8*# 25.0±6.7 39.5±6.8*便秘 16.3±3.4 17.2±5.2 15.5±4.4 18.3±6.1*腹泻 38.4±7.3 42.2±8.0*# 36.5±7.8 47.0±7.7*经济困难 28.6±5.9 33.9±7.4*# 29.2±6.6 34.3±7.0*
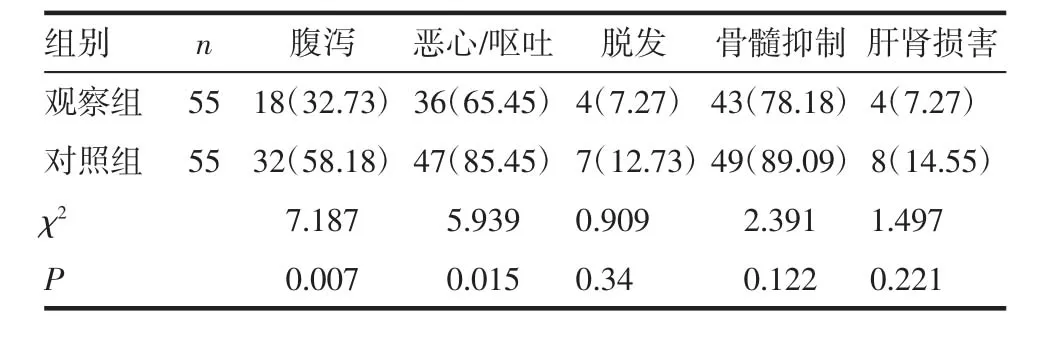
表3 两组患者化疗毒副反应发生率比较[n(%)]Tab 3 Comparison of the incidence of chemotherapy side effects in the two groups[n(%)]
3 讨论
不良的饮食习惯或遗传性肠道息肉病变,均能够促进肠道恶性肿瘤的发生,特别是在合并相关结直肠癌家族史的患者中,其发病率具有进一步的上升趋势[9]。根治性手术治疗能够通过切除原发肿瘤病灶和可疑的转移病灶,进而改善患者的生存预后。而FOLFOX方案能够在术后的辅助治疗过程中发挥重要作用,其对于残留癌细胞的抑制和杀伤性作用,能够提高手术治疗效果,进一步减轻患者的高肿瘤负荷性表现[10]。但一项囊括了237例样本量的结直肠癌术后化疗的临床分析研究可见,FOLFOX方案化疗后的患者病情缓解率仍然不足35%,患者的胃肠道并发症的发生率仍然超过了8%以上,同时生存预后的改善并不明显[11]。因此,临床上寻找可靠而有效的辅助性治疗药物,对于改善FOLFOX方案的化疗结局,提高FOLFOX方案治疗的临床安全性均具有重要的意义。
癌细胞膜内外的酸性微环境的维持,对于提高肿瘤细胞的增殖和侵袭能力具有重要的保护性意义,其能够提高癌细胞对于化疗药物的排泄能力,抑制化疗药物的吸收。PPI抑制剂能够通过对于ATP酶活性的抑制作用,抑制H+的泵出,从而改变癌细胞膜外的酸性环境[12]。同时相关基础方面的研究还证实,PPI能够通过提高膜上转运体的活性,促进化疗药物通过转运体进入癌细胞内膜,提高了药物的作用效果。
在肠道黏膜通透性上升的患者中,乳酸可透过肠道黏膜进入血循环中,DAO存在于肠道黏膜纤毛上皮中,在纤毛上皮细胞脱落和凋亡的过程中,DAO可释放并进入血液,乳果糖经过肠道黏膜吸收,而甘露醇经过细胞吸收,在肠道黏膜通透性上升的患者中,乳果糖的吸收明显增多,从而导致L/M的上升。本研究中两组患者化疗后的DAO、血乳酸、L/M均明显的上升,提示不同的化疗方案均能够导致肠道黏膜通透性的增加,但观察组患者治疗后的相关指标均明显低于对照组,提示PPI治疗能够在一定程度上保护肠道黏膜屏障,降低肠道黏膜的通透性。这主要由于PPI能够提高细胞膜内外酸碱代谢的微环境,减少肠道黏膜上皮细胞的凋亡和坏死,保护肠道黏膜的生理性屏障。同时PPI对于H+质子泵的抑制作用,能够参与肠道上皮细胞间缝隙蛋白的调控过程,促进缝隙蛋白的新生和修复。观察组患者采用PPI联合治疗后的生活质量明显的改善,同时患者的非特异性症状如恶心/呕吐、乏力等评分均低于对照组,提示PPI对于结肠癌患者的病情改善作用。通过汇集不同的相关文献,笔者认为PPI对于生活质量的改善,主要由于其下列几个方面的作用[13-14]:(1)PPI能够通过提高 FOLFOX 化疗药物的细胞毒性,提高化疗的敏感性,进一步促进癌细胞的坏死;(2)PPI能够通过对于肠道黏膜屏障的稳定作用,降低过度的毒素吸收导致的全身不良反应的发生,提高了患者的生活质量水平。赵加应等[8]研究者也发现,PPI联合治疗后,结肠癌患者的生活质量评分可平均上升25%以上,特别是在PPI治疗时机较早或治疗周期较长的患者中,其生活质量的改善程度更为明显。部分研究者认为,PPI可能增加肝肾功能损伤的风险[15]。在本研究中发现,PPI治疗的临床安全性较为可靠,无明显的血液系统或肝肾功能损害的表现。考虑可能与随访观察时间或FOLFOX方案的治疗周期的不同有关。
综上所述,PPI联合FOLFOX治疗,能够显著改善结肠癌术后患者的胃肠道黏膜屏障,改善患者的生活质量,降低胃肠道反应的发生率。
