血浆组蛋白H4与脓毒症患者严重程度及预后关系研究
2019-10-17王力军刘艳存王紫怡柴艳芬
郭 菲,王力军,么 颖,刘艳存,曹 超,王紫怡,柴艳芬
(天津医科大学总医院急诊医学科,天津300052)
脓毒症是危重症病人常见死亡原因,其发病率不断上升,且花费巨大,已成为全球范围的主要公共健康问题[1-3]。分子标志物是脓毒症研究热点,一些标志物在诊断脓毒症方面取得一定进展,但临床尚缺乏评估患者严重程度和预后的良好指标。
组蛋白是染色体的基本结构蛋白,共有5种类型:H1/H5、H2A、H2B、H3、H4,因 H3 和 H4 毒性最强[4],目前研究也最广泛。2008年,Xu等首次报道胞外组蛋白是脓毒症小鼠模型的主要致死因素,其毒性作用导致脓毒症小鼠内皮细胞损伤、器官功能衰竭甚至死亡,H4抗体能降低小鼠病死率[5]。Wildhagen等发现血浆组蛋白H3与脓毒症患者病死率和危重病评分相关,可作为脓毒症预后的预测指标[6]。关于血浆组蛋白H4的临床研究相对较少[7]。
细胞凋亡或坏死时染色质降解,核内组蛋白被释放至细胞外,称为细胞外组蛋白(Extracellular histone,EH)。EH进入血液循环称为循环组蛋白或血浆组蛋白[8]。脓毒症新近研究显示细胞凋亡在脓毒症及脓毒症心肌抑制的发生发展过程中发挥重要作用[9]。脓毒症死亡患者发生明显细胞凋亡[10]。Caspase-3是细胞凋亡过程的主要执行分子,本研究探讨脓毒症患者血浆组蛋白H4浓度变化和凋亡的关系,血浆组蛋白H4浓度是否与脓毒症患者严重程度有关以及是否可作为判断脓毒症预后的指标。
1 资料与方法
1.1 研究对象 2017年5月-2018年4月天津医科大学总医院急诊医学科收治的50例脓毒症患者。病例纳入标准:入院24 h内符合sepsis 3.0标准的患者,即机体对感染的反应失调而导致危及生命的器官功能障碍(感染+ΔSOFA评分≥2)。病例分组标准:根据患者28日生存情况,将其分为存活组和死亡组。所有患者(家属)均告知此研究的目的、研究程序以及参加此研究不影响患者的治疗方案,均签署知情同意书。本研究经天津医科大学总医院伦理委员会审核通过(IRB2018-152-01)。排除标准:(1)年龄>80 岁或<18 岁;(2)肿瘤患者;(3)失代偿性肝硬化;(4)急性坏死性胰腺炎;(5)慢性终末期肾病患者;(6)孕妇;(7)免疫性疾病活动期;(8)不能完成该试验者。
1.2 血浆组蛋白H4和caspase-3检测方法 脓毒症患者入院24 h和72 h时,采集静脉血5 mL置柠檬酸钠抗凝采血管中,-4℃冰箱内保存10~20 min,随后3 000 r/min离心10 min。收集血浆,-80℃冰箱保存。采用上海广锐生物科技有限公司提供的EH4(产品批号 20171226)和 caspase-3(产品批号20171223)检测试剂,用酶联免疫分析法集中检测血浆组蛋白H4和caspase-3浓度。
1.3 其他资料收集 收集患者入院24 h及72 h的白细胞计数(white blood cell,WBC)、中性粒细胞绝对值及其比例(absolute neutrophil cell,ANC,N%)、血小板计数(platelet,PLT)、血清降钙素原(procalcitonin,PCT)、C-反 应 蛋 白 (C-reactive protein,CRP)、乳酸(lactic acid,LAC)和乳酸脱氢酶(lactate dehydrogenase,LDH)等生化指标。LAC用GEM Premier 3000血气分析仪床旁及时测定,PCT用Pylon 3d循环增强荧光分析仪床旁即时测定,其他指标由我院检验中心测定。计算患者24 h和72 h疾病严重程度(APACHEⅡ评分、SOFA评分),并记录患者28日生存情况。
1.4 统计学方法 应用SPSS 24.0软件进行统计分析,符合正态分布的定量资料以±s表示,两组比较采用LSD-t检验;非正态分布的计量资料以中位数(四分位数)[M(Q1,Q3)]表示,两组比较采用 Mann-Whitney U检验。定性资料(28 d时存活状态)采用χ2检验,两变量相关性采用Spearman相关分析。绘制ROC曲线,根据约登指数找出最佳截断点,并计算各指标曲线下面积、敏感性及特异性。以P<0.05为有统计学差异。72 h血浆组蛋白H4清除率=(72 h血浆组蛋白H4浓度-24 h血浆组蛋白浓度)/24 h血浆组蛋白H4浓度×100%。
2 结果
2.1 一般资料比较 50例脓毒症患者中存活40例,死亡10例。存活组男25例,女15例,年龄(65.6±15.79)岁;死亡组 男 9例,女 1例,年龄(64.92±16.44)岁。两组患者的一般资料和入院24 h临床指标等数据比较,见表1。两组患者24 h和72 h血浆组蛋白H4浓度比较,见表2。
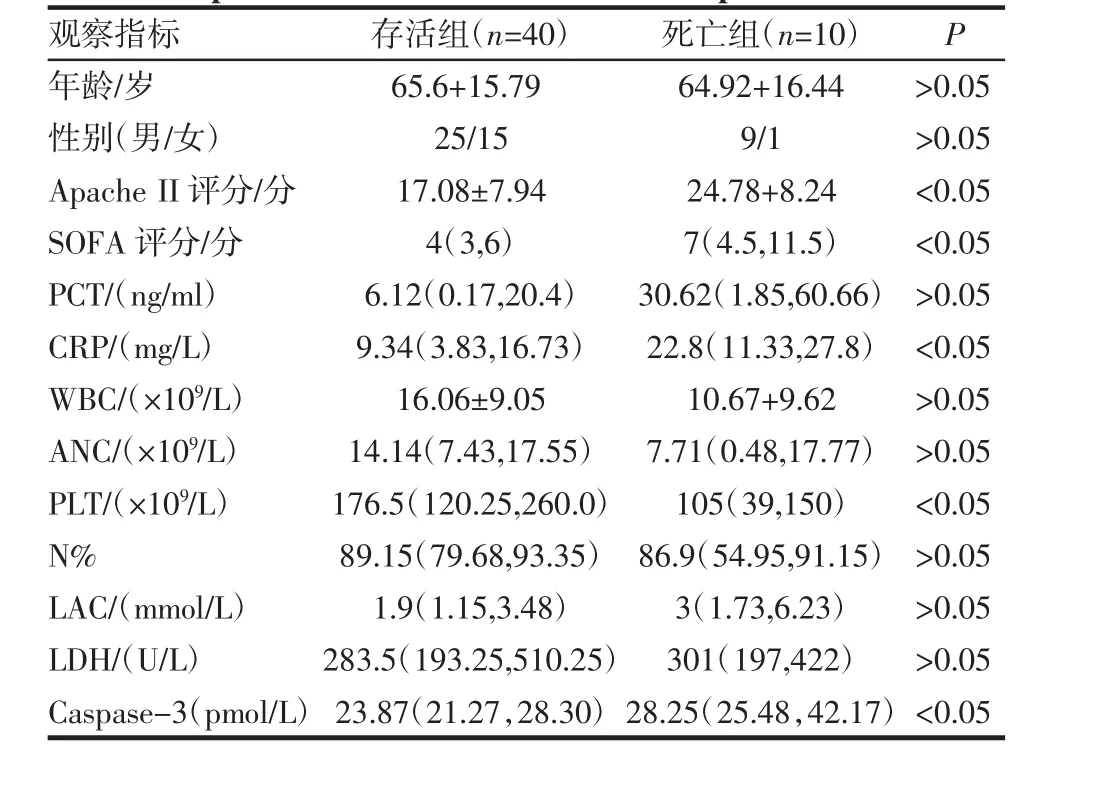
表1 两组患者一般资料和入院24 h观察指标比较Tab 1 Comparision of clinical data and clinical parameters at 24 h
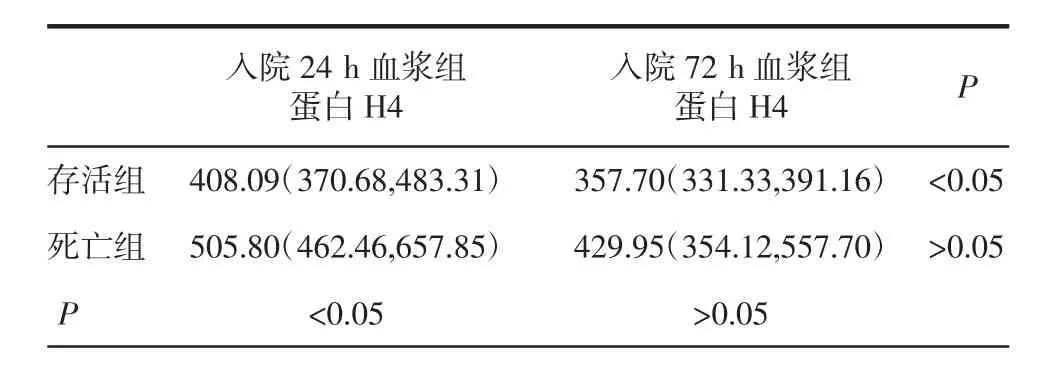
表2 脓毒症患者存活组与死亡组24 h和72 h血浆组蛋白H4浓度比较Tab 2 The comparision of plasma histone H4 levels at 24 h and 72 h in survivors and non-survivors of septic patients
2.2 血浆组蛋白H4与观察指标间的相关性分析 以 WBC、ANC、PLT、PCT、CRP、LAC、LDH 和Caspase-3作为观察指标,上述指标与血浆组蛋白H4相关性分析见表3。结果提示24 h和72 h血浆组蛋白 H4与 PCT、CRP、caspase-3呈正相关,72 h血浆组蛋白H4与LDH呈正相关,24 h和72 h血浆组蛋白H4与PLT呈负相关,见表3。

表3 血浆组蛋白H4浓度与观察指标的相关性分析Tab 3 The correlation between plasma histone H4 and observation parameters
2.3 血浆组蛋白H4与疾病严重程度的相关性分析 24 h时血浆组蛋白H4浓度与APACHEⅡ评分和SOFA评分均呈显著正相关(r值分别为0.747,和 0.631,P 均<0.05)。72 h 时血浆组蛋白 H4浓度与APACHEⅡ评分无显著相关性,72 h时血浆组蛋白H4浓度与SOFA评分呈正相关,见表4、图1。
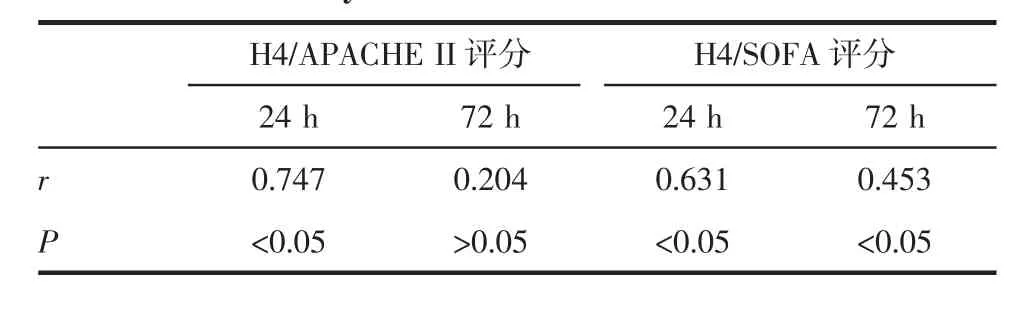
表4 两时间点血浆组蛋白H4浓度与疾病严重程度的相关性分析Tab 4 The correlation between plasma histone H4 levels and the disease severity at 24 h and 72 h
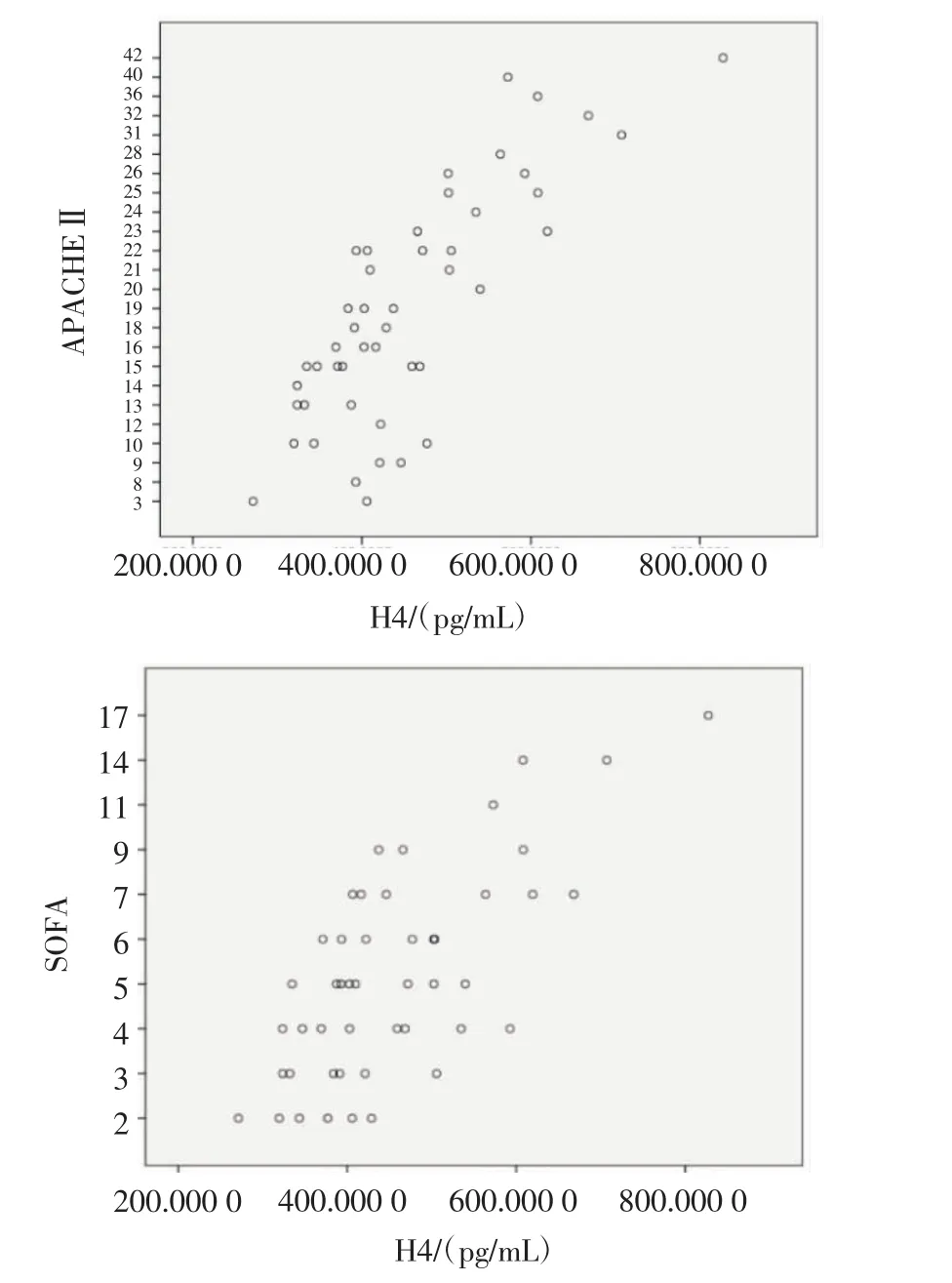
图1 24h血浆组蛋白H4与APACHEⅡ评分和SOFA评分相关性Fig 1 The correlation of plasma histone H4 levels with APACHEⅡscore and SOFA score
2.4 血浆组蛋白H4与脓毒症预后的相关性 脓毒症患者死亡组血浆组蛋白H4浓度高于存活组,24 h 差异有统计学意义[505.80(462.46,657.85)vs 408.09(370.68,483.31),P<0.05](图2);72 h差异无统 计 学 意 义 [429.95 (354.12,557.70)vs 357.70(331.33,391.16),P>0.05]。存活组 72 h 血浆组蛋白H4浓度低于24h血浆组蛋白H4浓度,差异有统计学意义[357.70(331.33,391.16)vs408.09(370.68,483.31),P<0.05]。死亡组72h血浆组蛋白H4浓度与24 h血浆组蛋白H4浓度差异无统计学意义[429.95(354.12,557.70)vs505.80(462.46,657.85),P>0.05]。计算72 h血浆组蛋白H4清除率+100%,存活组与死亡组差异无统计学意义 [111.1%(99.53%,131.08% vs 100%(100%,100%),P>0.05]。
两组间 24 h 观察指标中,Caspase-3、PCT、CRP、PLT、APACHEⅡ评分和SOFA评分有统计学差异,72 h观察指标均无统计学差异。以24 h血浆组蛋白 H4、Caspase-3、PCT、CRP、PLT、APACHE Ⅱ评分和SOFA评分来判断脓毒症患者预后,绘制ROC曲线(图3),并计算曲线下面积。24 h血浆组蛋白H4的AUC为0.804,高于其他指标,cutoff值452.66,敏感度 0.889,特异性 0.684(表 5)。
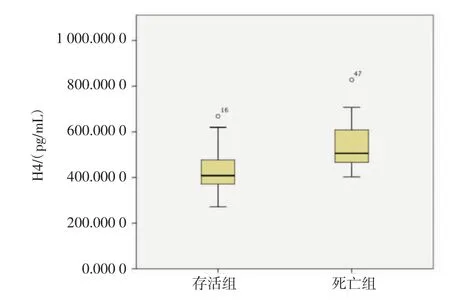
图2 脓毒症患者存活组和死亡组24 h血浆组蛋白H4浓度比较Fig 2 The comparision of plasma histone H4 levels at 24 h between survivors and non-survivors of septic patients
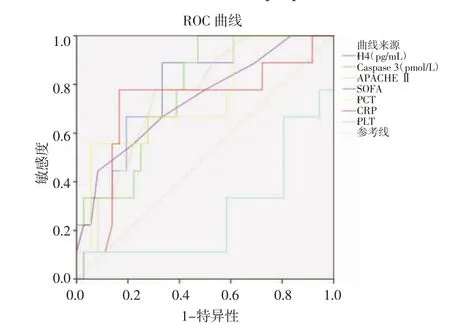
图3 血浆组蛋白H4、Caspase-3、APACHEⅡ评分和SOFA评分判断脓毒症患者预后的ROC曲线图Fig 3 TheareaundertheROCcurveofplasmahistoneH4,Caspase-3,APACHEⅡscore and SOFA score as prognostic markers

表5 血浆组蛋白 H4、Caspase-3、PCT、CRP、PLT、APACHE Ⅱ评分和SOFA对脓毒症患者预后的诊断价值Tab 5 The prognostic value of plasma histone H4,Caspase-3,PCT,CRP,PLT,APACHEⅡ score and SOFA score in septic patients
3 讨论
中国严重脓毒症/脓毒性休克治疗指南(2014)提出血清乳酸水平可作为患者病情严重程度的标志。但是单纯监测血清乳酸水平不能准确反映组织氧供、氧耗的动态变化。虽然乳酸清除率可纠正单一时间点监测的缺陷,但需时间长且操作繁琐,不利于早期评估患者病情严重程度。脓毒症发病机制复杂,炎症反应失衡、免疫功能紊乱、微循环功能障碍、凝血障碍、线粒体损伤、内质网应激、细胞凋亡与自噬、基因多态性及神经-内分泌-免疫网络等均参与脓毒症的发生和发展[11-12]。
EH与脓毒症炎症反应、免疫瘫痪和凝血障碍等机制密切相关[7],EH作为细胞毒性损伤相关分子模式蛋白,通过激活Toll样受体、促进炎症反应和改变磷脂膜通透性等多种机制,诱导肺、心脏、肝、肾及脾损伤,出现多器官功能障碍综合征[13-14]。此外,脓毒症时炎症反应、微血管内血栓形成和内皮细胞功能失调等致全身靶器官损伤及大量炎症细胞坏死,核内组蛋白大量溢出至细胞外,再次诱导炎症因子激活或释放,从而形成恶性循环[15-16]。另有学者发现中性粒细胞胞外诱捕网也是血浆组蛋白的重要来源[17-18]。
本研究发现,脓毒症患者入院24 h血浆组蛋白H4浓度与APACHEⅡ评分和SOFA评分有较好的正相关性(r值分别为 0.747 和 0.631,P<0.05),24 h血浆组蛋白H4浓度可反应脓毒症患者严重程度。APACHEⅡ评分和SOFA评分是临床常用的病情严重程度评分系统,评分越高患者病情越重。APACHEⅡ评分[19]能够较好的预测脓毒症患者预后,因其较高的敏感性和特异性,目前应用最为广泛。但需要指标较多,计算过程繁琐。qSOFA评分被推荐为急诊床旁筛查脓毒症和评估预后的工具[2],但Park等[20]研究表明其敏感性较低,有漏诊风险。Raith等研究表明qSOFA评分对危重的感染患者的预后评估价值有限[21]。脓毒症时,患者血浆组蛋白H4升高时间早,与APACHEⅡ评分和SOFA评分有较好的相关性,敏感性、特异性较高,可早期、准确评估脓毒症患者严重程度。
本研究中,死亡组患者入院24 h血浆组蛋白H4浓度高于存活组。此与Ekaney等研究结果一致[5,22-23]。动态监测脓毒症患者血浆组蛋白H4浓度变化,存活组患者72 h血浆组蛋白H4浓度较24 h明显下降。可能与脓毒症存活组患者细胞损伤较前减轻,组蛋白来源减少而机体清除能力增强有关。说明血浆组蛋白H4浓度下降预测患者病情好转。既往关于脓毒症血浆组蛋白H4动态变化的研究很少,Ekaney等[22]报道ICU脓毒症患者入院第3天血浆组蛋白H4浓度较第1天显著下降,患者第1天的血浆组蛋白H4浓度与病死率有关。本研究结果与其一致。本研究死亡组患者两时间点血浆组蛋白H4浓度无统计学差异,可能与脓毒症死亡患者清除组蛋白能力严重受损有关,也可能与样本量小有关。死亡组与存活组72 h血浆组蛋白H4清除率没有统计学差异,考虑与死亡组72 h样本量小有关。有待多中心、大样本量的研究证实脓毒症死亡患者的血浆组蛋白H4变化情况。
临床常用指标如 PCT、CRP、LAC、WBC、ANC 和PLT等均对评估脓毒症严重程度和预后有一定作用[24-26],但是这些指标的临床价值尚存争议。本研究中,临床常用指标 PCT、CRP、PLT、APACHE Ⅱ评分和SOFA评分在预测脓毒症患者预后方面有诊断价值,此与Sadaka等学者结论一致[22-24]。用ROC曲线下面积评估各指标对脓毒症患者预后的价值,24 h血浆组蛋白H4的AUC为0.793,高于PCT、CRP、PLT、Caspase-3、APACHEⅡ评分和SOFA评分。此外,血浆组蛋与PCT、CRP和APACHEⅡ评分和SOFA评分呈正相关,而与PLT计数呈负相关。表明血浆组蛋白H4是较好的脓毒症患者预后的指标。
脓毒症细胞凋亡与胞外组蛋白H4密切相关。细胞凋亡途径主要包括内源性途径和外源性途径[27],Caspase、Fas/FasL、Bcl-2、Livin 等均可作为反映细胞凋亡的标志物,其中Caspase家族在脓毒症细胞凋亡的发生发展过程中发挥关键作用[28]。细胞凋亡的两种途径都作用于caspase-3。Caspase-3在凋亡早期阶段即可被激活,活化后裂解相应的胞浆胞核底物,引发细胞凋亡,影响组织器官功能,甚至危及生命[9]。本研究发现,血浆caspase-3在脓毒症患者24 h和72 h时均明显升高,存活组患者72 h血浆caspase-3浓度较24 h明显下降。血浆组蛋白H4在脓毒症患者24 h和72 h时均与caspase-3呈正相关(P均<0.05)。该结果与凋亡是组蛋白来源之一相吻合,细胞凋亡增加导致血浆组蛋白H4浓度升高,推测细胞凋亡是血浆组蛋白H4导致脓毒症患者病死的机制之一。细胞凋亡与脓毒症患者不良预后有关。Lorente等报道caspase-3浓度与脓毒症患者早期病死率相关[29],本研究结果与其一致。Santiago等学者发现血浆组蛋白通过mTOR途径,以剂量依赖性的方式,激活内皮细胞的凋亡和自噬,从而导致脓毒症和脓毒性休克的发生[30]。
脓毒症患者常并发凝血系统功能紊乱[31],此过程与血浆组蛋白H4有关。本研究中,血浆组蛋白H4与血小板计数呈显著负相关。EH通过血小板活化和血栓栓塞等多种机制,诱导凝血功能紊乱[32]。所有组蛋白亚型均可促进血小板的聚集和血栓形成。然而,H4亚型的上述作用最强[33]。此作用与TLR2及TLR4有关,也可能有其他机制[32]。
本研究还纳入LDH做为观察指标,在体外试验中LDH浓度与细胞膜损伤程度相关。胞外组蛋白对内皮细胞有直接毒性,血浆组蛋白H4可通过直接细胞毒性参与脓毒症病情进展[20]。本研究中,血浆组蛋白H4与LDH呈正相关,此与既往研究结果一致[20]。
本研究存在一定的局限性。首先,Alhamdi等[34]发现,胞外组蛋白在脓毒症患者出现时间为发病10 h,达峰时间为16~24 h。本研究未监测脓毒症患者24 h内的血浆组蛋白及caspase-3浓度,另外,本研究选取的时间点为脓毒症患者入院24 h及72 h,但患者入院前可能已符合脓毒症标准,导致数据不能真实反映脓毒症两时间点的状态。其次,在脓毒症发病机制中存在促炎(如IL-1、IL-6和TNFα)与抗炎(如IL-2、IL-10和IFN-γ)的动态变化过程。本研究没有监测以上炎性因子,而选择WBC、PLT、PCT、CRP、LAC和LDH等,不能说明血浆组蛋白H4在脓毒症早期对炎性因子的影响。再次,细胞凋亡的标志物有促进凋亡与抑制凋亡之分,本研究仅选取了促进凋亡的caspase-3,不能充分阐释脓毒症细胞凋亡和组蛋白的关系。脓毒症时导致血浆组蛋白H4升高的凋亡细胞类型尚不明确,有待进一步证实。总之,脓毒症病人入院24 h时血浆组蛋白H4浓度可反应疾病严重程度,并作为判断预后的预测指标。胞外组蛋白不仅是新型生物标记物,也是未来治疗靶点。中和循环中组蛋白、使用EH抗体及阻断组蛋白信号转导等措施,可能为治疗脓毒症提供新方向。
