血管紧张素-(1-7)对快速心房起搏犬心房重构及p38MAPK蛋白表达的影响
2019-10-17张凤环上官文锋王学文李广平
张凤环,上官文锋,王学文,李广平
(天津医科大学第二医院心脏科,天津心血管病离子与分子机能重点实验室,天津心脏病学研究所,天津300211)
心房颤动是临床上最常见的快速性心律失常之一,其病理生理机制主要为心房重构,其中肾素-血管紧张素(RAS)系统发挥重要作用,已证实Ang II有强的促心脏重构作用[1]。而RAS系统中的另一成分,血管紧张素-(1-7)[Ang-(1-7)]可经血管紧张素转化酶 2/血管紧张素-(1-7)/Mas(ACE2/Ang-(1-7)/Mas)通路对抗Ang II而发挥降血压、改善心脏重构的作用,并在抗炎症反应、抗纤维化中也起到作用。p38MAPK信号通路与心肌纤维化、心肌肥大、缺血再灌注损伤有关,但是p38MAPK信号通路是否参与了房颤的病理生理改变,以及Ang-(1-7)对于p38MAPK信号通路有无干预作用尚不明确。本研究拟探讨房颤动物模型中心房重构与p38MAPK蛋白激活的关系和Ang-(1-7)的干预作用。
1 材料与方法
1.1 实验设备及材料 健康成年杂种犬购自天津医科大学动物实验中心;特制犬高频心房起搏器购自复旦大学电子工程系;TOP2001多导电生理仪购自上海宏桐有限公司;DF-5A型电生理刺激仪购自苏州市东方电子仪器厂;Alzet®微量渗透泵购自美国DURECT公司;Masson染色试剂盒购自南京建成科技有限公司;电泳转膜仪购自Bio-Rad公司;化学发光成像系统购自上海天能公司;Ang-(1-7)试剂购自Bachem公司;BCA蛋白含量检测试剂盒购自凯基生物公司;小鼠抗大鼠β-actin抗体购自全式金公司;小鼠抗大鼠p38MAPK抗体、兔抗大鼠磷酸化p38MAPK抗体购自Abcam公司;HRP标记的羊抗小鼠抗体、HRP标记的羊抗兔抗体购自Promega公司;ECL化学发光液购自Millipore公司。
1.2 实验方法
1.2.1 实验分组与模型建立 健康成年杂种犬15只,体质量12Kg左右,雌雄不限,随机数字表法分为3组:假手术组(Sham,S组),心房起搏组(Pacing,P组)和心房起搏+Ang-(1-7)组(A 组),每组 5只。所有犬均以3%异戊巴比妥钠30 mg/Kg麻醉,气管插管连接呼吸机,仰卧位固定,监测心电图、血氧饱和度、动脉血压,静脉点滴5%葡萄糖生理盐水注射液,分离右侧颈外静脉,穿刺颈外静脉向近心端送入电极至右心房,电极远端连接电生理刺激仪,用500次/min快速起搏心房,当记录到1:1心房夺获并起搏良好,固定电极,电极末端连接特制犬高频心房起搏器,起搏电压5 V,脉宽0.2 ms,频率500次/min,起搏器埋置于肩胛间区皮下囊袋,术中严格无菌操作,术后应用抗生素预防感染,S组起搏器不起搏,P组和A组连续起搏2周,A组同时皮下埋置Alzet®微量渗透泵,经颈外静脉给予Ang-(1-7)以6 μg/Kg/h持续泵入至实验结束。
1.2.2 房颤诱发率及持续时间测定 各组犬起搏2周后,3%异戊巴比妥钠麻醉,仰卧位固定,连接呼吸机与体表心电图,正中开胸,暴露心脏,将6对双极记录电极分别与高位左心房、低位左心房、左心耳、高位右心房、低位右心房、右心耳连接,将4对电极与左上、下肺静脉和右上、下肺静脉连接,各电极与多导电生理记录仪连接,应用心脏程序期前刺激法测量心房6点基础起搏周长为250 ms时的心房有效不应期,应用快速刺激诱发房颤,测定各位点的房颤诱发率及持续时间。
1.2.3 心房肌细胞形态学检查 电生理实验结束后取出心脏,剪取心房肌组织,冷PBS洗净血液后于10%中性福尔马林溶液中固定24 h,经脱水、石蜡包埋后切片,分别进行HE染色及Masson染色。
1.2.4 Western blot检测心房肌组织p38MAPK、磷酸化p38MAPK的蛋白表达情况 电生理实验结束后取出心脏,剪取左心房肌组织,冷PBS洗净血液,置于冻存管中-80℃保存。剪取适量冷冻组织,液氮法研磨提取蛋白上清液,BCA法测定总蛋白浓度,等量上样作SDS-PAGE电泳,将凝胶中的蛋白质转至PVDF膜,室温下用5%脱脂牛奶封闭1 h,分别于稀释 β-actin 抗体(1:5 000)、p38MAPK(1:1 000)抗体和磷酸化p38MAPK(1:1 000)抗体4℃孵育过夜,TBST洗膜3次,每次10 min,于相应二抗室温孵育1 h,TBST洗膜3次,每次10 min,ECL法于化学发光呈像系统中曝光,使用Tanon Gis系统进行条带灰度分析计算净光密度,以目的蛋白净光密度/β-actin净光密度的比值反应目的蛋白相对水平。
1.3 统计学处理 使用SPSS21进行统计学数据分析处理,计量资料用±s表示,多组样本均数比较使用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 各组犬起搏前后心室率比较 各组犬起搏前及起搏后心室率比较均无统计学意义,见表1。

表1 各组犬起搏前后心室率比较Tab 1 Comparison of ventricular rate before and after pacing in each group
2.2 各组犬心脏超声参数变化 快速心房起搏使P组犬左室射血分数较S组明显降低(P<0.05),而A组与P组比较左室射血分数提高(P<0.05)且仍低于S组,但左房内径、左室舒张末期内径、室间隔厚度及左室后壁厚度的变化在3组间未达到统计学意义,见表2。
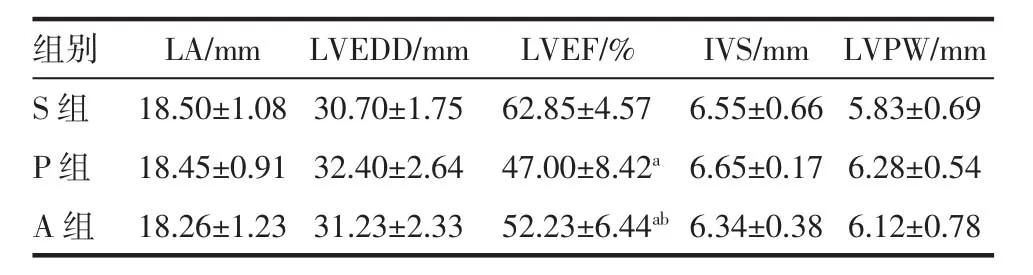
表2 各组犬心脏超声参数的变化Tab 2 Changes in cardiac ultrasound parameters in each group
LA左房内径,LVEDD左室舒张末期内径,LVEF左室射血分数,IVS室间隔厚度,LVPW左室后壁厚度,a与S组比较P<0.05,b与P组比较P<0.05
2.3 各组犬心房有效不应期、房颤诱发率及持续时间的变化 与S组相比,P组各部位心房有效不应期明显缩短,而A组与P组比较在高位右房、高位左房和低位左房的心房有效不应期延长;P组房颤诱发率升高,房颤持续时间延长,A组与P组比较房颤诱发率降低,房颤持续时间缩短,见表3、4。

表3 各组犬房颤诱发率及持续时间Tab 3 AF inducibility and duration in each group

表4 各组犬不同部位心房有效不应期(ms)Tab 4 AERP of each group(ms)
2.4 心房肌细胞结构及形态学变化 HE、Masson染色可以观察到P组较S组心房肌细胞排列紊乱,细胞大小不均,细胞间纤维组织增多,而Ang-(1-7)干预后可减轻上述变化,见图1、2。
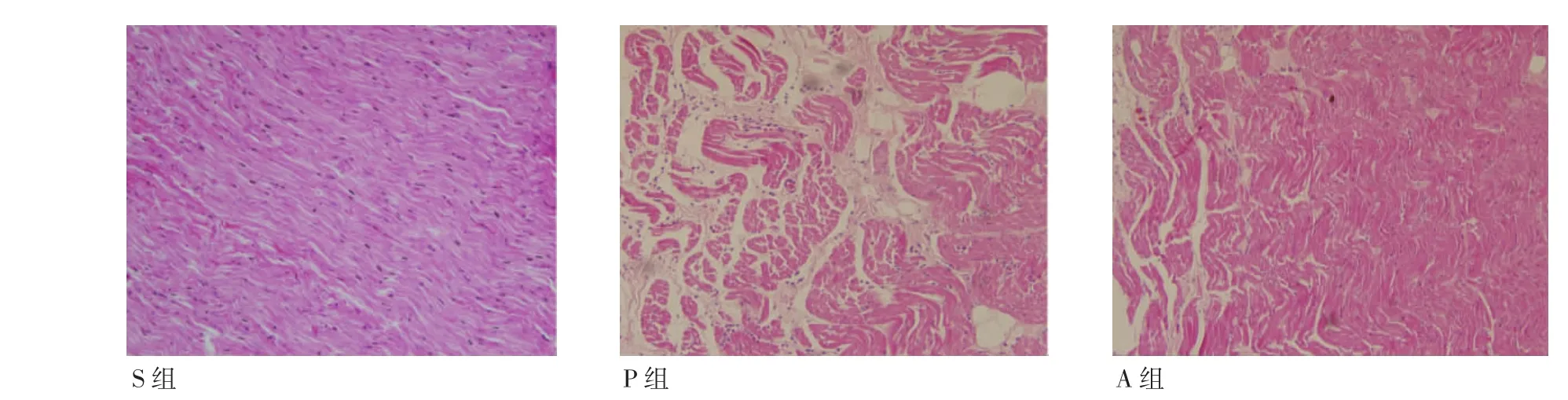
图1 心房肌组织HE染色(200×)Fig 1 HE staining of atrial myocardium(200×)

图2 心房肌组织Masson染色(200×)Fig 2 Masson staining of atrial myocardium(200×)
2.5 p38MAPK、磷酸化p38MAPK蛋白表达情况 与S组相比,P组磷酸化p38MAPK蛋白水平明显升高(P<0.05),使用 Ang-(1-7)干预后可使其降低(P<0.05),但3组p38MAPK蛋白水平的变化未达到统计学意义,见表 5、图 3。
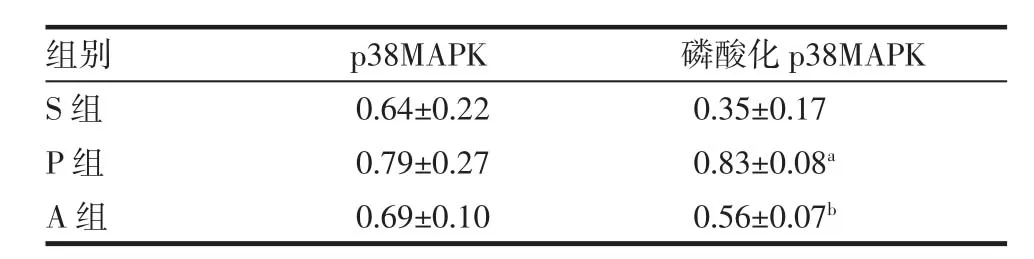
表5 各组犬左心房各目的蛋白相对表达量平均值Tab 5 Relative expression levels of proteins in the left atrium of each group

图3 Western blot检测p38MAPK、磷酸化p38MAPK蛋白表达情况Fig 3 Western blot of p38MAPK and phosphorylated p38MAPK protein expression
3 讨论
心房颤动是临床上常见的一种以心房快速、无序的电活动为特征的心律失常,其对人体的危害主要为血栓栓塞和心功能损害。房颤可使心衰的患病率增加3倍并且加重心衰的症状[2],在本实验中,两周的快速心房起搏就可使左室射血分数明显降低。房颤的病理生理改变主要包括心房的电重构和结构重构,电重构主要表现为心房有效不应期和动作电位时限缩短、动作电位传导速度减慢、不应期离散度增加等,结构重构则包括心房肌细胞退行性变和心肌间质纤维化等[3],在我们的前期实验中已观察到快速心房起搏可使心房肌细胞离子通道发生改变[4-5],本实验中通过快速心房起搏模拟房颤,两周后关闭心房起搏器,虽然各组犬窦性心律时的心室率变化没有意义,但是心房起搏组犬心房有效不应期缩短,房颤诱发率及持续时间升高,心肌细胞间纤维组织明显增多,符合房颤的病理生理改变,即房颤造模成功。
p38MAPK是丝裂原活化蛋白激酶(MAPK)家族的成员之一,在介导细胞生长、凋亡、炎症及应激反应等起到十分重要的作用[6],并与心肌纤维化、心肌肥大、缺血再灌注损伤有关[7-8]。p38MAPK通路也参与了房颤的发生和维持,如在兔肺静脉肌袖中的研究发现,致房性心律失常作用主要通过激活p38MAPK信号通路[9];与窦性心律相比,房颤患者心肌局部磷酸化p38MAPK水平明显升高,据此认为MAPK途径的激活可能是心房纤维化的分子基础[10],p38MAPK还可通过干预炎症因子及细胞外基质代谢、诱导细胞凋亡、激活成纤维细胞促进胶原沉积等参与心肌纤维化[7]。在细胞水平已证明快速起搏可使心房肌细胞L型钙通道α1c亚单位、Kv4.3表达下降,磷酸化p38MAPK升高,特异性阻断p38MAPK可减轻这一变化[11],即p38MAPK可能参与了电重构,本研究在在体实验水平也证实快速心房起搏所导致的心房重构伴随着p38MAPK磷酸化激活,而总p38MAPK水平并无差异,这可能因为外界刺激因素经多级传递使磷酸化激酶活化进而磷酸化激活p38MAPK蛋白成为有活性状态,活化后的p38MAPK蛋白才能调控多种转录因子的产生从而发挥作用[6]。目前快速心房起搏与p38MAPK激活的具体调控机制尚不明确,但有研究表明β3肾上腺素能受体在其中起到桥梁的作用[12]。
RAS系统与心血管疾病密切相关,其中的重要效应因子Ang II与AT1R结合可通过多种途径调控内皮细胞损伤、动脉硬化、心肌纤维化和炎症反应等[13]。Ang-(1-7)是 RAS 系统的另一活性物质,与Ang II的生理作用相反,其可抑制并改善多种心血管疾病所导致的心肌肥大和纤维化[14],并在抗炎症反应中起到作用,如抗白细胞募集、降低促炎因子表达、增加抗炎因子表达等[15]。在笔者的前期实验中,使用Ang-(1-7)可以减轻快速心房起搏导致的离子通道改变,使电生理指标明显改善,也可通过降低ACE、ERK1/ERK2的表达,提高ACE2表达减轻心房肌纤维化[5,16-17]。Ang-(1-7)也可干预 p38MAPK 通路,如Ang II可使人脐静脉血管内皮细胞p38MAPK蛋白磷酸化水平明显升高,细胞间黏附分子-1(ICAM-1)、血管细胞粘附分子-1(VCAM-1)和MCP-1表达明显升高,而Ang-(1-7)可通过Mas受体,减轻p38MAPK蛋白磷酸化水平从而逆转这一变化[18]。在本实验的房颤模型中,Ang-(1-7)可延长心房有效不应期,降低房颤诱发率和持续时间,降低p38MAPK磷酸化激活,改善心肌纤维化,但这些作用是否经Mas受体及是否直接作用于p38MAPK通路还未得知。
在本实验中,通过快速右心房起搏建立房颤动物模型,可以观察到心房重构的表现,并且磷酸化p38MAPK蛋白水平显著升高。磷酸化p38MAPK激活后可能通过介导下游的细胞因子的表达而触发并加重心房重构,从而导致房颤的发生和持续,而给予Ang-(1-7)干预后,心房重构改善,心房磷酸化p38MAPK蛋白表达水平显著降低,表明Ang-(1-7)可能通过抑制心房p38MAPK激活发挥其抑制心房重构的作用。但是,心房重构与p38MAPK激活的具体关系及Ang-(1-7)干预p38MAPK通路的具体机制目前尚不明确,需进行深入研究。
