关节腔注射透明质酸钠对去卵巢大鼠骨关节炎的影响
2019-10-17张兴廖瑛周君曾亚华成果王甜甜邓程远钟培瑞
张兴 廖瑛,* 周君 曾亚华 成果 王甜甜 邓程远 钟培瑞
1.南华大学附属第一医院骨科,湖南 衡阳 421001 2.南华大学附属第一医院康复科,湖南 衡阳 421001
骨性关节炎(osteoarthritis,OA)是关节紊乱的最常见形式,其特征是关节软骨退化、软骨下骨重建、关节边缘反应性新骨形成,从而引起关节疼痛和僵硬,最终导致关节功能障碍而影响生活质量[1]。OA的发病率已成为世界范围内日益严重的健康问题[2]。而关节腔注射透明质酸(hyaluronic acid, HA)因可减轻OA疼痛,并能改善关节活动,保护软骨是其治疗OA最常见的机制[3]。因此探寻透明质酸对OA治疗的相关作用机制研究,将有利于进一步寻找抑制病情发生的作用靶点,为OA预防与治疗提供新思路。
骨质疏松症是人类最常见的骨病[4],以绝经后卵巢产生的雌激素降低致使骨质流失的女性最为多见。虽然对于OA与骨质疏松之间的关联尚未明确,但有不同的报道表明,在严重的髋或膝OA患者中,骨量减少和骨质疏松占的比例很大[5],而在远离膝关节的部位,纵向骨密度丧失与膝OA软骨的进行性丢失有关[6]。还有研究表明,在OA伴骨质疏松症的早期发展过程中,可以检测到骨的变化,这些变化发生在软骨下骨和膝OA患者的胫骨内[7]。以往的研究主要集中在使用膝关节不稳定所致的实验性OA动物模型[8]。然而,这些模型可能不适用于原发性OA,尤其是绝经后OA。已有研究证实,动物去卵巢(ovariectomy,OVX)能够复制OA合并骨质疏松的体内模型,模拟绝经后OA的病理生理进程[9-10]。因此,本实验联合膝关节不稳和OVX,在大鼠体内建立表现OA和骨量丢失的模型,以探究透明质酸对OVX大鼠OA模型关节软骨及软骨下骨的影响。
1 材料和方法
1.1 材料
1.1.1实验动物:3月龄雌性SD大鼠30只,平均体重约为256.7 g,购于湖南省斯莱克景达实验动物有限公司,动物许可证号:SCXK(湘)2016-0002。实验动物饲养于南华大学动物实验室,使用许可证号:SYXK(湘)2010-0006。12 h间隔照明,自由活动,环境温度为 21~27 ℃,湿度为55%~65%。严格依照中华人民共和国《实验动物管理条例》执行。
1.1.2试剂与仪器设备:试剂:透明质酸钠(玻璃酸钠,山东博士伦福瑞达制药有限公司,批准文号:国药准字H10960136);CTX-I、TRACP5b、BALP的ELISA 试剂盒(编号号:7E2B2C3、7E2B2C5、7E2B2C9,广州皓跃生物科技有限公司);奥林巴斯光学显微镜(CX41,奥林巴斯,日本);MSE Micro-Centaur Centrifuge 微型台式离心机(LD5-10B,Sanyo,Japan);Micro-CT(型号:ZKKS-MCT-Sharp,广州中科恺盛医疗科技有限公司)。
1.2 实验方法
1.2.1实验分组与造模:将30只SD雌性大鼠采用随机统计学分成 3 组,每组10只,分别为:假手术组、OVX-ACLT 组(去卵巢-横断双侧膝关节前交叉韧带骨关节炎组)、治疗组(去卵巢-横断双侧膝关节前交叉韧带骨关节炎+透明质酸钠治疗组)。参照文献[11]:OVX-ACLT 组及治疗组均采用去卵巢+横断大鼠的双膝关节前交叉韧带方法(OVX-ACLT术)建立骨质疏松合并OA动物模型。术后每只动物予青霉素4万U肌肉注射2周,预防性抗感染治疗。术后2周,治疗组:双侧膝透明质酸钠50μg[12]关节腔注射,每周 1 次,共治疗12 周;ACLT 组:双膝等量生理盐水,关节腔注射,每周 1次,共治疗12 周;假手术组:不做任何特殊处理。实验期间所有的大鼠均是自由活动和摄食饮水。
1.2.2标本采集及处理:每组实验动物于治疗12周后取血,颈椎脱臼法处死,留取标本。眼眶静脉丛取血约3~5 mL,血液予以离心机离心后,取上层血清,保存于约-80 ℃冰箱中。取左侧胫骨近端,钝性分离软组织,生理盐水反复冲洗后,切片后行番红固绿HE染色。取右侧胫骨近端置于 40 g/L多聚甲醛中固定,保存送检。

图1 3组CTX-I、TRACP5b、BALP浓度比较Fig.1 Comparison of CTX-I, TRACP5b, and BALP concentrations among the three groups
1.2.3血清 CTX- Ⅰ、TRACP5b、BALP检测:使用ELISA测定 CTX- Ⅰ、TRACP5b、BALP等指标(应用双抗体一步夹心法酶联免疫吸附试验)。
1.2.4组织形态学观察及 Mankin 评分:对左侧胫骨近端软骨组织切片后行番红固绿染色。按照改良 Mankin评分标准[13],分别从软骨组织结构、细胞数量、AB-PAS染色情况、潮线改变等评估关节损伤程度。其中 0~1 分为正常,2~5 分为轻度,6~9 分为中度,10~14 分为重度。
1.2.5Micro-CT技术观察软骨下骨:将固定于40 g/L多聚甲醛大鼠右侧胫骨近端软骨下骨取出后置于Micro-CT设备中进行检测。分别从骨体积分数(bone volume fraction,BV/TV)、骨小梁厚度(trabecular thickness,Tb.Th)、骨小梁数量(trabecular number,Tb.N)、骨小梁分离度(trabecular separation,Tb.Sp)等方面对软骨下骨行定量分析。
1.3 统计学处理
2 结果
2.1 3组血清 CTX-Ⅰ、TRACP5b、BALP浓度比较
术12 周与假手术组比较,OVX-ACLT组中CTX-I、TRACP5b、BALP水平显然高于假手术组(P<0.01、P<0.05、P<0.05);治疗组中CTX-I、TRACP5b、BALP水平显然低于OVX-ACLT组(P<0.05、P<0.05、P<0.05)。见图1。
2.2 光镜下3组软骨形态学及软骨Mankin评分比较
假手术组:软骨细胞与基质分布均匀,潮线清晰连续,软骨表层光滑,软骨层面完整。OVX-ACLT组:软骨细胞与基质分布紊乱,潮线模糊不完整,软骨表层破坏,软骨组织缺失,裂隙增宽。治疗组:软骨组织结构排列尚有一定序列,可见潮线完整连续,软骨表层轻度粗糙,关节软骨轻微变窄。3组Mankin评分比较:OVX-ACLT组较假手术组明显增高(P<0.01);治疗组较OVX-ACLT组明显减低(P<0.01)。见图2、表1。
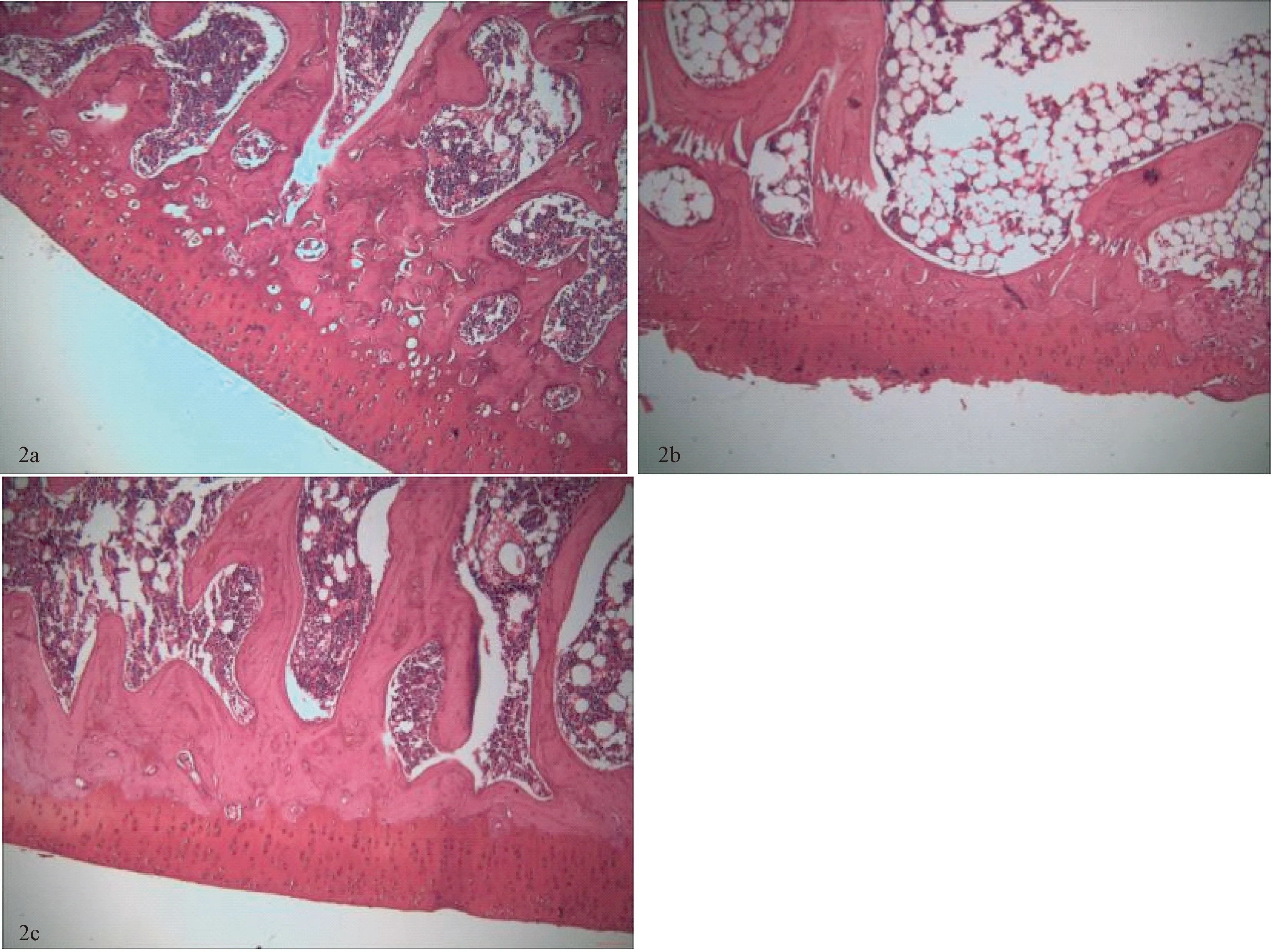
图2 3组软骨组织形态学比较(番红染色 ×10)Fig.2 Comparison of cartilage tissue morphology among the three groups (saffron-stained, 10×)a.Sham-operated group; b.ACLT group;c.Treatment group.
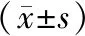


组别Mankin评分假手术组0.96±0.71OVX-ACLT组8.89±1.67∗治疗组2.56±1.42#
注:与假手术组比较,*P<0.01;与 OVX-ACLT组比较,#P<0.01。
2.3 3组胫骨近端软骨下骨Micro-CT比较及骨量分析
通过胫骨近端软骨下骨Micro-CT比较及骨量分析可见:治疗后12周,OVX-ACLT组的BV/TV、Tb.N值较假手术组明显降低(分别P<0.01、P<0.01),而Tb.Sp值较假手术组明显增高(P<0.01),Tb.Th两组对比差异无统计学意义(P>0.05)。治疗组的BV/TV、Tb.N值较OVX-ACLT组明显增高(分别P<0.01、P<0.01),而Tb.Sp值较OVX-ACLT组明显减低(P<0.01),Tb.Th两组对比差异无统计学意义(P>0.05)。见图3、图4。

图3 软骨下骨显微CT图像a.假手术组 b.OVX-ACLT组 c.治疗组。Fig.3 Image of subchondral bone under micro-CTa.sham-operation group; b.OVX-ACLT group; c.treatment group.
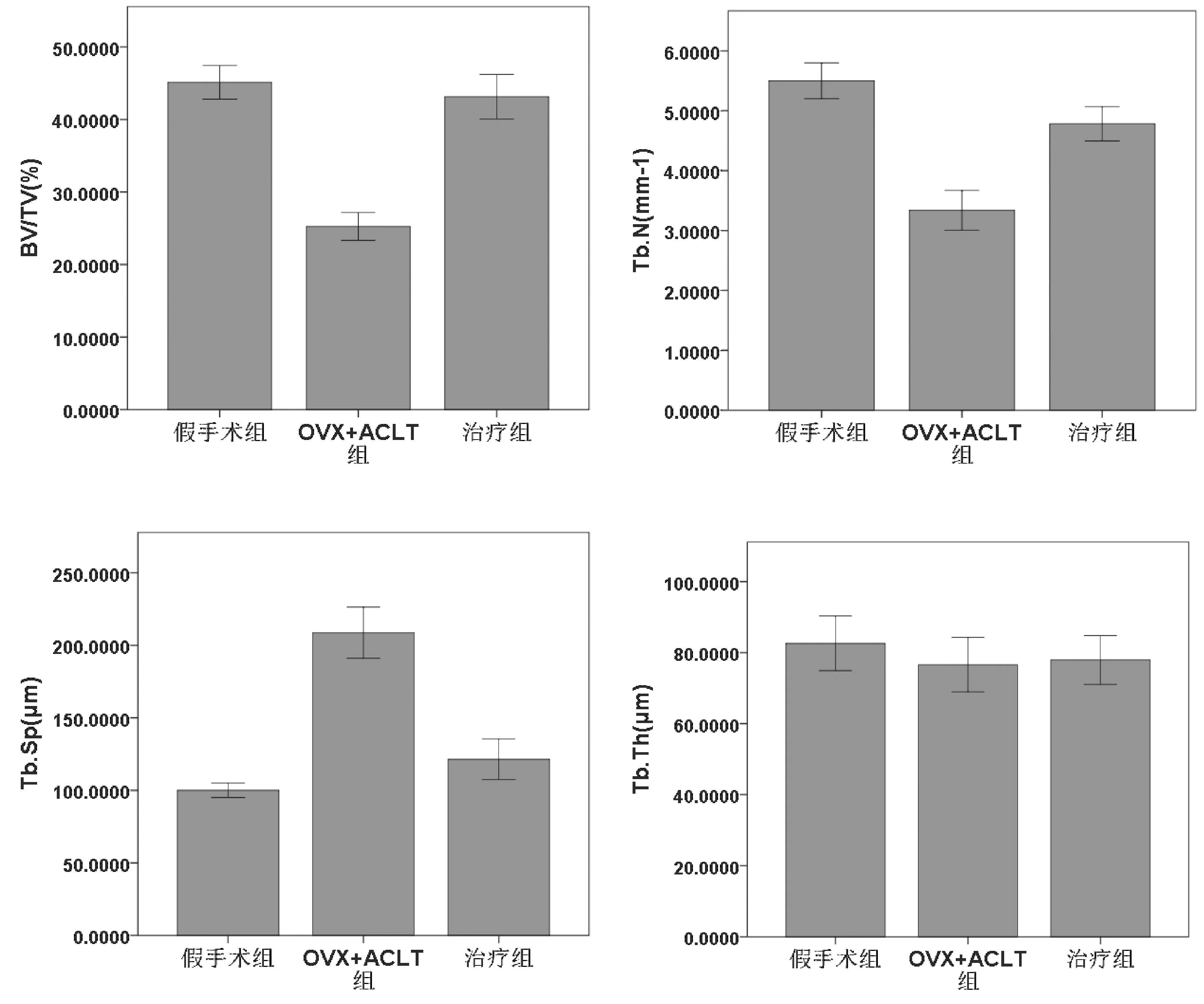
图4 3组胫骨近端软骨下骨定量分析Fig.4 Quantitative analysis of subchondral bone of the proximal tibia in the three groups
3 讨论
OA现在被认为是一种全局性的关节衰竭,涉及关节的所有组织:软骨、滑膜和软骨下骨[14]。近年来,许多研究集中在软骨下骨在该病病理生理特征中的作用。软骨下骨是几种动态形态改变的场所,涉及一个重建进程[15]。在OA中,软骨下骨表现为骨吸收和骨形成的加速期[16],这些变化与成骨细胞代谢的改变有关,从而导致可溶性介质的异常生成。这种由骨细胞产生的介质可以通过骨软骨界面影响深层软骨细胞[17]。临床上,症状性OA患者软骨下骨层面MRI上显示更多的骨质病变,从而强化了软骨下骨的中心作用假说。因此,软骨下骨细胞可作为治疗OA和减少软骨降解的靶点。为了评价软骨下骨成骨细胞在OA过程中的作用,我们将在大鼠体内建立表现OA和骨量丢失的模型(即OVX-ACLT),为透明质酸治疗OA机制提供新的科学证据。
临床和流行病学研究表明,绝经后女性因雌激素水平的急剧下降,致使OA的发病率和严重程度均增加[18]。在基础实验中已有证据表明,动物前交叉韧带横断结合去卵巢完全可以建立OA合并骨质疏松的体内模型,并模拟绝经后OA发生、发展的病理过程[11,19]。而且Bellido等[20]研究发现,OVX-ACLT模型组的软骨损伤程度明显高于单纯ACLT横断OA模型组。本实验发现OVX-ACLT组软骨Mankin评分较假手术组的显然增高,镜下可见软骨细胞与基质分布紊乱,潮线模糊不完整,软骨表层破坏,软骨组织缺失,裂隙增宽,表明软骨严重受损。而通过Micro-CT图像显示:OVX-ACLT组软骨下骨较假手术组明显骨小梁连接稀疏、结构错乱、分布面积窄,同时骨量分析可看出OVX-ACLT组BV/TV、Tb.N值较假手术组明显减低,而Tb.Sp显然增高,提示OVX-ACLT组骨组织密度减低,说明存在骨质疏松现象。与此同时,OVX-ACLT组中血清TRACP5b、BALP值明显高于假手术组,而TRACP5b、BALP可作为骨质代谢变化的敏感指标[21-22],其值往往与骨密度表现为负相关性,表明OVX-ACLT组骨量丢失。本实验通过大鼠前交叉韧带横断与去卵巢成功建立OA合并骨质疏松的体内模型,并模拟了绝经后相关OA的病理生理过程。
骨质疏松主要以骨量的丢失、骨微结构破坏为主,本实验发现软骨下骨已存在骨质疏松现象。而软骨下骨作用于软骨的主要功能是为软骨吸收应力、缓冲震荡防止软骨损伤和撑持软骨形状使其受力匀称,从而影响软骨细胞的代谢等[23]。当骨质疏松发生时,致使软骨下骨骨代谢重建失常,削弱了对软骨吸收应力的能力,导致过量的应力传导使软骨损伤,从而促进了OA的发病进程[24]。已有研究报道,骨质疏松致使软骨下骨骨量的丢失,会加速软骨的损伤,对OA的发生及发展起到重要作用[15,25]。因此在OA发生及进展中软骨下骨的异常改变发挥重要作用,其可作为OA预防及治疗的新靶点[26]。
透明质酸为大分子链状糖胺多糖,广泛分布于软骨细胞和滑膜细胞中,作为关节软骨的润滑剂,屏障和缓冲剂,可防止软骨损伤或变性,从而延缓OA的进程[27]。国内外大量的研究,已基本明确HA对软骨的保护及修复作用[3,28]。另有研究表明,HA能穿透OA软骨外植体并与软骨细胞结合[29]。Hiraoka等[30]发现荧光透明质酸在兔OA模型关节内注射后,被发现穿透软骨下骨。在OA关节中,软骨和软骨下骨之间出现血管化和微裂纹,允许物质直接在软骨和软骨下骨之间移动[31]。Mladenovic等[32]发现HA可能调控RANKL/RANK/OPG信号通路影响软骨下骨的骨吸收和骨形成,从而影响软骨下骨骨重建,维持软骨下骨中破骨细胞和成骨细胞的代谢动态平衡,使软骨下骨保持正常的生物力学性能,从而抑制关节软骨退变。同时,HA还可以通过与CD44结合来抑制基质金属蛋白酶-13(matrix metalloproteases 13,MMP-13)的表达来保护软骨下骨的微结构,从而抑制软骨退变[30,32]。CTX-Ⅰ是胶原蛋白降解的衍生物,它也是骨代谢指标重要指标之一,可间接反映软骨下骨的活性。本实验发现,OVX-ACLT组CTX-I水平较假手术组显然增高,而治疗组较OVX-ACLT组显然降低,与此同时,治疗组中TRACP5b、BALP值也较OVX-ACLT组减低,说明通过关节腔注射HA后可防止软骨下骨骨量过分的丢失,维持软骨下骨强度,为关节软骨提供生物力学支撑。而在Micro-CT图像显示:治疗组胫骨近端软骨下骨较OVX-ACLT组骨小梁连接紧密、结构规律、分布面积广,在骨量分析可看出治疗组BV/TV、Tb.N值较OVX-ACLT组明显增高,而Tb.Sp显然降低,说明关节腔注射HA可以改善软骨下骨的骨质疏松现象,改变软骨下骨显微结构,减少软骨的应力负荷。此外,通过关节腔注射HA改善软骨下骨后,治疗组较OVX+ACLT组中软骨Mankin评分显然减低,有效的抑制了软骨退变。
综上,利用SD大鼠前交叉韧带横断与去卵巢可成功建立OA合并骨质疏松的体内模型,并模拟绝经后相关OA的病理生理过程。本实验通过关节腔注射HA治疗OA可有效地改善骨小梁的结构,增强软骨下骨硬度和强度,使软骨下骨的顺应性加强,从而减少软骨的应力吸收,防止软骨的损伤。虽然对于HA具体如何作用软骨下骨达到治疗OA的效果机制尚未明确,但软骨下骨在OA的发生、发展的病理变化中扮演着重要角色,其可作药物治疗OA潜在靶点。
