2型糖尿病性骨质疏松大鼠ADSCs成骨能力的研究
2019-10-17谭伟源陈军平宋若愚陈诗迪
谭伟源 陈军平 宋若愚 陈诗迪
遵义医科大学第五附属(珠海)医院骨二科,广东 珠海 519100
糖尿病性骨质疏松(diabetic osteoporosis,DOP)是继发性骨质疏松症的一种,亦是糖尿病严重的骨骼并发症[1],是因糖尿病所并发的骨量减少、骨组织微结构异常、骨脆性增加并且易发生骨折的一种全身性、代谢性骨病[2]。有研究指出,糖尿病患者中合并有骨质疏松的比例可达50%以上[3]。DOP的发病率呈逐年上升趋势,其高致残率大大降低患者的生活质量,同时也带来极大的社会经济负担[4]。目前DOP的治疗主要以控制血糖及抗骨质疏松治疗为主,寻求更有效的、专门针对DOP的治疗方法是目前DOP研究的重点[5]。干细胞治疗技术的发展为DOP的治疗带来曙光。脂肪干细胞(adipose-derived mesenchymal stem cells,ADSCs)是一种获取容易、来源丰富的干细胞,已被用于多种疾病的治疗[6],有学者指出自体ADSCs移植可用于骨质疏松的治疗,并得到良好的疗效[7]。但DOP个体自身的ADSCs成骨能力如何,能否应用于DOP的治疗,目前相关的研究较欠缺。于2018年4月至2019年1月,本研究观察了2型糖尿病性骨质疏松大鼠ADSCs的体外成骨能力,旨在探讨DOP患者应用自体ADSCs治疗DOP的可能性,为未来本方向医学领域的发展提供借鉴,现报道如下。
1 材料与方法
1.1 材料
动物:健康12周龄SD大鼠60只,雌性,体重210~230 g,由广东省实验动物中心提供,许可证号:SCXK(粤)2013-0002。各大鼠分笼饲养,自由饮食。主要实验试剂:DMEM高糖液体培养基、胎牛血清、青-链霉素双抗(广州玺美生物科技有限公司);Trizol (美国Invitrogen公司);链脲霉素(streptozocin,STZ)(Sigama公司);RT-PCR试剂盒(TAKARA公司)。主要实验器材:Hema9600基因扩增仪(珠海黑马医学仪器有限公司);微量分光光度计K2800(北京凯奥科技有限公司);双能X线骨密度仪OSTEOCORE(法国MEDILINK)。
1.2 DOP及OP大鼠模型的建立
60只SD大鼠随机分为对照组、骨质疏松组(OP组)、2型糖尿病性骨质疏松组(DOP组)3组,每组20只。DOP组大鼠适应环境饲养1周后,给予高糖高脂饲料喂养,连续喂养8周后,禁食12 h,于大鼠左下腹部经腹腔注射2% STZ 30 mg/kg,每两周注射1次,共两次。于最后一次注射STZ 72 h后于大鼠尾静脉取血,采用血糖检测仪测量空腹血糖值,血糖≥16.7 mmol/L为2型糖尿病大鼠模型造模成功[8]。2型糖尿病大鼠造模成功后,各大鼠给予10%水合氯醛1.5 mL/kg,经腹腔注射麻醉,麻醉满意后,腹正中切开切除大鼠双侧卵巢。卵巢切除术后各大鼠每天肌注青霉素钠(5万U / d)预防感染,连续3 d。OP组大鼠同法切除双侧卵巢,对照组同法仅切除双侧卵巢周围脂肪。3组大鼠正常饲养3个月后,使用双能X线骨密仪测定各组大鼠腰4、5椎骨密度(bone mineral density,BMD),以BMD<对照组BMD均值的2.5个标准差确认OP组骨质疏松大鼠模型及DOP组2型DOP大鼠模型建立成功[9]。建模完成后,对照组随机选取10只大鼠,DOP组及OP组从建模成功的大鼠中各随机选取10只作研究。
1.3 大鼠脂肪干细胞的分离与传代
将3组各大鼠分别用10%水合氯醛经腹腔注射充分麻醉后,取仰卧位,剪除双侧腹股沟区鼠毛,消毒铺洞巾,每只大鼠切除腹股沟区脂肪组织约2 g,剔去脂肪组织中可见的血管及浅筋膜,予PBS液多次清冼后剪至糊状。用0.1%Ⅰ型胶原酶消化后离心,弃上清液后加入完全培养基重悬,将细胞悬液置于T25培养瓶中接种,于细胞培养箱(37 ℃、5% CO2)中培养。2 d后首次换液,此后每3天换液。每天使用倒置显微镜观察各组大鼠ADSCs生长情况,当细胞汇合度达80%时,进行传代,取各组大鼠第3代ADSCs备用。应用CCK-8法检测3组大鼠第3代ADSCs增殖情况,酶标仪检测3组ADSCs 450 nm处吸光度,计算光密度(optical density,OD)值,连续检测10 h。以天数为横轴,OD值为纵轴绘制第3代ADSCs生长曲线。
1.4 各组大鼠ADSCs成骨能力测定
1.4.1ADSCs成骨结节染色及定量分析:取各组大鼠第3代ADSCs接种于6孔板,密度为1×105/孔,无菌载玻片覆盖。细胞培养至汇合度达80%时,加入成骨诱导液(高糖DMEM液体培养基+10%胎牛血清+1%青-链霉素双抗+1 mol/L地塞米松+50 mmol/L抗坏血酸+10 mmol/Lβ-甘油磷酸钠)置于细胞培养箱(37 ℃、5% CO2)中培养,每3天换液1次,在成骨诱导13 d后行茜素红染色,倒置显微镜下观察成骨钙结节并拍照。拍照后,使用氯化十六烷基吡啶析出成骨结节中与茜素红结合的钙离子,应用酶标仪检测3组ADSCs 620 nm处的OD值,以OD值作成骨定量分析。

图1 大鼠原代ADSCs生长情况(×100)Fig.1 Growth of primary generation ADSCs in rats of three groups (× 100)
1.4.2RT-PCR检测各组大鼠ADSCs成骨相关基因的表达:取各组大鼠经成骨诱导后的第3代ADSCs,予PBS液冲冼3次后,加入至含Trizol液的离心管,经相分离、RNA沉淀洗涤及溶解提取ADSCs总RNA,检测纯度合格后反转录成cDNA,以ACTB作为内参,在荧光定量仪上使用实时PCR试剂盒进行PCR反应,检测各组ADSCs成骨相关基因mRNA的表达,包括:核心结合因子(runt-related transcription factor 2,RUNX2)、骨钙蛋白(osteocalcin,OCN)、骨桥蛋白(osteopontin,OPN)、碱性磷酸酶(alkaline phosphatase,ALP)。各基因引物由苏州泓迅生物科技有限公司设计及合成,各引物序列为:RUNX2上游引物:5′-CGCCTCACAAACAACCACAG-3′,RUNX2下游引物:5′-AATGACTCGGTTGGTCTCGG-3′;OCN上游引物:5′-CAACCCCAATTGTGACGAGC-3′,OCN下游引物:5′-AACGGTGGTGCCATAGATGC-3′;OPN上游引物:5′-AGACTGGCAGTGGTTTGCTT-3′,OPN下游引物:5′-AGTGTTTGCTGTAATGCGCC-3′;ALP上游引物:5′-CGTTTTCACGTTTGGTGGCT-3′,ALP下游引物:5′-ACCGTCCACCACCTTGTAAC-3′;内参基因ACTB上游引物:5′-CCCTAAGGCCAACCGTGAAAA-3′,下游引物:5′-GTACGACCAGGCATACAGG-3′。PCR反应条件为:95 ℃预变性3 min,95 ℃变性25 s,60 ℃退火35 s,共40个循环。应用2-ΔΔCT法计算各基因的表达量。
1.5 统计学处理
2 结果
2.1 DOP及OP大鼠模型建立情况
20只DOP组大鼠经腹腔注射2% STZ后共19只发生2型糖尿病,19只2型糖尿病大鼠行卵巢切除术后共有15只出现骨质疏松,共15只DOP大鼠建模成功,符合入组条件,从中随机选取10只建模成功的DOP大鼠作研究;20只OP组大鼠行卵巢切除术后共有12只出现骨质疏松,符合入组条件,从中随机选取10只建模成功的OP组大鼠作研究;对照组中随机选取10只大鼠入组作研究。3组大鼠在造模过程中均未出现死亡。
2.2 3组大鼠造模后骨密度情况
造模后DOP组大鼠与OP组大鼠BMD明显低于对照组(P<0.05),并且DOP组大鼠BMD更明显低于OP组(P<0.05)(见表1)。
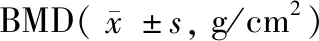

组别nBMD对照组100.325±0.017OP组100.193±0.021∗DOP组100.157±0.015∗#
注:与对照组比较,*P<0.05;与OP组比较,#P<0.05。
2.3 3组大鼠ADSCs的生物活性
显微镜下观察3组大鼠的ADSCs原代细胞生长情况,发现接种于培养瓶后12 h开始贴壁,约24 h全部贴壁。3组大鼠ADSCs生长状态良好,外观无明显差异,均呈现长梭型,边缘透明,胞内无深色颗粒和杂点,细胞外环境无漂浮深色颗粒及细胞碎片(见图1)。经消化、传代,绘制第3代ADSCs生长曲线,见3组ADSCs均于前两天缓慢增长,于第三天起增殖速度加快,4至6 d DOP组与OP组细胞增殖速度较对照组快,于6天后细胞增殖平缓,至第10天3组细胞均铺满培养瓶瓶底(见图2)。
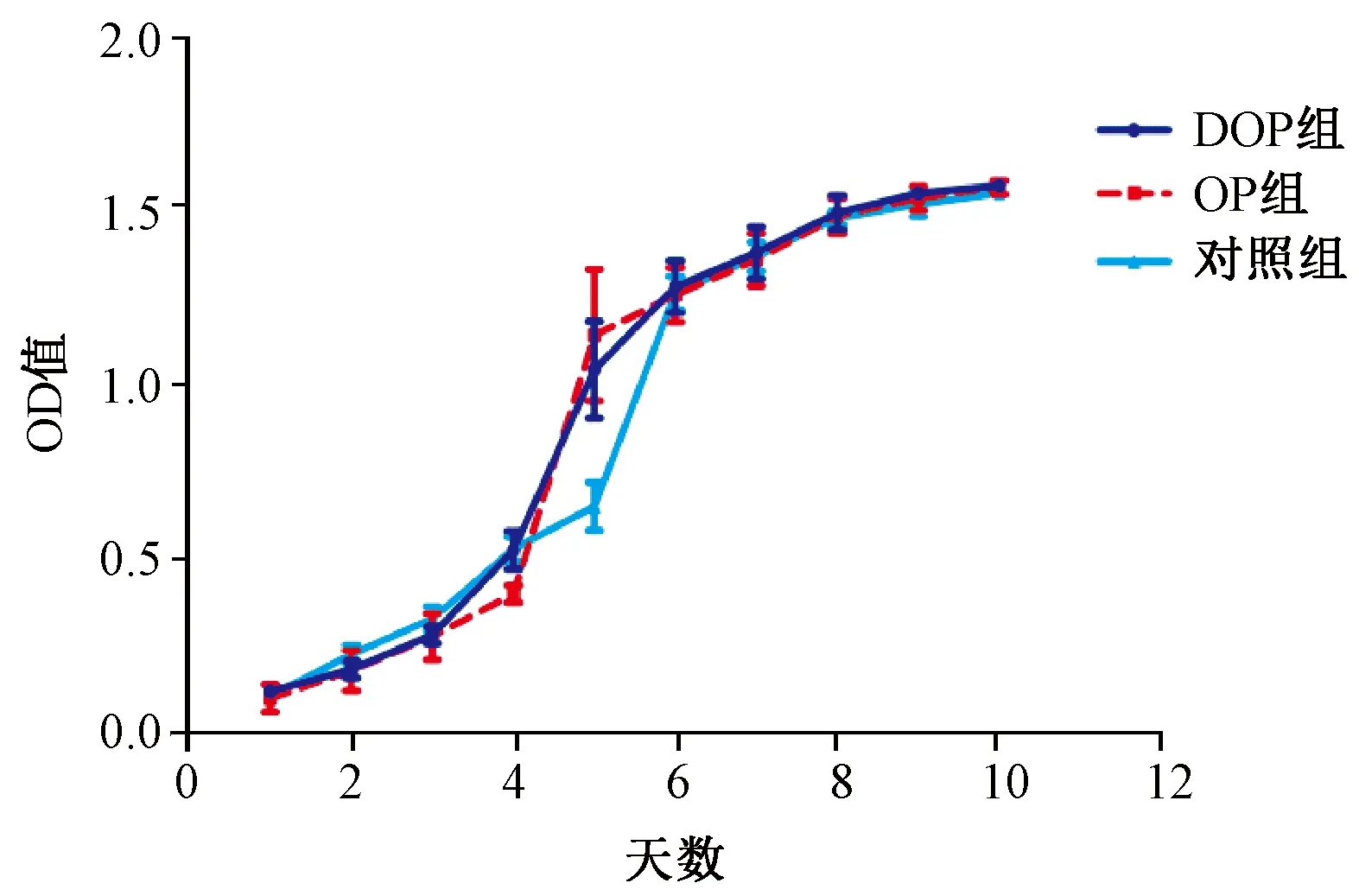
图2 3组大鼠第三代ADSCs生长曲线Fig.2 Growth curves of the third generation ADSCs in rats of three groups
2.4 3组大鼠ADSCs成骨结节检测
3组大鼠第3代ADSCs在成骨诱导13 d后进行茜素红染色,显微镜下可见DOP组与OP组大鼠的钙化结节量较对照组少,DOP组钙化结节最少,并且缺少大片状结节,染色较浅(见图3)。从成骨定量分析结果可见,DOP组与OP组的OD值均低于对照组(P<0.05),并且DOP组明显低于OP组(P<0.05)(见表2)。
2.5 RT-PCR检测三组ADSCs成骨相关基因的表达
于成骨诱导13 d后,RT-PCR检测3组ADSCs成骨基因RUNX2、OCN、OPN、ALP mRNA的表达,DOP组与OP组四基因mRNA的表达量均低于对照组,差异有统计学意义(P<0.05);DOP组与OP组相比较,OCN与OPNmRNA的表达量无明显差异(P>0.05),而DOP组RUNX2与ALPmRNA的表达量明显低于OP组(P<0.05)(见表3)。

表3 成骨诱导后各组ADSCs成骨相关基因mRNA的表达Table 3 Osteogenesis-related gene expression of ADSCs in each group after osteogenesis
注:与对照组比较,*P<0.05;与OP组比较,#P<0.05。

图3 三组大鼠第三代ADSCs成骨诱导后茜素红染色结果Fig.3 Alizarin red staining after osteogenic induction of the third generation of ADSCs in rats of three groups



组别nOD值(620 nm)对照组100.143±0.032OP组100.097±0.015∗DOP组100.053±0.011∗#
注:与对照组比较,*P<0.05;与OP组比较,#P<0.05。
3 讨论
随着2型糖尿病发病率的逐年增高,DOP在临床上也愈发常见[10]。DOP的发病机制目前仍未完全明确,目前考虑与糖尿病高血糖状态下出现骨代谢异常、成骨细胞活性减弱、破骨细胞活增强、血钙水平下降等方面有关[11]。本研究采用喂食高脂高糖饲料加腹腔注射STZ联合双侧卵巢切除术的方法成功建立2型DOP大鼠,从造模腰椎骨密度检测结果可得,DOP组大鼠BMD明显低于OP组,说明高血糖状态下出现骨质疏松骨量丢失会更严重,糖尿病性骨质疏松比单纯骨质疏松具有更大的危害性。进一步明确DOP的发病机制,寻找有效的防治DOP的方法刻不容缓。
目前,已有研究表明通过移植自体ADSCs对2型糖尿病有一定治疗作用[12-13],亦有学者通过实验得出经静脉移植ADSCs能减少单纯骨质疏松大鼠的骨量丢失[14]。但DOP患者同时存在糖尿病和骨质疏松症两种病理状态,其自身ADSCs成骨分化能力是否比单纯OP差,应用自体ADSCs干预DOP能否也能起到一定作用,目前相关的研究尚欠缺。本研究将DOP组大鼠ADSCs成骨分化情况与OP组、对照组作比较,探讨2型DOP大鼠ADSCs成骨分化的能力,从而为应用自体ADSCs移植治疗2型DOP打下基础。
从研究结果可得,从DOP组大鼠脂肪组织中可成功分离并传代 ADSCs,并且DOP组ADSCs细胞形态和增殖情况与OP组、对照组无明显差异,提示从DOP大鼠中可提取丰富的ADSCs。但从成骨诱导后显微镜下观察结果及定量分析结果可得,DOP组大鼠ADSCs的成骨分化能力要低于对照组,甚至低于单纯OP组。从RT-PCR检测3组ADSCs成骨基因表达的结果可得,DOP组与OP组RUNX2、OCN、OPN、ALP mRNA的表达量均低于对照组,并且DOP组与OP组作比较,DOP组RUNX2与ALP mRNA的表达量明显低于OP组,进一步体现了DOP组ADSCs的成骨分化能力要低于OP组,为3组中最弱。进一步分析RT-PCR结果可得,DOP组与OP组OCN、OPN mRNA的表达量并无明显差异,可以推测两组ADSCs成骨能力的差异可能与RUNX2、ALP的表达水平密切相关。ALP与RUNX2均是反映干细胞早期成骨能力的重要基因[15]。ALP是细胞早期成骨的重要标志物,其表达量影响着骨代谢的发生发展[16]。RUNX2则是影响干细胞成骨分化的特异转录因子,可促进细胞成骨分化及诱导软骨形成[17-18]。RUNX2和ALP基因目前被认为对干细胞的成骨能力具有重大作用[19],以二者为核心的信号通路直接控制骨组织的建立[20]。从PCR结果可以推测,DOP组在高血糖状态下自身ADSCs中RUNX2、ALP基因会较OP组进一步降低,这可能是DOP组ADSCs成骨能力弱于OP组的直接原因,通过上调ADSCs中RUNX2、ALP的表达有望提高其成骨分化能力,从而为DOP患者自体ADSCs移植治疗带来希望。至于2型DOP大鼠体内存在何种机制能够加重ALP和RUNX2基因水平的急剧下调,这需要进一步研究探讨。
综上所述,2型DOP大鼠ADSCs体外成骨分化能力较弱,弱于单纯骨质疏松大鼠,原因可能与高血糖状态下其ADSCs中ALP和RUNX2的表达进一步减少有关。单纯移植自体ADSCs干预自身DOP可能疗效较差,提高其ADSCs成骨分化能力,未来有望实现应用自体ADSCs完成自身DOP的治疗。
