弓形虫ROP16Ⅰ/Ⅲ蛋白对小鼠子宫基质细胞蜕膜化的影响
2019-10-16计永胜汪学龙
金 郁,计永胜,姚 湧,汪学龙
胚胎植入是一个复杂的过程,涉及到子宫与胚胎之间精确的相互作用。当胚胎附着在子宫内膜上后,在植入部位的基质细胞开始发生蜕膜化[1]。子宫蜕膜化对胚胎的植入和妊娠的维持至关重要。如果产妇子宫不经过蜕膜化,胚胎就不会正常发育。小鼠子宫蜕膜细胞在胚胎植入后以有序的凋亡和增殖来适应其快速生长发育的需要,现已证明,蜕膜细胞的增殖与退化是一个涉及多种因素的细胞凋亡过程[2-3]。在这个过程中,子宫内膜基质的增殖和凋亡需要严格遵循时空的发展。有研究[4]显示,小鼠子宫基质细胞蜕膜化过程中的凋亡受到促进和抑制作用,都会导致蜕膜化的异常,导致着床位点的减少,引起着床的失败。
刚地弓形虫(Toxoplasmagondii)是一种属于真球虫目(Eucoccidiorid)、弓形虫科(Toxoplasmatidae)、弓形虫属(Toxoplasma)的专性细胞内寄生原虫,根据虫体对小鼠毒力的差异可以将弓形虫分为3型。弓形虫ROP16蛋白同样在不同虫株间存在多态性。I型和III型虫株(如RH、CTG)ROP16Ⅰ/Ⅲ蛋白可以通过直接和宿主细胞的STAT3结合,磷酸化STAT 705位的酪氨酸。目前有研究[5]表明其对宿主细胞的凋亡具有抑制作用。同时,ROP16Ⅰ/Ⅲ会诱导人神经母细胞瘤发生凋亡[6]。而ROP16Ⅰ/Ⅲ对于蜕膜细胞的影响鲜有报道。该实验通过ROP16Ⅰ/Ⅲ慢病毒感染原代小鼠蜕膜细胞,检测凋亡相关指标,探讨弓形虫ROP16蛋白对妊娠小鼠子宫基质细胞蜕膜化的影响。
1 材料与方法
1.1 主要试剂与实验动物
1.1.1主要试剂 DMEM/F12培养基购自美国HYCLONE公司;BCA蛋白浓度测定试剂盒、SDS-PAGE试剂盒、RIPA裂解液、一抗稀释液、ECL Kit化学发光试剂盒均购自南京碧云天生物技术公司;胶原酶Ⅱ、NC膜均购自美国Sigma公司;Western blot所用一抗anti-Bax、anti-Bcl-2、anti-Caspase3均购自美国Cell Signaling公司;二抗HRP羊抗兔、免疫荧光一抗anti-Vimentin、二抗羊抗兔均购自武汉博士德公司;流式细胞术凋亡试剂盒购自美国BD公司;E2、P4、cAMP试剂购自美国阿拉丁公司。
1.1.2实验动物 6~8周龄清洁级昆明小鼠均为性成熟雌、雄鼠,由济南朋悦实验动物繁育有限公司提供。小鼠的饲养以安徽医科大学实验动物使用指南为标准,符合动物伦理相关准则。雌、雄鼠按2 ∶1合笼,次晨发现阴栓者记为孕D0。
1.2 小鼠子宫基质细胞的原代培养取孕D4的雌鼠的子宫,剪净系膜和多余脂肪,放入培养皿,用PBS冲洗2次后,将子宫剪碎,过程中可适当加入少量胰酶继续剪,最终以约1只0.7 ml的体积加入胰酶。将加好酶液的培养皿在4 ℃放置1 h,再室温1 h,然后用含10% FBS的培养液终止消化,转入15 ml离心管,500 r/min离心5 min。然后用PBS洗涤沉淀1次,500 r/min离心5 min,弃上清液,然后加入配好的0.5%胶原酶Ⅳ,混匀,放入恒温摇床,37 ℃消化30 min。然后终止消化,将组织液依次通过200目和400目的灭菌过滤网,收集滤液到50 ml的离心管,1 500 r/min离心5 min后用PBS洗涤沉淀,后1 500 r/min离心5 min,弃上清液。加入含FBS的DMEM/F12培养基,重悬沉淀,计数后以1×105个/ml接种于6孔板。将细胞在培养箱培养2 h,等基质细胞贴壁后换液去除杂细胞。
1.3 小鼠子宫基质细胞纯度鉴定将上述步骤取得的原代子宫基质细胞做细胞爬片,PBS洗3次,每次5 min,用4%多聚甲醛固定30 min后用PBS洗3次,用5%BSA封闭,37 ℃ 1 h,接着加入Vimentin抗体(1 ∶100)4 ℃孵育过夜,PBS洗3次。然后加荧光二抗(FITC标记二抗,1 ∶50),室温避光孵育1 h,PBS洗3次。最后加入DAPI染核(1 ∶25),室温15 min,PBS洗3次,加入荧光猝灭剂后封片。在荧光显微镜下观察细胞荧光信号。
1.4 ROP16Ⅰ/Ⅲ慢病毒感染小鼠子宫基质细胞并体外诱导蜕膜化培养小鼠原代子宫基质细胞24 h后,用ROP16Ⅰ/Ⅲ慢病毒进行细胞感染,实验分为空白对照组、空载慢病毒组和ROP16Ⅰ/Ⅲ慢病毒转染组。慢病毒转染24 h后在培养基中加入1 μmol/L孕激素(P4)、10 nmol/L雌二醇(E2)、0.5 mmol/L环磷酸腺苷(cAMP)进行蜕膜化诱导,镜下观察细胞形态变化。并接着培养48 h,分别收集0、24、48 h的蜕膜细胞,提取细胞总RNA,逆转录成cDNA,实时荧光定量PCR荧光染料法,以β-actin为内参,以比较Ct值法进行相对定量,观察催乳素(prolactin,PRL) mRNA表达水平。PRL基因上游引物为5′-CTCCTCCTGTTGCTGA-3′,下游引物为5′-CAGTCGG GTCTTTCCC-3′,扩增长度为362 bp。内参基因β-actin上游引物为5′-AGCCATGTACGTAGCCATCC-3′,下游引物为5′-CTCTCAGCTGTGGTGGTGAA-3′, 扩增长度为228 bp。
1.5 流式细胞术检测细胞凋亡小鼠子宫基质细胞在转染ROP16Ⅰ/Ⅲ慢病毒并体外诱导蜕膜化72 h后,收集各组细胞,用胰酶消化下来后,用PBS和缓冲液依次洗涤后按凋亡试剂盒说明书染色,用流式细胞仪检测各组凋亡率。
1.6 Western blot法检测Bax、Bcl-2蛋白表达水平收集细胞总蛋白,用SDS-PAGE电泳分离蛋白(20 μg/孔),转至PVDF膜,按顺序孵育抗体(一抗浓度均为1 ∶1 000,二抗浓度为1 ∶5 000),显色。
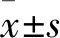
2 结果
2.1 细胞纯度鉴定采用免疫荧光方法检测小鼠子宫基质细胞波形蛋白的表达,鉴定其纯度,荧光显微镜下观察,Vimentin蛋白主要集中于胞质,产生绿色荧光,用DAPI染核,产生蓝紫色荧光。显微镜视野下随机选取5个不同区域,计数波形蛋白阳性细胞数与细胞总数之比,结果显示,提取的原代基质细胞纯度为(95±2.5)%。见图1。
2.2 成功诱导细胞蜕膜化在培养基中加入E2、P4和cAMP培养原代基质细胞,小鼠子宫基质细胞人工诱导蜕膜化后,分别在0、24、48 h测定PRL mRNA表达水平,结果显示,随着体外诱导蜕膜化时间的延长,PRL mRNA的表达会逐渐增加(P<0.05),说明体外诱导蜕膜化成功。见图2。
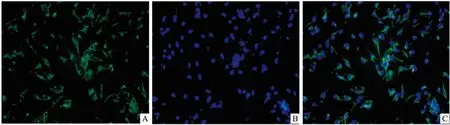
图1 小鼠子宫内膜基质细胞的鉴定 ×200
A:荧光显微镜下观察间质细胞标志物Vimentin蛋白;B:荧光显微镜下观察DAPI染色的细胞核;C:合并观察计数波形蛋白阳性细胞数与细胞总数
图2 小鼠子宫基质细胞体外诱导蜕膜化 ×200
A:明场下观察小鼠子宫基质细胞;B:经过体外诱导蜕膜化后,明场下观察蜕膜细胞;C:小鼠子宫基质细胞体外诱导蜕膜化qRT-PCR测定PRL mRNA表达;与24 h比较:*P<0.05,**P<0.01

图3 ROP16Ⅰ/Ⅲ重组慢病毒感染小鼠子宫基质细胞 ×200
A:明场下转染ROP16Ⅰ/Ⅲ过表达重组慢病毒的蜕膜基质细胞;B:荧光显微镜下转染ROP16Ⅰ/Ⅲ过表达重组慢病毒的蜕膜基质细胞;C:明场下转染空载病毒的蜕膜基质细胞;D:荧光显微镜下空载病毒转染的蜕膜基质细胞;E:明场下的蜕膜基质细胞;F:荧光显微镜下的蜕膜基质细胞
2.3 慢病毒成功转染蜕膜细胞培养的原代小鼠子宫基质细胞分别感染ROP16Ⅰ/Ⅲ基因过表达和空载LV慢病毒并体外诱导蜕膜化培养72 h后,显微镜下观察转染情况。见图3。
2.4 ROP16Ⅰ/Ⅲ对蜕膜细胞凋亡的影响流式细胞术结果显示:ROP16Ⅰ/Ⅲ过表达组的蜕膜细胞凋亡率相较于空载组(F=111.4,P<0.01)和对照组(F=49.1,P<0.01)降低。见图4。
2.5 Bax、Bcl-2蛋白表达Western blot法检测Bax、Bcl-2蛋白的表达水平后显示:各组细胞在培养72 h后,对照组和空载组的Bax、bcl-2蛋白表达没有明显差异,而ROP16Ⅰ/Ⅲ转染组Bax表达较对照组和空载组降低,Bcl-2表达较对照组和空载组则呈升高趋势,因此ROP16Ⅰ/Ⅲ转染组Bax/Bcl-2的值小于对照组(F=75.22,P<0.05)和空载组(F=51.13,P<0.05)。见图5。
3 讨论
胚泡和子宫是结构成分不同的两种组织,植入是胚胎与子宫建立生理联系的过程,是胚泡和子宫相互识别、黏附、容纳的过程,所以植入是妊娠过程中的一个关键环节,称为“植入窗口期”。植入过程中,子宫内膜和胚泡的滋养层都会发生一系列复杂的变化:植入位点的子宫内膜基质细胞首先会发生剧烈的增殖和分化,这种变化会逐渐延伸到整个子宫内膜。这些变化统称为子宫蜕膜化。

图4 各组基质细胞感染不同ROP16Ⅰ/Ⅲ慢病毒的凋亡率
A:ROP16Ⅰ/Ⅲ慢病毒转染组;B:阴性对照病毒组;C:对照组;D:各组凋亡率;与空载组比较:**P<0.01;与对照组比较:##P<0.01
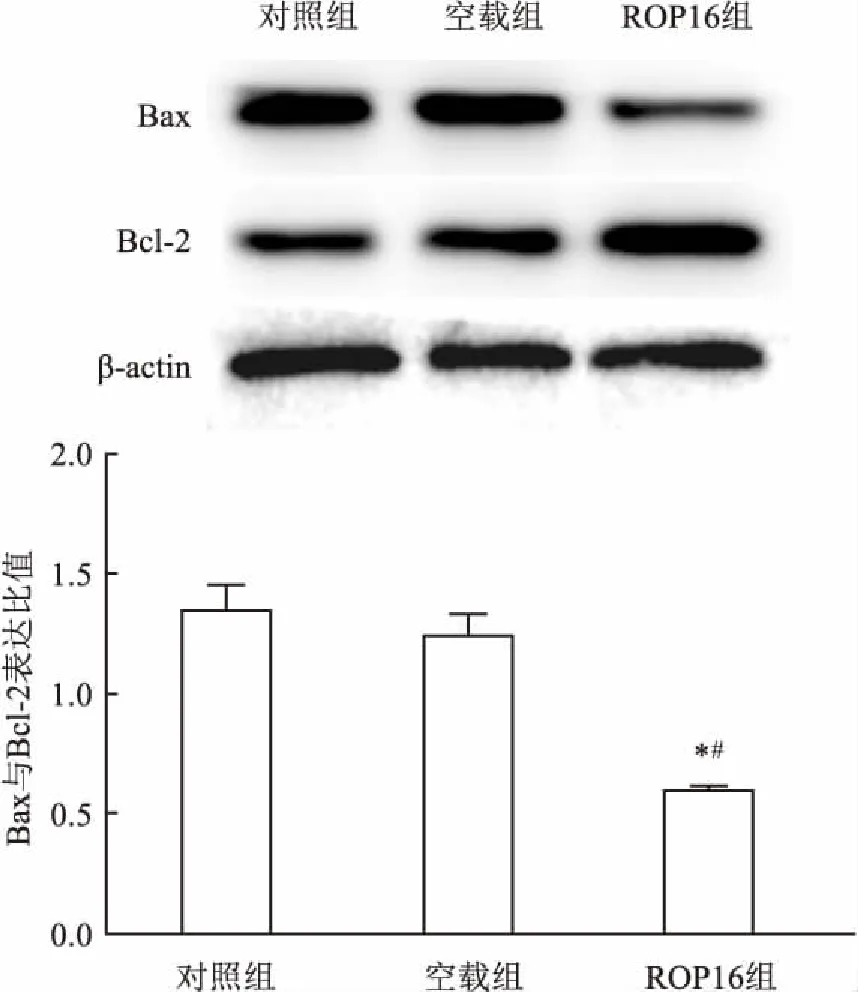
图5 Western blot法检测Bax和Bcl-2表达与空载组比较:*P<0.05;与对照组比较:#P<0.05
子宫内膜进行蜕膜化的过程中,首先与子宫内膜基质细胞的正常增殖密切相关[7]。当胚泡附着在子宫内膜上皮时,在附着位置周围的内膜上皮细胞会发生凋亡,而邻近的基质细胞则会进行广泛的增殖,增殖的基质细胞获得多倍性而分化成特殊的细胞类型,此时基质细胞会向着床位点周围扩展,逐步形成成熟的蜕膜细胞,然后随着胚泡的植入,又会按照相同的趋势持续退化和凋亡[8],并被周围的滋养层或巨噬细胞吞噬[9]。因为有了蜕膜化过程中细胞有序的增殖和退化,使胚泡周围的蜕膜细胞的数量得以控制,所以控制了滋养细胞的侵袭。在此过程中,小鼠子宫内膜基质细胞经历了形态学和分子水平的独特变化[10]。蜕膜化过程中,着床位点的蜕膜细胞停止增殖,终末分化后形成的区域称之为初级蜕膜区,第2次分化形成的区域称之为次级蜕膜区,最后次级蜕膜区的细胞也会发生凋亡,使着床位点的腔隙增大以便容纳生长的胚胎[11]。
在本实验中,在孕鼠胚胎着床的时间段成功分离培养了子宫内膜基质细胞,在体外培养的小鼠子宫基质细胞中过表达ROP16Ⅰ/Ⅲ蛋白,并体外诱导蜕膜化时,结果显示ROP16Ⅰ/Ⅲ蛋白上调了蜕膜细胞Bcl-2的表达并降低了Bax表达,抑制了蜕膜细胞的凋亡,提示可能导致初级蜕膜区的蜕膜细胞不能按照正常程序退化消失,同时段发育的胚胎不能获得足够相应的发展空间,同时,初级蜕膜区退化的受阻也会导致次级蜕膜区的发展受阻,也会导致接下来胚胎发展空间的受限,最终导致母胎界面的对话受到干扰,从而导致植入位点的数量减少,引起胚胎着床的不良结局。
ROP16Ⅰ/Ⅲ蛋白作为弓形虫重要毒力因子,具有丝氨酸、苏氨酸和酪氨酸激酶活性,参与宿主细胞内信号转录活化因子(STATs)相关的磷酸化[12]。由于ROP16Ⅰ/Ⅲ能磷酸化STAT3,两者作用后会从胞质中转移至细胞核引起下游转录因子改变,结果就会干预宿主细胞内信号通路传导[13-14]。磷酸化的STAT3进入细胞核内,直接与DNA结合,诱导抗凋亡蛋白(Bcl-xL、Mcl-1、survivin)的表达,所以STAT3通路的活化在多种细胞都有抗凋亡的作用[15]。 ROP16Ⅰ/Ⅲ蛋白可以通过磷酸化STAT3,介导细胞的凋亡变化。ROP16Ⅰ/Ⅲ蛋白在蜕膜细胞蜕膜化过程中抑制了细胞的凋亡,其中与细胞其他促凋亡因子之间的相互作用机制及信号通路和体内实验对于不良妊娠的验证是本研究下一步的研究方向和内容。
