KLK7在肝细胞癌中的表达及其意义
2019-10-16荚卫东葛勇胜
陈 康,荚卫东,葛勇胜,陈 新
肝细胞癌(hepatocellular carcinoma,HCC)是肝脏最常见的原发性恶性肿瘤,占全球肝癌总数的70%~85%,是世界范围内第五大常见肿瘤之一,也是全球癌症相关死亡的第二大原因。在过去的20年中,HCC的发病率增加了2倍,而5年生存率仍然低于12%[1],每年大约发生782 500例新病例和745 500死亡病例,仅中国的新生病例和死亡占总数的一半左右[2]。鉴于肝细胞癌发生是通过遗传、表观遗传和信号传导程序的复杂变化而产生的,HCC表现出广泛的异质分子特征[3],正是存在这种多样性,HCC细胞具有强大的细胞存活性和增殖表型。阐明HCC起始和进展的分子机制可以改善诊断和治疗策略。因此,迫切需要在该领域进行旨在鉴定可靠的早期诊断生物标志物和有效治疗选择的研究。
人激肽释放酶7(kallikrein related peptidase 7,KLK7),也曾被称为角质层胰凝乳蛋白酶(stratum corneur chymotryptic enzyme,SCCE),属于激肽释放酶相关肽酶家族,作为皮肤中最突出的蛋白酶之一,这种酶通过降解几种不同的底物而促进脱屑和皮肤免疫系统活化[4],因此它作为治疗皮肤病的潜在靶点而被广泛研究。然而在最近的报道中,KLK7在其他多种恶性肿瘤中显示出较高的研究价值,如研究人员发现KLK7在宫颈癌、结肠癌、胰腺癌等的肿瘤组织中表达上调,而在乳腺癌和肾癌中表达下调[5]。但在肝细胞癌研究中,尚未见国内外有相关文献报道,该研究旨在探讨KLK7在肝细胞癌中的临床病理学意义。
1 材料与方法
1.1 病例资料收集2015年1月~2017年12月于安徽医科大学附属省立医院肝脏外科行根治性肝细胞癌切除术,术后经病理确认且具备完整随访资料的88例石蜡切片,其中男68例,女20例;年龄20~73(52±12)岁;据Edmondson分级法标准行肿瘤分级,Ⅰ~Ⅱ级63例,Ⅲ~Ⅳ级25例;肿瘤TNM分期标准依据美国癌症联合会(AJCC)第八版标准,Ⅰ~Ⅱ期52例,Ⅲ~Ⅳ期36例。另外收集本院肝脏外科近期行根治性肝细胞癌切除术的新鲜冷冻HCC组织及其对应癌旁组织20对和TRIzol浸泡的HCC组织及其对应癌旁组织20对,行Western blot及qRT-PCR检测。所选患者术前未行放疗、化疗、介入等抗肿瘤治疗。
1.2 主要试剂KLK7 PAB910Hu01(武汉优尔生商贸有限公司);通用型二抗试剂盒PV-6000、DAB显色剂(北京中杉金桥生物技术有限公司);RIPA细胞裂解液(上海碧云天生物技术研究所);苏木精BA-4041(珠海贝索生物技术有限公司);TRIzol试剂(美国Life technogies公司);qRT-PCR 引物合成(生工生物工程上海股份有限公司);ECL超敏发光试剂盒、逆转录试剂盒、荧光定量PCR仪(美国Thermo Scientific公司)。
1.3 实验方法
1.3.1Western blot 剪取肝癌及对应癌旁组织均约100 mg,加入RIPA细胞裂解液进行裂解后提取总蛋白,使用BCA法进行蛋白的定量测定,每对样本等量蛋白上样,电泳结束后,分离蛋白并将蛋白转至PVDF膜上,转膜完毕后,立即把PVDF膜放置到预先准备好的Western洗涤液中,漂洗5 min,以洗去膜上的转膜液。加入封闭液(5%脱脂奶粉),在摇床上缓慢摇动,室温封闭2 h。KLK7-1抗体在4 ℃摇床中用兔抗1 ∶200稀释液(10%分离凝胶)孵育过夜,之后用PBST溶液洗膜3次。二抗稀释液稀释辣根过氧化物酶(HRP)标记的二抗(1 ∶10 000),室温孵育2 h,PBST液洗涤3次后使用ECL超敏发光试剂盒来检测蛋白,采用北京科创锐新生物凝胶成像系统对扫描、保存后的图像进行灰度值分析。同法用兔抗人β-actin 作内参对照;获取KLK7条带灰度值与β-actin 灰度值之比用于统计学分析。
1.3.2qRT-PCR 提取肝癌及癌旁组织总RNA,用于合成cDNA,随后使用三步法进行qRT-PCR反应,设置扩增条件为:95 ℃预变性2 min;95 ℃变性5 s,60 ℃退火10 s,共计40个循环,每基因样本设置3次重复。KLK7引物正向序列:5′-CGAGCCCAGATGTGACCTTT-3′,反向序列:5′-GTCACCATTGCAGGCGTTTT-3′,扩增产物长度:155 bp;内参(β-actin)引物正向序列:5′-CCCTGGAGAAGAGCTACGAG-3′,反向序列:5′-GGAAGGAAGGCTGGAAGAGT-3′,扩增产物长度为96 bp;KLK7 mRNA相对表达量用2-ΔΔCt进行计算。
1.3.3免疫组化 本实验采用PicTureTM二步SP法对肝细胞癌及癌旁组织中KLK7的表达进行检测。根据KLK7抗体的特殊要求,通过脱蜡和水合预处理组织切片。3% H2O2去离子水孵育5 min用以阻断内源性过氧化物酶,PBS漂洗。用KLK7抗体滴注1 ∶200,在37 ℃下孵育90 min后用PBS冲洗3次,每次2 min。滴下通用IgG抗体(Fab段)-HRP聚合物,在37 ℃下孵育30 min后用PBS冲洗3次,每次2 min。蒸馏水冲洗、复染、脱水和密封。免疫组化实验结果判定标准:首先根据切片着色细胞强度评分:显色不清或不显色者计为0分;浅黄色计为1分;棕黄色计2分;棕褐色计3分。另外对于每张组织切片都随机选择5个高倍视野(400倍),根据着色细胞所占百分比评分:0~25%细胞着色为1分;26%~50%细胞着色为2分;51%~75% 细胞着色为3分;76%~100%细胞着色为4分。切片最终分数=着色细胞所占百分比分数×着色细胞强度评分,分数≥6分定为高表达,得分<6分定为低表达。
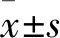
2 结果
2.1 Western blot与qRT-PCR实验结果通过Western blot法检测HCC中KLK7表达情况,定量结果显示HCC组织中KLK7相对含量(1.45±0.24)高于癌旁组织(0.65±0.16),差异具有统计学意义(t=28.03,P<0.001),见图1。qRT-PCR 检测结果显示,20对标本中KLK7在癌组织中的mRNA表达均高于对应癌旁组织,定量结果显示KLK7在HCC组织及对应癌旁组织中的mRNA相对表达量分别为(18.39±18.18)和(9.11±13.73),差异有统计学意义(t=5.804,P<0.001),见图2。
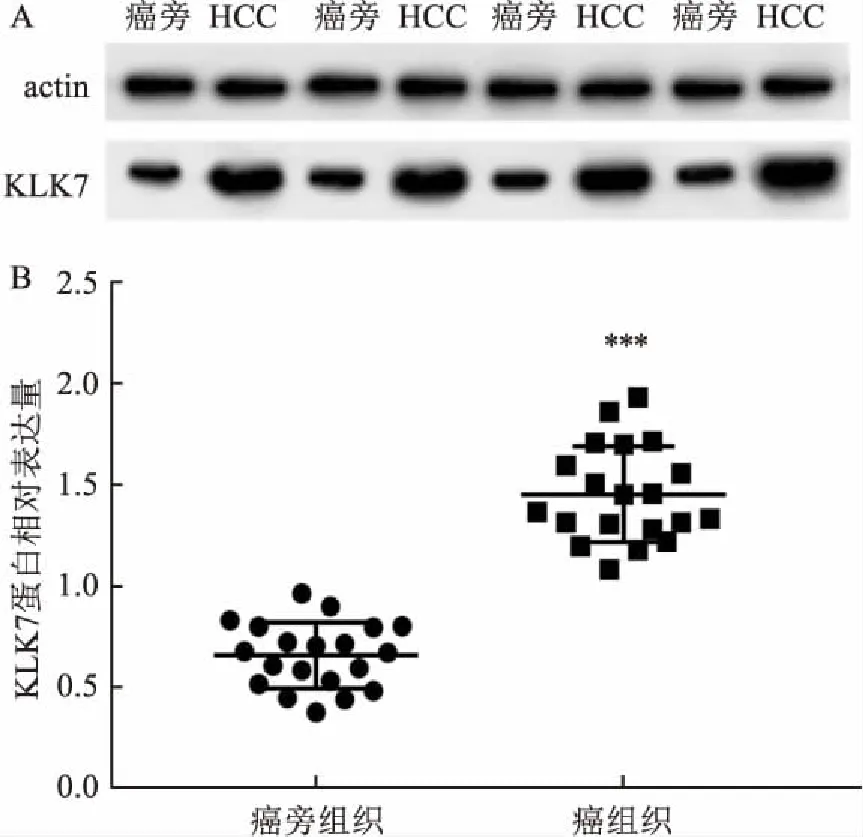
图1 Western blot法检测KLK7的表达
A:KLK7蛋白在4对代表性HCC及对应癌旁组织中的表达;B:KLK7蛋白在20对HCC及对应癌旁组织中的相对表达量;与癌旁组织比较:***P<0.001
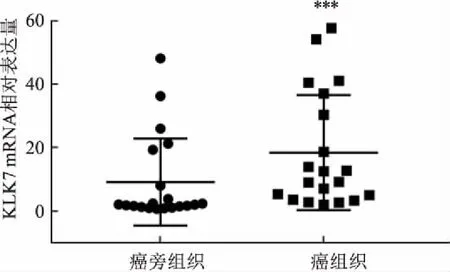
图2 qRT-PCR法检测KLK7 mRNA在20对肝癌及癌旁组织中相对表达量与癌旁组织比较:***P<0.001
2.2 免疫组化结果本研究通过对88例组织切片观察结果显示,有58例显示KLK7在HCC细胞质中呈高表达(65.9%),低表达有30例(34.1%)。在对应癌旁组织中有26例呈高表达(29.5%),低表达有62例(70.5%),差异具有统计学意义(P<0.05),见图3、4。
图3 HCC组织与癌旁组织KLK7的表达 ×100
A、C:KLK7在HCC组织中的表达;B、D:KLK7在癌旁组织中的表达
2.3 KLK7在HCC组织中的表达与临床病理因素的关系KLK7在HCC组织中的表达上调与肿瘤直径、肿瘤Edmondson分级、肿瘤TNM分期有关(P=0.011、0.016、0.006);与年龄、性别、甲胎蛋白(alpha-fetoprotein,AFP)、肿瘤包膜、肝硬化等无关(均P>0.05),见表1。
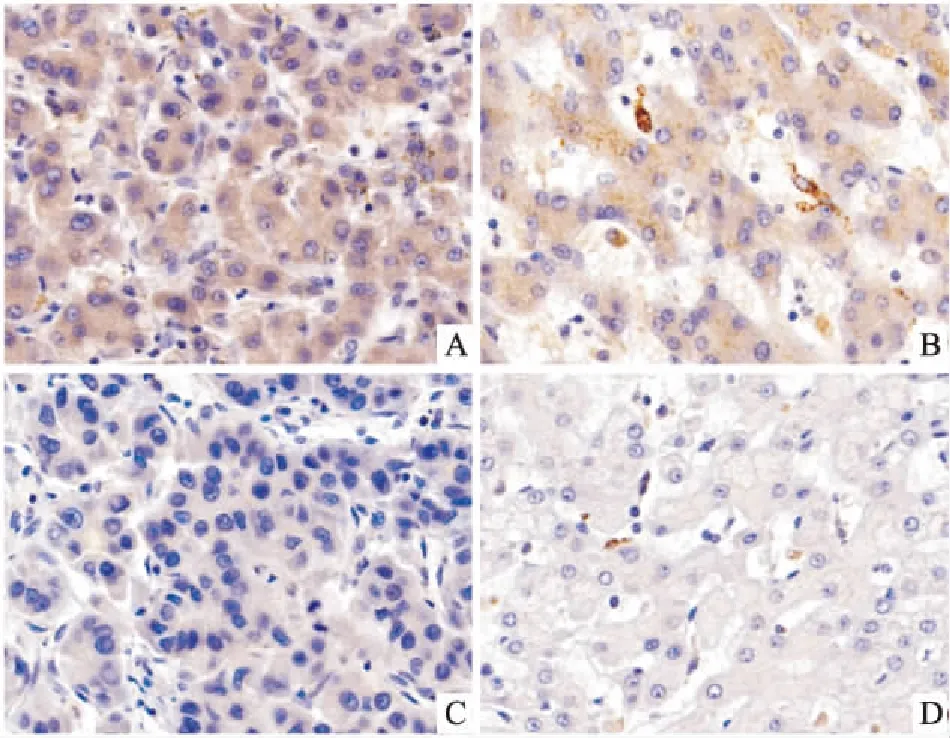
图4 HCC组织与癌旁组织KLK7的表达 ×400
A、C:KLK7在HCC组织中的表达;B、D:KLK7在癌旁组织中的表达
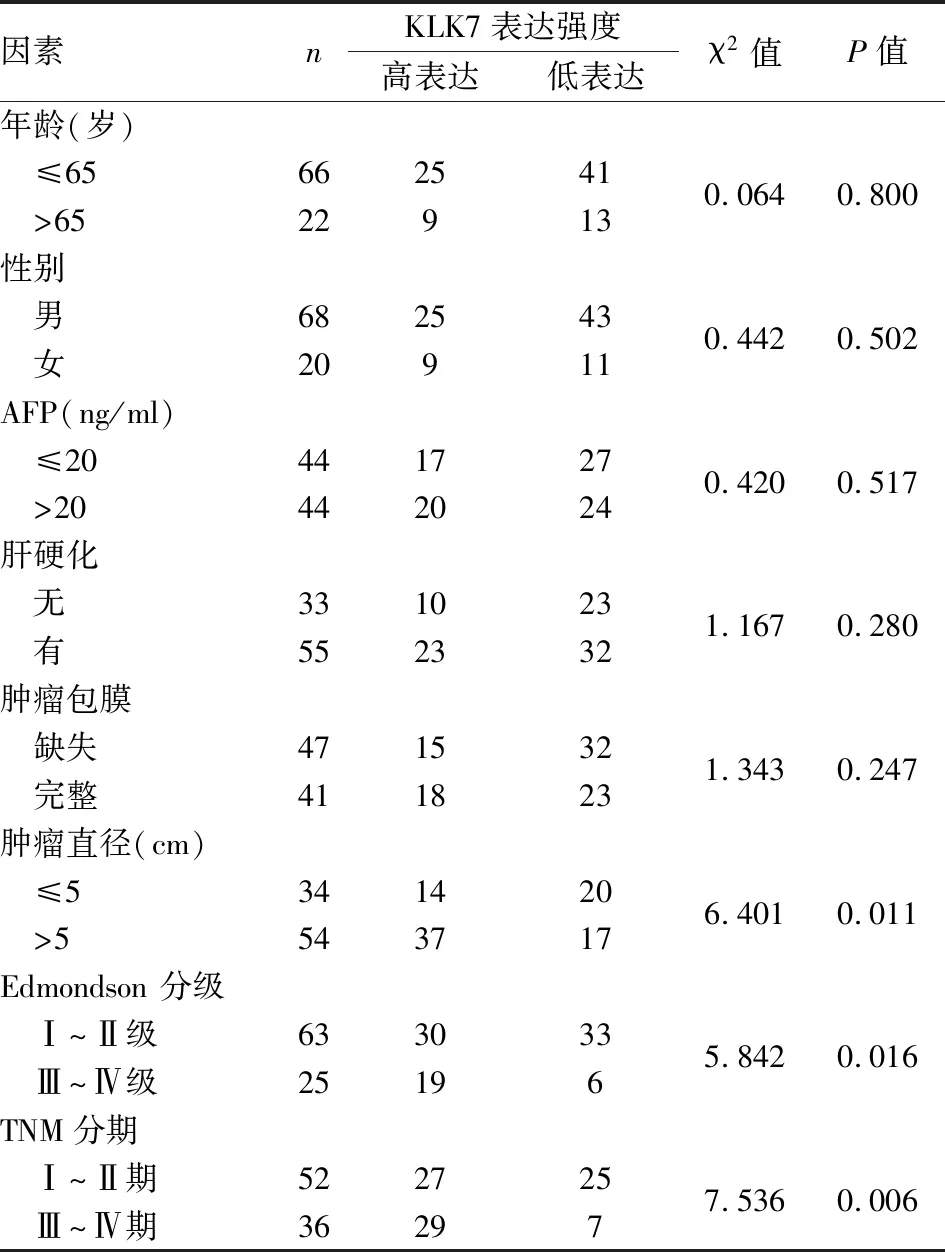
表1 KLK7的表达与患者临床病理特征之间的关系(n)
3 讨论
人激肽释放酶基因家族由15个同源分泌的胰蛋白酶或胰凝乳蛋白酶样丝氨酸蛋白酶组成,由染色体19q13.4区域中发现的紧密聚簇基因编码,人激肽释放酶的异常表达干扰恶性肿瘤生长的不同阶段,特别是在肿瘤转移和侵袭中,这可能是因为其在从胚胎发育到组织重塑的生理过程中都起到重要作用,并通过协助基底膜和结缔组织细胞外基质的降解而在恶性肿瘤的扩散中发挥重要作用密切相关[6]。KLK7是一种类似胰凝乳蛋白酶的丝氨酸蛋白酶,属于激肽释放酶家族,最初是从皮肤中提纯得到的,如其他激肽酶家族成员一样,KLK7同样以组织特异性方式表达,并且分别受转录和转录后机制如类固醇激素(雄激素反应元件)和丝氨酸蛋白酶抑制剂的调节,因其在肿瘤的发生发展中可能发挥重要作用而作为癌症生物标志物被广泛研究。
Du et al[7]在胰腺癌研究中发现KLK7在胰腺癌中呈现高表达,进一步沉默KLK7基因后诱导获得肿瘤的抗迁移和抗侵袭能力,将其相关的分子机制解释为KLK7对细胞外基质蛋白和连接、黏附分子的切割导致的。苏晓峰 等[8]也同样证实了KLK7在胃癌中的高表达后筛选出沉默KLK7效率最高的KLK7-siRNA-416片段,瞬时转染入胃低分化腺癌AGS细胞株,发现KLK7沉默后在mRNA水平及蛋白水平均匀下调。这一研究证明了胃癌细胞增殖变化的过程中有着KLK7的参与,KLK7基因的沉默影响了细胞周期的前DNA合成从而抑制细胞增殖。Xi et al[9]也通过鼠异种移植实验检查KLK7表达及在体内调节食管腺癌的生长情况,证实了KLK7在食管腺癌中起致癌基因的作用,其可能的机制也与KLK7切割细胞间连接分子相关。在另外一项关于黑色素瘤的研究中,Yu et al[10]发现高表达水平的KLK7表达与黑素瘤患者的良好预后相关,这是少数关于高表达KLK7在肿瘤中起保护作用的报道。上述研究中,包括以往的另外一些研究[11-12],KLK7在肿瘤中的作用机制通常被描绘为直接降解细胞外基质的组成成分(例如纤连蛋白)促进肿瘤的转移,同时还通过降解桥粒蛋白如桥粒蛋白1和桥粒芯糖蛋白2,导致细胞黏附减少并促进肿瘤细胞侵袭,在肿瘤发生发展中起重要作用。目前人们了解到细胞外蛋白水解通过主动降解和修饰细胞外基质而促进肿瘤进展,导致恶性肿瘤的侵袭和最终转移。几种蛋白酶系统在癌症中持续失调,并且它们负责的信号传导直接影响肿瘤微环境[13]。这些蛋白水解级联中的非常重要的两个蛋白酶是基质金属蛋白酶和属于丝氨酸蛋白酶的尿激酶纤溶酶原激活物(uPA)及其受体(uPAR),而这两种蛋白酶又恰恰是被几种激肽释放酶激活的,这其中也包括KLK7。这种失调通常会改善癌症进展的条件,例如通过增加细胞黏附受体来促进细胞黏附和细胞迁移,并在释放细胞外生长因子后产生化学梯度。
KLK7在生理学和病理学作用已在各种组织中广泛研究,特别是皮肤、胰腺这些广泛受到激素调节的组织,然而其在肝脏中的生理和病理学作用仍然知之甚少,国内外尚未见对KLK7在HCC中表达情况及其与HCC患者临床病例特征之间关系的探讨,本研究旨在检测KLK7在HCC中的表达情况,并分析KLK7的表达与HCC患者相关临床病理特征之间的关系。一方面本研究进行免疫组织化学实验、qRT-PCR、Western blot实验显示KLK7在HCC中呈现高表达,另一方面本研究通过对临床资料的分析显示,KLK7的表达上调与肿瘤直径、肿瘤Edmondson分级、TNM分期有关(P=0.011、0.016、0.006),而与年龄、性别、肿瘤包膜、AFP、肝硬化等无关(P>0.05),这表明KLK7在HCC中呈高表达可能会促进肿瘤侵袭和迁移能力,增加肿瘤的恶性程度。KLK7在HCC中作用的机制同样可能是对HCC的细胞外基质进行重塑,对细胞黏附分子进行降解,或者通过作为其他细胞的旁分泌因子调节机制从而改变HCC的肿瘤微环境,进而增加HCC的迁移和侵袭能力。
虽然本研究只探讨了KLK7在HCC中的表达情况,分析其与临床病理资料之间的相关性,但对其具体行为机制未作深入探究,仍然有必要进行更大样本的进一步研究KLK7在HCC中的作用靶点及调控机制,随着研究的深入,KLK7可能成为HCC潜在的治疗靶点或分子标志物。
