双歧杆菌微胶囊的制备及其稳定性研究
2019-10-16张孟雪蔡为荣
张孟雪,蔡为荣
(安徽工程大学 生物与化学工程学院,安徽 芜湖 241000)
作为人体和动物体内的优势菌群,双歧杆菌具有很多优良特性,可以预防肠道感染,维持胆固醇水平,调节免疫系统,改善乳糖不耐受的情况等[1-2]。但是要获得理想的治疗效果,必须使益生菌保持高活性并能够定殖到人体的肠道中,只有这样益生菌才能发挥作用[3-5]。由于双歧杆菌的活性受pH影响较大,在摄入过程中受胃肠道内环境影响,难以成功到达肠道内并存活,因此双歧杆菌微胶囊显示了优良的特性。微胶囊包裹的双歧杆菌延长了双歧杆菌的存活率,使得双歧杆菌被摄入后到达肠道发挥作用的活菌数大大提高[6]。目前,研究最多的是微胶囊的包埋技术,在食品行业中,研究和应用比较成熟的微胶囊化技术有挤压法、乳化法和喷雾干燥法[7-8],将益生菌包埋进肠溶性壁材中制备成微胶囊,这不仅仅能够增强菌体对有害环境的抗性,还能够让微胶囊中的益生菌在宿主肠道适宜的条件下被快速地释放出来。微胶囊包埋法大大提高了益生菌在宿主肠道中的存活率,从而更好地发挥益生菌的作用[9-11]。微胶囊既可以维持微生物的活性又能够使其稳定保存,还可以提高微生物类产品生产效率以及便于控制工艺过程,帮助细菌防御外部环境的侵扰,保持其活性[12-14]。微胶囊壁材要形成薄膜将芯材包裹住,除了以上的特点之外,最重要的一点是制备出的微胶囊要具有良好的肠溶性并且耐胃酸腐蚀,这样微胶囊才能够经过消化道到达肠道内并释放双歧杆菌发挥作用[15]。实验选择海藻酸钠等作为壁材,将双歧杆菌菌体与果胶低聚糖混合作为芯材进行包裹,提高双歧杆菌到达人体内的活菌量,用挤压注射法制备微胶囊并分析微胶囊在模拟消化液中的稳定性情况。
1 材料与设备
1.1 实验试剂
盐酸、NaCl、NaH2PO4、CaCl2、海藻酸钠、胃蛋白酶、胰蛋白酶、壳聚糖、磷酸二氢钾等试剂均为国产分析纯试剂;果胶低聚糖,实验室自制;两歧双歧杆菌,实验室保存菌株。
1.2 仪器与设备
电子天平;pH计;5 mL针式注射器恒温震荡培养箱;可见分光光度计;扫描电镜(SEM)。
1.3 实验方法
(1)微胶囊制备。将厌氧培养得到的双歧杆菌菌液6 000 r/min离心10 min分离后,用0.9%无菌生理盐水洗涤菌体沉淀数次,与实验所得果胶低聚糖混合(添加量5%(W/V)),再与1.5%(W/V)的海藻酸钠溶液均匀混合,用5 mL无菌注射器将双歧杆菌与海藻酸钠混合溶液注入到1.6%的CaCl2溶液中, 形成海藻酸钙凝胶珠。然后在0.3%(V/V)的壳聚糖溶液(壳聚糖用0.01%的醋酸溶解)中进行成膜反应形成胶囊外膜,30 min后用蒸馏水洗除未反应的壳聚糖,收集微胶囊(P-MCL)于培养皿中,将其真空冷冻干燥密封保存。再按此方法制备不含果胶低聚糖的微胶囊(MCL)。
(2)模拟消化液的配制。模拟胃液的配制[15]:量取无菌蒸馏水约800 mL,向其中加入16.40 mL的稀盐酸(0.1 mol/L)和10 g胃蛋白酶,搅拌均匀,定容至1 000 mL, pH约为1.2,溶液用0.22 μm膜过滤除菌备用。模拟肠液的配制:量取无菌蒸馏水约500 mL,加入6.8 g的磷酸二氢钾,搅拌至溶解,再量取一定量无菌蒸馏水,加入10 g胰蛋白酶,搅拌至溶解,将两溶液混合后定容至1 000 mL, pH约为7.4,溶液用0.22 μm膜过滤除菌备用。模拟胆汁液配制[16]:将7号胆盐(胆酸-脱氧胆酸钠盐混合物,胆酸含量≥65%)溶解到无菌蒸馏水中,配制质量体积分数为1%的胆汁盐溶液。解囊液[15]:3%柠檬酸钠水溶液。
(3)微胶囊在模拟人工胃液中的溶解特性。根据李来酉[16]等方法改良,称取0.2 g冻干的微胶囊样品,将其溶于40 mL人工模拟胃液中,在37 ℃、155 r/min的恒温震荡培养箱中震荡溶解,每隔15 min取样测定溶液在波长600 nm处的吸光度值,再根据溶液吸光度值的变化分析微胶囊在人工胃液中的溶解情况。
(4)微胶囊在模拟人工肠液中的溶解特性。同1.3(3)实验方法,称取0.2 g冻干的微胶囊样品,将其溶于40 mL人工模拟肠液中, 在37 ℃、155 r/min的恒温震荡培养箱中震荡溶解。每隔15 min取样品溶液测其在波长600 nm处的吸光度值,再根据溶液的吸光度值变化分析微胶囊在人工肠液中的溶出情况。
(5)微胶囊活菌计数。将微胶囊置于模拟胃液中处理1 h、模拟胆汁液中处理12 h后,再将其置于模拟肠液中按1.3(4)最快崩解时间处理后,将溶液在 6 000 r/min条件下离心10 min,用PBS缓冲液清洗一次,进行活菌计数。
(6)微胶囊的包埋率、肠溶释放率的测定[15]。将发酵培养后的双歧杆菌菌悬液在6 000 r/min条件下离心10 min后,用无菌蒸馏水洗涤数次进行活菌计数;称取0.2 g 的微胶囊,用无菌蒸馏水清洗,待洗去微胶囊表面的活菌,将其置于解囊液中,计算活菌数记为P;再分别称取0.2 g 的微胶囊,将其分别加入到解囊液和人工模拟肠液中,一段时间后分别计算解囊液和肠液中的总活菌数,分别记为Q和R。
微胶囊表面活菌数(K)=解囊液中总活菌数(Q)-微胶囊内部活菌数(P),
(1)
称取干燥后的微胶囊样品0.2 g,分散于40 mL的肠液中,37 ℃恒温水浴振荡,处理30 min后进行活菌计数,包埋率:
(2)
式中,C1为所测稀释液中的活菌数(CFU/g);C0为起始添加的活菌数(CFU/g)。

(3)
(7)双歧杆菌微胶囊的稳定性研究。根据经典加速实验,将微胶囊放置在37 ℃条件下保持恒温,相对湿度保持在60%~65%,存储3个月后测定微胶囊中的活菌数,此时的活菌数衰减速度就相当于在室温的条件下存储1年以上后的活菌数衰减速度[17]。将上述实验操作重复3次增加实验准确性。
(8)双歧杆菌微胶囊结构观察。①微胶囊外部观察。对干燥的微胶囊样品进行喷金处理,在电压为15 kV条件下,扫描电镜观察微胶囊的表观形态。②微胶囊内部观察。微胶囊湿样品在载玻片上切片后用无菌蒸馏水清洗,真空冷冻干燥。干燥样品喷金处理后,扫描电微镜观察微胶囊的内部形态。
2 结果与分析
2.1 微胶囊在模拟消化液中的稳定性分析
通过微胶囊在模拟胃液、模拟肠液中吸光度值的变化以及对比胆汁盐处理后菌体存活率和微胶囊在模拟肠液、解囊液中的溶解情况来分析其稳定性。
微胶囊在模拟胃液中的溶解情况如图1所示。图1中P-MCL和MCL分别表示添加果胶低聚糖的微胶囊和未添加果胶低聚糖的微胶囊,结果显示两种微胶囊在模拟胃液中的吸光度值基本无变化,在胃液中基本不溶解,表明微胶囊的抗酸能力较强。
微胶囊在模拟肠液中的溶解情况如图2所示。由图2可知,两种微胶囊均可以在模拟肠液中溶解,吸光度值随时间增大而增大。MCL在15 min左右基本崩解完全,菌体全部溶出,吸光度值稳定在1.6左右,而P-MCL在15 min后加快崩解, 30 min左右崩解完全,菌体全部溶出,溶液的吸光度值稳定在1.7左右。其中,菌悬液在模拟胃液和模拟肠液中随时间变化其吸光度值基本维持不变,微胶囊肠溶性良好。
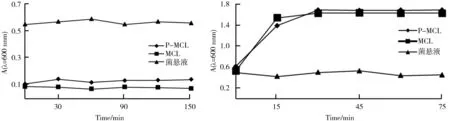
图1 微胶囊在模拟胃液中的溶解情况 图2 微胶囊在模拟肠液中的溶解情况
P-MCL、MCL和菌悬液在胆汁盐中的稳定性如图3所示。由图3可知,P-MCL和MCL经胆汁盐处理12 h后双歧杆菌存活率可高达75.3%和69.2%,而菌悬液中双歧杆菌的存活率为49.6%,表明经过包埋后的双歧杆菌具有较好的耐胆汁盐的能力,且添加低聚糖有助于双歧杆菌存活率的提高。
P-MCL在模拟肠液和解囊液中的溶解情况如图4所示。由图4可以看出,P-MCL在模拟肠液和解囊液中的两条溶解曲线基本重合,表明微胶囊具有良好的肠溶性,符合微胶囊的制备要求。
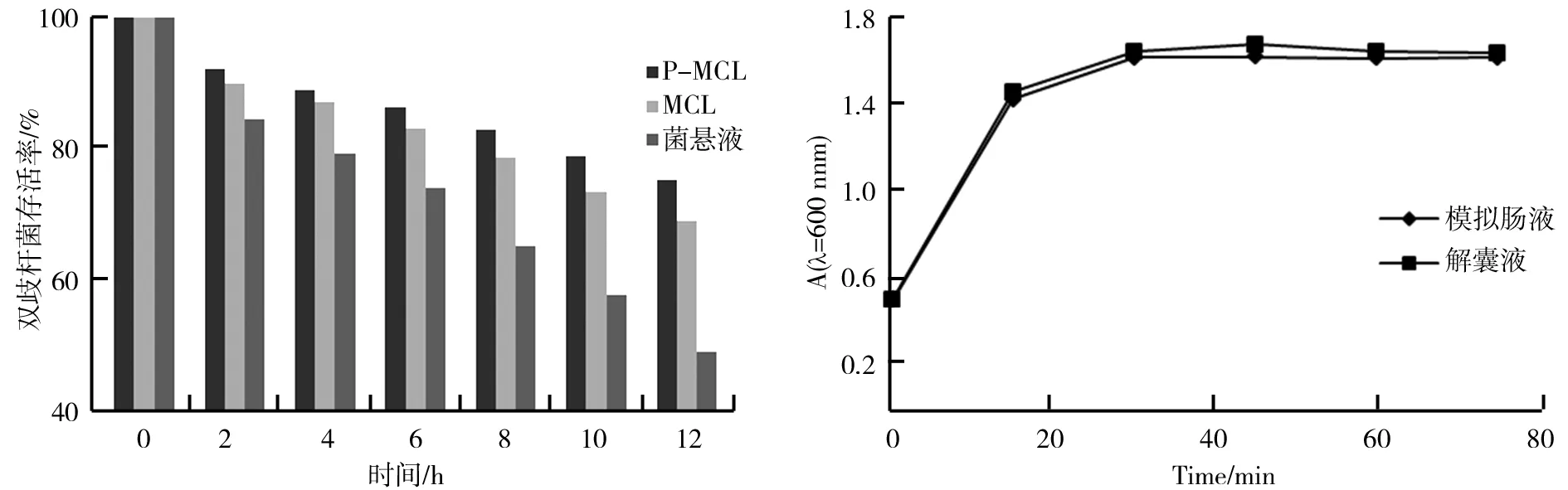
图3 P-MCL、MCL和菌悬液在胆汁盐中的稳定性 图4 P-MCL在模拟肠液和解囊液中的吸光度变化
2.2 微胶囊活菌计数结果分析
将模拟消化液处理后的微胶囊溶解液接种到培养基中厌氧培养48 h后进行平板计数。微胶囊活菌计数如图5所示。图5a的稀释倍数为108,图5b、图5c、图5d的稀释倍数为109,可以看出表面生长的双歧杆菌菌落光滑且分布均匀,其中图5a是菌悬液经模拟消化液处理后的活菌数,图5b是P-MCL未经模拟消化液处理的微胶囊活菌数,图5c和图5d是经过模拟消化液处理后的微胶囊活菌数,计算得出培养皿中的活菌数分别为1.3×107CFU/mL、7.5×109CFU/mL、3×109CFU/mL和4.75×109CFU/mL。结果表明,未包埋的双歧杆菌经过模拟消化液处理后活菌数大大降低,模拟消化液处理前后P-MCL中活菌数未发生数量级的变化,说明微胶囊对双歧杆菌具有良好的保护作用,包埋后的双歧杆菌在消化道中的存活率有很大提高。
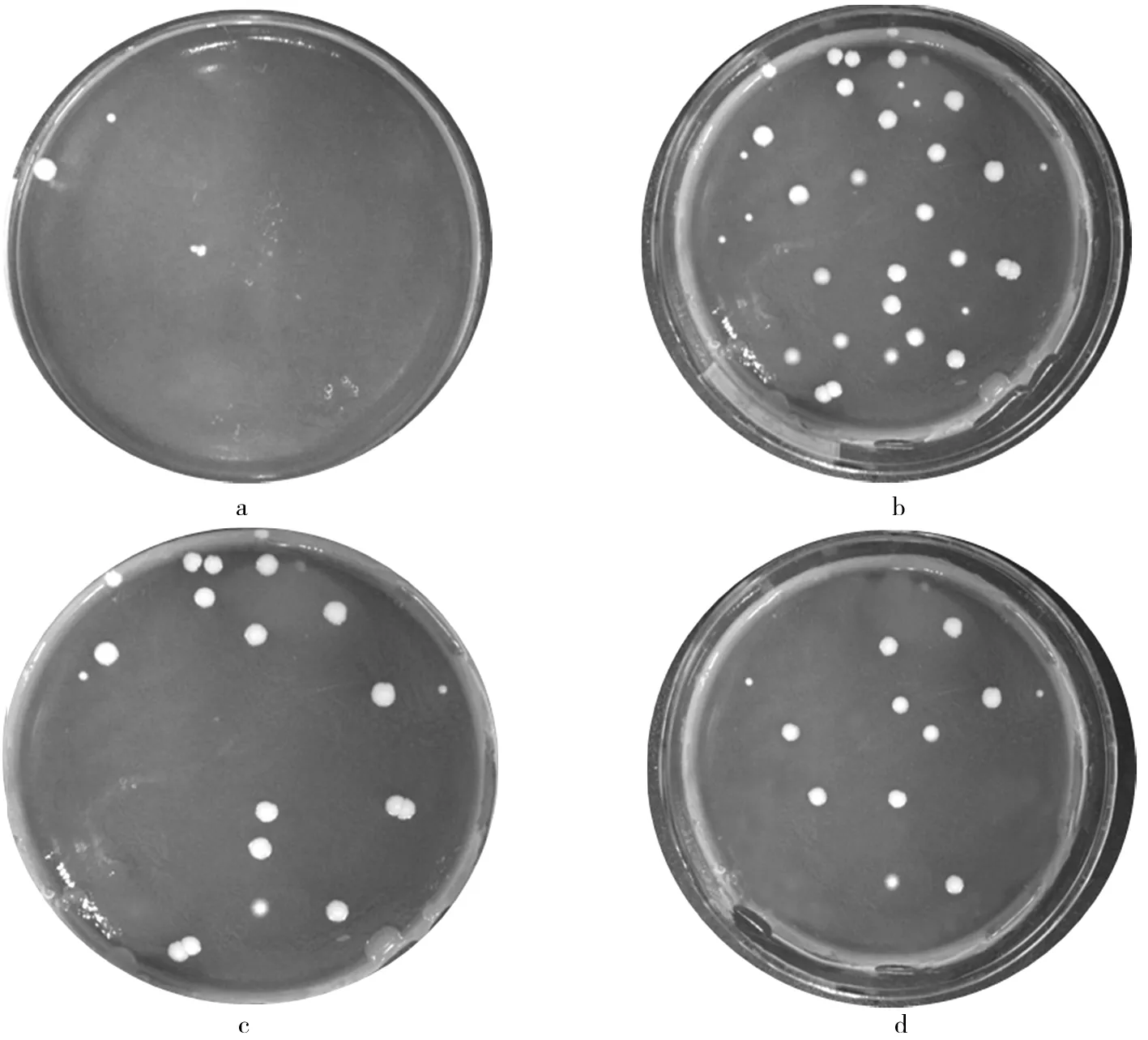
图5 微胶囊活菌计数
2.3 微胶囊包埋率和肠溶率计算
实验所得到的微胶囊,其胶囊内部的活菌数、解囊液中的总活菌数以及模拟肠液中的总活菌数分别为 4.34×108CFU/mL、1.03×109CFU/mL、4.75×109CFU/mL。 根据式(2)计算出包埋率为 76.85%,由式(3)计算出肠溶释放率为87.92%,表明实验制备的微胶囊对双歧杆菌的包埋效果好,具有肠溶速度快,能够释放出大量的双歧杆菌活菌的特点。
2.4 微胶囊稳定性实验结果分析
将微胶囊(P-MCL)放置在加速实验条件下,经活菌计数测定3个月后微胶囊内活菌数基本都可以达到108数量级,而以未包埋的双歧杆菌作为对照的实验中,未包埋的菌悬液中活菌数数量级均降到104以下,说明微胶囊对双歧杆菌具有良好的保护作用。微胶囊稳定性分析如表1所示。

表1 微胶囊稳定性分析
2.5 微胶囊扫描电镜图片分析

图6 P-MCL表观图
以海藻酸钠进行一次包埋,经注射器注射到氯化钙溶液中形成凝珠状,再用壳聚糖进行二次包埋,真空冷冻干燥得到微胶囊样品,并通过SEM进行观察。
制备得到的微胶囊P-MCL外观如图6所示,呈乳白色球体状,粒径分布比较均匀,成型较好。P-MCL和未包埋双歧杆菌的扫描电镜图如图7所示。由图7可知,微胶囊表面形状略不规则,多孔疏松。微胶囊表面可以看见部分裸露的菌体,其切片横截面图片中可以看出包埋在微胶囊内部的大量菌体,表明实验方法可以将双歧杆菌有效地包裹在胶囊内。

图7 P-MCL和未包埋双歧杆菌的扫描电镜图
3 结论
挤压注射法制备得到微胶囊(P-MCL),其外观呈乳白色球体状,粒径分布略不均匀,但总体粒径较小,成型较好。通过扫描电镜观察后发现,微胶囊表面形状略不规则,粒径较小,部分有凹陷,可能是外力挤压造成的。微胶囊的包埋率为 76.85%,肠溶释放率为87.92%,包埋效果好,具有肠溶速度快,能够释放出大量的双歧杆菌活菌的特点。微胶囊在胃液中基本不溶解,在胆汁盐作用12 h后菌体存活率依然高达70%以上,表明其耐酸能力和耐胆盐性能良好,而且微胶囊可以在模拟肠液中快速崩解,因此其在人体内可以顺利到达肠道内并释放活菌;经模拟人体内环境液处理后的微胶囊其活菌数为4.75×109CFU/mL,表明微胶囊中的活菌数含量较高,微胶囊包裹双歧杆菌后可以大大提高其在胃肠道中的存活率。
