粉尘螨不同地理种群的遗传结构研究
2019-10-16叶长江郑凌霄陶香林杨邦和孙恩涛
叶长江,陈 成,郑凌霄,刘 啸,陶香林,杨邦和,孙恩涛
(1.皖南医学院 检验学院,安徽 芜湖 241002;2.皖南医学院 临床医学院,安徽 芜湖 241002)
粉尘螨(Dermatophagoidesfarina)属粉螨亚目(Acarida)、麦食螨科(Pyoglyphiae),主要以有机残屑为食,在自然界中分布广泛,孳生在粮食、干果、中草药等储藏物中,会造成一定的经济损失[1-3];近十年,过敏性疾病成为全世界关注的热点公共健康问题,我国每年有近1千万的儿童患哮喘和5千万成人患过敏性鼻炎,而各种螨类被认为是主要的过敏原,临床上超过50%的过敏性疾病归因于螨类。螨种类繁多,其中粉尘螨在人居环境中广泛存在[4],因此粉尘螨的防治具有重要的意义。
种群遗传结构是种群遗传的主要特征之一,可通过种群遗传多样性、遗传距离和遗传分化等参数来衡量遗传多样性在种群间和种群内的时空分布。研究表明,扩散能力(主动或被动)、地理隔离、寄主及其他外界生态因子均可影响并形成螨虫独特的种群遗传结构和进化[5-6]。分子标记是研究种内不同种群间遗传多态性、遗传分化等遗传结构特征十分有用的工具,普遍用于研究种群遗传结构的分子标记为微卫星、AFLP和线粒体基因等。线粒体DNA具有突变率较高、单亲遗传、一般没有重组、对种群瓶颈以及种群再分比较敏感的特点[7-8],杨小强[9]等以线粒体cox1基因片段为分子标记,对马六甲肉食螨的系统地理结构的成因进行了探讨,认为其系统地理结构不仅长期受到自然历史地理环境的影响,近期人为干扰如粮食的生产及贸易也促进了其在不同种群间的交流,从而导致原有的系统地理结构发生了改变。研究利用系统地理学的分析方法,以线粒体基因COI基因作为分子标记,分析了采自我国3个省4个地理种群粉尘螨的遗传多样性和种群遗传结构,以期为粉尘螨制定有效的可持续控制策略提供种群分子遗传学方面的基础信息。
1 材料与方法
1.1 粉尘螨样本采集
粉尘螨样本来自河北省石家庄市,山东省济南市,安徽省的淮南市和芜湖市4个地区,在当地的面粉加工厂将可能含有粉尘螨的面粉和地尘用自封袋装好,带回实验室,在光学显微镜下从粉尘螨样本中挑取单只雌螨。具体样本采集信息见表1。

表1 河北、山东和安徽三省粉螨采集情况
1.2 基因组DNA的提取
实验前一天收集粉尘螨,干饥饿处理。实验前,离心3 000~5 000 r,3 min,使粉尘螨落在管底。参考Jia[10]等提取DNA的方法,提取单个粉尘螨DNA。
1.3 PCR扩增及反应体系
上游引物:5'-GGTCAACAAATCATAAAGATATTG-3',下游引物:5'-ATTTTTTGGTCACCCTGAAGTTTA-3'(购自上海生工生物工程有限公司)。12.5 μL反应体系中含上下游引物各0.5 μL,ddH2O 4.75 μL,Mix 6.25 μL,模板0.5 μL。线粒体COI基因扩增条件:95 ℃预变性5 min,95 ℃变性30 s,48 ℃退火30 s,72 ℃延伸1 min,34次循环,72 ℃延伸6 min,设阴性对照。PCR产物经1%的琼脂糖凝胶电泳,于紫外灯下观察并记录结果。
1.4 扩增产物纯化及序列测定
用琼脂糖凝胶回收试剂盒(购自上海天根生物公司),对目的片段进行回收,将目的片段连接至pUcm-T载体上,将连接产物转化到DH5-α感受态细胞中,筛选阳性克隆,送至上海生工生物工程有限公司双向测序。
1.5 序列分析
用Chromas 2软件进行校对测序序列,并用DNAstar软件包[11]进行双向对准和拼接,最后在ClustalX软件进行多序列比对,必要时需人工修正,生成序列矩阵。用DnaSP 5软件统计单倍型,计算各种群的单倍型多样性(h)、核苷酸多态性(P);利用MEGA 5软件包分析序列特征,计算遗传变异和遗传距离[12]。利用Arlequin3.5.2.2[13]和DnaSP 5软件进行中性检验,计算Tajima's D值、Fu和Li's D值、Fu和Li's F值,以检验是否符合中性变异,评估粉尘螨种群历史。用分子变异分析法(Analysis of molecular variance,AMOVA)分析种群间遗传分化指数Fst,将4个地理种群归为一大组,排列置换数为1 000。P<0.05为差异有统计学意义[14]。
2 结果
2.1 单个粉尘螨基因组DNA提取和PCR扩增
粉尘螨COI基因的PCR扩增片段长约709 bp,所有序列条带均清晰可见,经克隆测序,共获得37个有效序列。
2.2 COI基因序列特征
研究扩增的片段为COI基因,经对比校正,获得长度为709 bp的序列,GC含量约为35.699 3%。多序列进行对比,显示共有709个信息位点,其中多态位点41个,占5.92%,多态位点中简约位点有31个(75.6%),其余为碱基突变。利用DnaSP5软件统计各种群单倍型,样本中共检出16个单倍型(见表2),其中仅H-1为河北石家庄和安徽淮南共享单倍型,其他均为独享单倍型。
2.3 种群遗传多样性分析
4个粉尘螨种群的h值较高,范围在0.423~0.905,平均值为0.847;核苷酸P值较低,范围为0.000 65~0.012 76,平均值为0.021 08。4个种群均显示出较丰富的遗传多样性。粉螨种群遗传多样性参数如表2所示。综合分析显示,安徽芜湖遗传多样性最高,安徽淮南遗传多样性最低。
2.4 种群遗传分化
序列的差异程度反映了种群亲缘性的远近,用MEGA 5.05软件中的Tamura-Nei距离模型计算种群内及种群间的遗传距离。粉螨各种群的遗传距离(左下角)和粉螨种群间Fst值(右上角)如表3所示。由表3可知,种群间的遗传距离在0.002~0.043。4个种群两两比较,Fst值在0.077 38~0.974 21,表明遗传分化明显,遗传距离大的种群分化明显,种群间Fst分析与遗传距离分析结果一致。

表2 4个粉螨种群遗传多样性参数

表3 粉螨各种群遗传距离(左下角)和粉螨种群间Fst值(右上角)
注:左下角的数字表示的是粉螨种群间Fst值,右上角的数字表示的是种群之间的平均遗传距离。
基于COI基因粉螨种群的中性检验结果如表4所示。由表4可知,在物种水平上,Tajima's D值,Fu和Li's D值,Fu和Li's F值分别为1.731 81(0.05

表4 基于COI基因粉螨种群的中性检验结果
分子变异分析结果如表5所示。由表5可知,AMOVA分析的结果表明有87.34%(P<0.001)的遗传变异存在于种群间,仅有12.66%的遗传变异位于种群内。
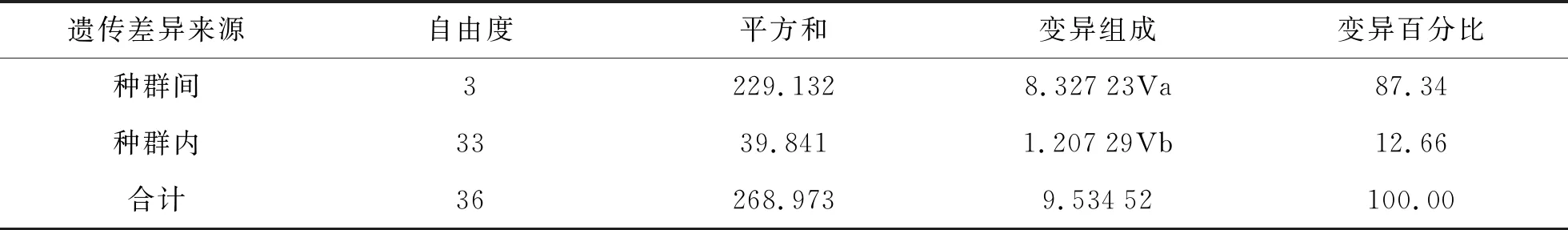
表5 分子变异分析结果
Fst=0.873 38,P=0.000 00。
2.5 单倍型网络图
用NetWork 5.0.1.1构建16个单倍型的网络进化关系树,计算方法为Median Joining。共分为A、B两大分支,A分支中共享单倍型H-1位于分支的中心,A分支含有分属于4个地理种群的8种单倍型共27个个体;B分支均为独有单倍型,含有属于4个地理种群的8种单倍型共10个个体。结果显示,各单倍型已经发生明显的遗传分化,但单倍型的聚类关系与单倍型的地理分布没有显示出明显的相关性。
16种单倍型(H-1~H-16)网状关系图如图1所示。图1中圆形的大小代表单倍型的频率,圆圈大小与单倍型频率相对应,空白圆圈代表缺失单倍型。

图1 16种单倍型(H-1~H-16)网状关系图
3 讨论
实验利用COI基因对华东和华中地区三省四地的粉尘螨不同地理种群进行了遗传多样性分析,共获得37个粉尘螨线粒体的COI基因部分序列,发现16个单倍型,占43.24%,表明粉尘螨种群遗传多态性较丰富。4个地理种群的单倍型h值均较高,P值均较低,显示粉尘螨种群可能是由一个较小的有效种群经历瓶颈效应[15]和建群者效应[16]后而得到快速增长。这和螨虫的生活史有很大的关系,其在不同的季节数量差异很大:春季开始繁殖,夏季数量最多,进入冬季由于寒冷、缺少食物等原因致大批个体死亡,至第二年春季,由少量残存的个体繁衍导致后代基因频率由残存个体基因频率决定,形成了冬季数量减少的瓶颈样[5]。其中安徽淮南的P值最低,表明其地理种群是这种遗传效应表现较为明显的种群之一。
4个地理种群中芜湖地区的粉尘螨遗传多样性最高,可能和当地的气候有关。长江以南地区全年的平均气温和湿度均较高,更适宜于粉尘螨的生长发育和繁殖,即有利于种群的增长,增加了种群的遗传多样性的丰富度。这和中性检测的结果一致,Tajima's D统计值为显著的负值(P<0.05),Fu's FS统计值也为极显著的负值(P<0.05),D检验如果得到负的显著结果,既有可能是负选择造成的,也可能是搭载效应的信号[17],统计都表明该种群发生过快速扩散,显示了该种群具有较强的进化潜力和高水平的适应能力[18-19]。
Wright建议[20],在实际研究过程中,如果Fst为0~0.05,群体间遗传分化很小,可以不考虑;Fst为0.05~0.15,存在中等程度的遗传分化;Fst为0.15~0.25,遗传分化较大;Fst为0.25以上,显示有很大的遗传分化。从研究结果来看,芜湖和济南的种群之间遗传分化呈中等程度,种群之间遗传分化较大。济南与石家庄、济南与淮南、芜湖与石家庄、芜湖与淮南之间有很大的遗传分化。AMOVA分析结果表明,高达87.34 % (P<0.001)的变异分布于种群间,而种群内仅占12.66 %,表明种群间存在显著遗传分化,因此,不同地区的螨类防控有必要采用不同的防治方法,以达到最优的效果。
粉尘螨体小,无翅,迁移能力有限,自身只能进行短距离的传播,自然条件下,储藏物螨类要发生长距离的传播只可能借助外力的帮助。储藏物螨类分布如果只受自然环境的作用,理论上不同地理种群之间会显示出明显的系统地理结构,种群之间的遗传距离与地理距离应该会显示出一定的相关性;而研究利用单倍型构建的网络进化关系树则没有明显的地理分布相关性,表明粉尘螨的分布受到很强的人为干扰。由于粮食作物的贸易交流、交通等因素导致粉尘螨在不同种群之间交流[21-22],因此在粮食及药材交易前,应进行适当的螨类防治,以减少螨类的扩散和交流。
