HSCCC分离荷叶原花青素及其抗氧化活性研究
2019-10-16蔡为荣张孟雪岳丹伟
高 亮,蔡为荣,张孟雪,岳丹伟
(安徽工程大学 生物与化学工程学院,安徽 芜湖 241000)
荷叶为睡莲科植物莲(Nymphaeaceae Genus)的干燥叶,味苦性平,归肝、脾、胃经,具有升发清阳、凉血止血等功效 ,现代研究表明荷叶具有调节血脂、止咳化痰、降低血压等作用[1]。《本草纲目》记载:“荷叶服之,令人瘦劣。单服可以消阳水浮之气”。中华人民共和国卫生部在1991年第45号文件将荷叶列入第二批“既是食品又是药品”名单[2]。研究表明:荷叶富含原花青素、黄酮、槲皮素、生物碱等,具有抗氧化、抗肿瘤等多种生物活性。原花青素(Poranthocyanidins,OPC)是具有C6-C3-C6结构的黄烷醇及其聚合体,由不同数量的儿茶素或表儿茶素结合而成[3-4]。对原花青素最早的研究始于20世纪50年代,法国科学家Masquelier J首次从松树皮中提取出该类物质[5]。原花青素是由儿茶素和表儿茶素通过不同聚合度聚合而成的一类聚合物,上下单元间以4~8或4~6位C-C键相连,从而形成具有不同聚合度的聚合物。原花青素广泛存在于自然界的植物中,在某些植物的皮和籽中含量较高。高速逆流色谱(HSCCC)分离技术是一种新兴的色谱分离技术,相对于一般分离技术而言,其特点在于流动相和固定相都为液体,没有不可逆吸附,具有分离效率高,对样品无损耗,制备量大等优点。目前对于高速逆流色谱分离原花青素的研究较少,N Savitri Kumar[6]等利用高速逆流色谱分离茶叶中的原花青素。近些年来的研究证明,原花青素具有很强的抗氧化活性,其抗氧化能力是VE的50倍、VC的20倍,此外还可以降血压、提高血管活性,对缺血-再灌注损伤、抗动脉粥状硬化以及抗血小板凝固有很高的医疗价值;在抗肿瘤方面,对多种癌细胞,例如乳腺、前列腺癌细胞等都有一定程度的抑制作用。关于荷叶原花青素,采用高速逆流色谱分离技术相对于之前的相关研究具有一定的创新,为分离荷叶原花青素提供了一种新的思路。
1 材料与方法
1.1 主要材料与试剂
荷叶采摘自校内池塘,洗净,放入40 ℃烘箱(常压下)内烘干,过80目筛,封口后保存于干燥阴凉处;儿茶素标准品(CAS编号7295-85-4),表儿茶素标准品(CAS编号490-46-0),表儿茶素没食子酸酯标准品(CAS编号490-46-0)(含量均>98%,合肥博美生物科技有限责任公司);原花青素B2标准品(含量>98%,CAS编号29106-49-8,南京市渊科技有限公司);乙醇、乙酸乙酯、乙酸、石油醚(均为分析纯),乙腈、甲醇(均为色谱纯)(国药集团有限公司);正己烷(分析纯,天津科密欧化学试剂有限公司);AB-8大孔树脂(天津南开化工厂)。
1.2 主要仪器与设备

表1 主要仪器与设备
1.3 实验方法
(1)荷叶原花青素样品的制备。取干燥后的干荷叶粉以料液比1∶20加入质量体积分数为60%的乙醇,在40 ℃条件下水浴加热1 h,抽滤后浸提两次,洗涤滤渣。将两次提取液合并,减压浓缩除去有机溶剂,再用AB-8大孔树脂洗脱除去糖类、蛋白质类杂质。方法为将浓缩液上样放入经过预处理后的树脂柱中进行纯化,先用蒸馏水洗去杂质至流出液无色,用45%乙醇溶液洗脱并收集洗脱液,再将洗脱液减压浓缩除去有机溶剂,之后加入饱和的NaCl溶液。经过滤后,先用3倍体积的乙酸乙酯萃取2次,再用2倍体积的石油醚沉淀两次,最终得到荷叶原花青素样品。将其放入冷冻干燥机中,冻干成粉备用。显色剂:10%香草醛盐酸溶液。
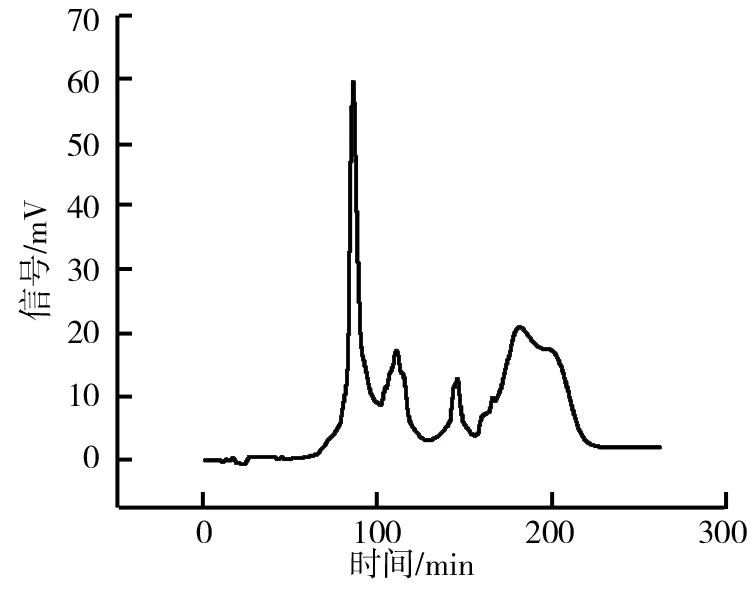
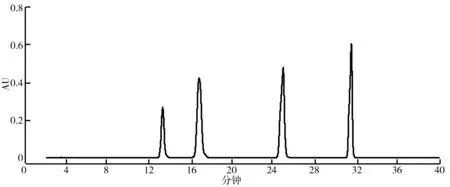
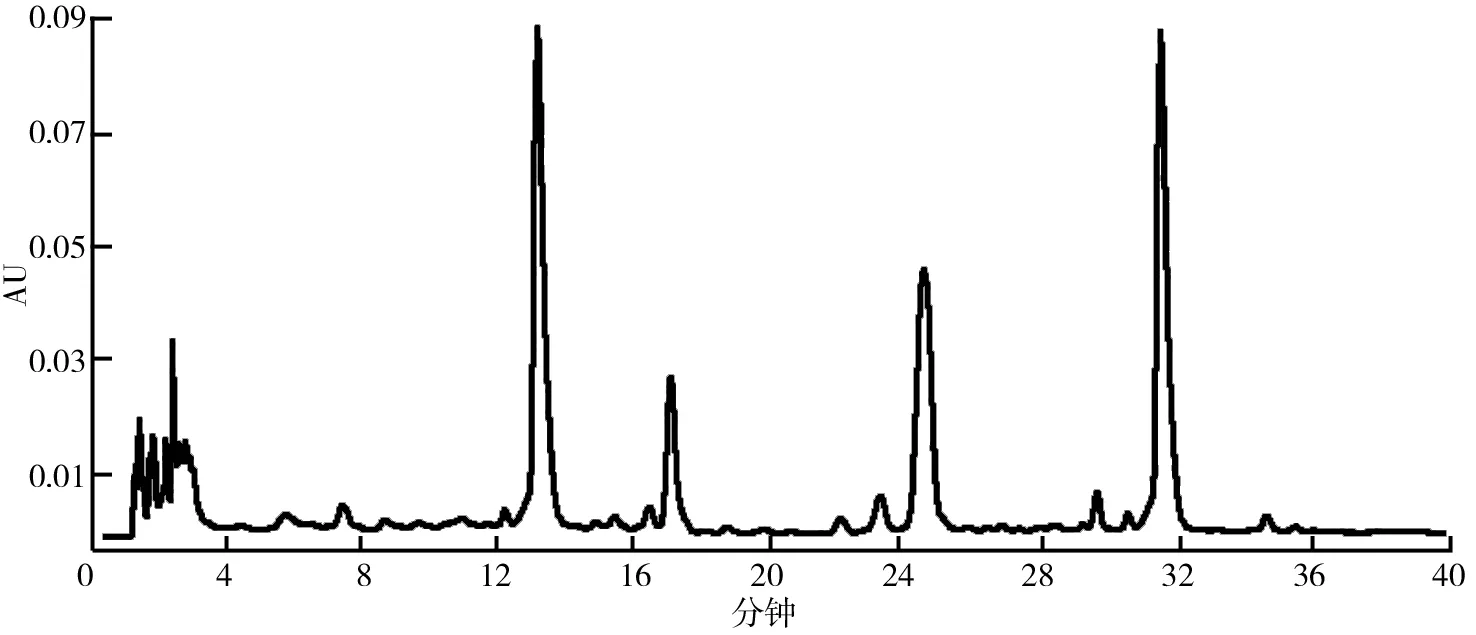
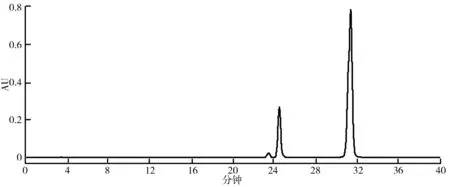
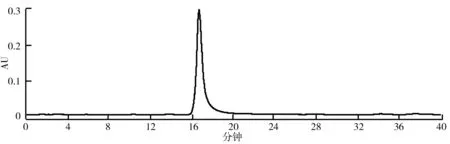
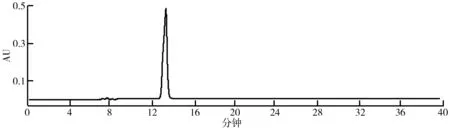
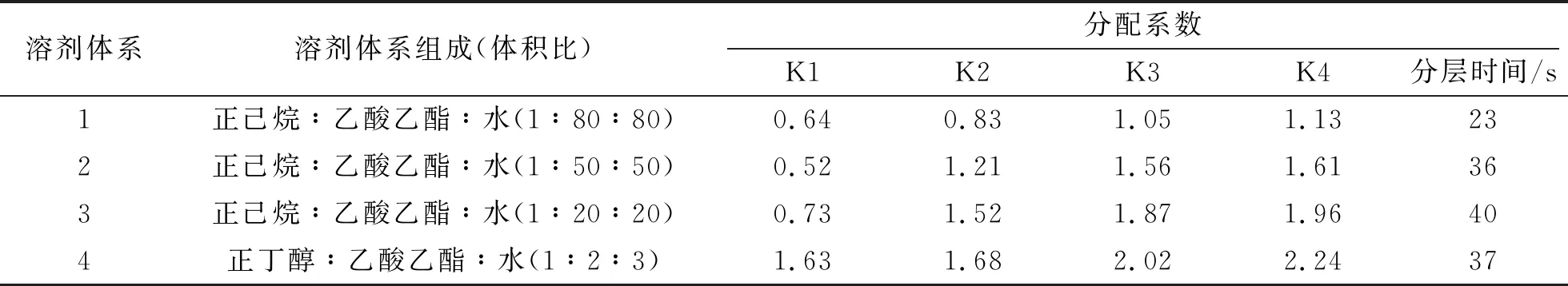
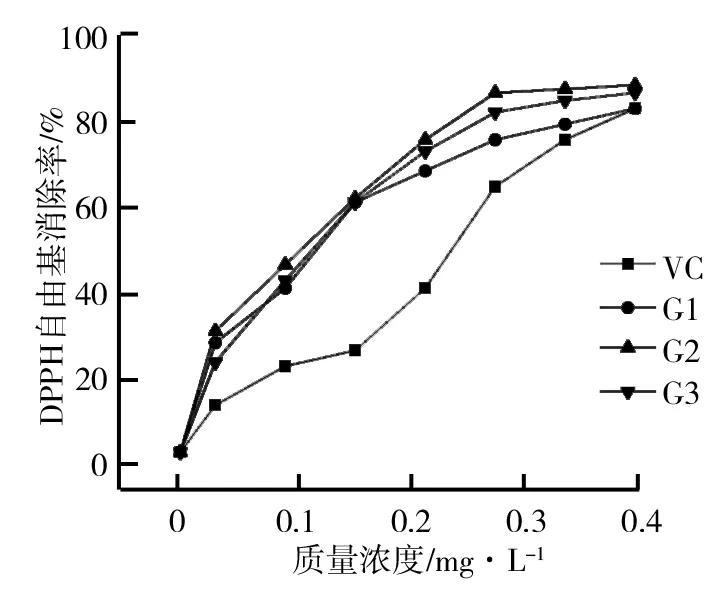
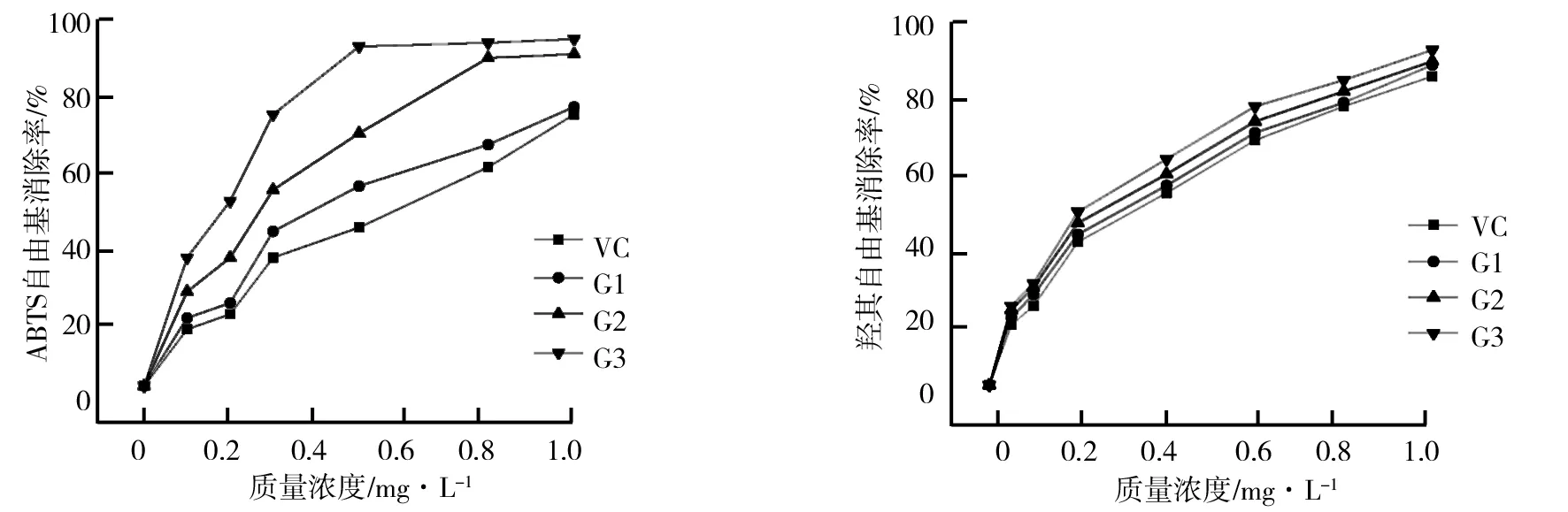
(2)HSCCC法分离荷叶原花青素溶剂体系的选择。分离溶剂体系的选择对于高速逆流分离效果的好坏有着重大的影响。一个好的溶剂体系应该具备以下3个条件:具备较高的固定相保留率;分配系数K范围应该在0.5 (3)HSCCC分离纯化原花青素。配好所选的溶剂体系倒入分液漏斗中,充分摇匀,并记录分层时间,分配半小时达到平衡,倒出上下相溶剂,超声脱气30 min备用。取上述浓缩后的浸膏0.5 g,取等量上、下相将其溶解,过0.45 μm过滤器后作为样液。先打开紫外检测器开始预热,以流速40 mL/min泵入固定相,待固定相充满整个管路后,色谱检测器出口端流出固定体积相约为50 mL后停泵。将主机调至正转,转速设置为900 r/min,同时以2 mL/min的流速泵入流动相,至检测器出口端流出液体且紫外信号稳定,此时系统达到平衡,进样10 mL并启动色谱工作站记录谱图,同时将检测波长设为280 nm,分峰段收集出口段的组分用于之后的HPLC检测。 (4)高效液相色谱鉴定。色谱条件:流动相B:乙腈,流动相A:0.4%乙酸水溶液;色谱柱:C18,柱温30 ℃,进样量10 μL,将上述组分配制成甲醇溶液,用于HPLC检测,洗脱程序。HPLC洗脱条件如表2所示。 表2 HPLC洗脱条件 (5)原花青素含量的测定。研究采用香草醛盐酸法测定原花青素的含量,按条件配制A液B液,其中A液为1%的香草醛甲醇溶液,B液为8%的盐酸甲醇溶液。将A液B液按照1∶1的比例混合成显色剂。配制儿茶素标准溶液1.2 mg/mL,分别取标准液1 mL、2 mL、3 mL、4 mL、5 mL定容至10 mL,分别取1 mL标准品溶液并加入5 mL显色剂,在避光条件下30 ℃水浴加热30 min,随后测定吸光度并绘制儿茶素标准曲线。取样液1 mL加入显色剂测定其吸光度,根据标准曲线计算其原花青素的质量浓度,并计算出原花青素含量。计算公式如下: M=C×V, 式中,C为原花青素质量浓度;V为样品体积;M为原花青素质量。 (6)荷叶原花青素组分的抗氧化活性研究。对高速逆流色谱分离出的组分进行抗氧化活性研究即对所得组分进行清除DPPH、ABTS+和羟基自由基的能力进行实验研究。 ①DPPH自由基清除率的测定:参考孙志武[11]等的方法略作改动,分别吸取0.4 mL不同质量浓度样品溶液于试管中,加入2 mL 0.1 mmoL/L的DPPH溶液,混合均匀,避光反应30 min,在波长517 nm处测其吸光度记为A2;吸取0.4 mL不同质量浓度的样品溶液与2 mL无水乙醇混合均匀,避光反应30 min,在波长517 nm处测其吸光度记为A1;吸取0.4 mL无水乙醇,加入2 mL 0.1 mmoL/L的DPPH溶液,混合均匀,避光反应30 min,在波长517 nm处测其吸光度记为A0。同时测定维生素C对DPPH自由基的清除率作为对比。按照下列公式计算清除率: ②ABTS+自由基清除率的测定:参照蒋孟君[12]等的方法,将0.5 mL不同质量浓度原花青素溶液与4 mL ABTS+工作液混匀,30 ℃水浴加热6 min,在波长734 nm处测其吸光度A2;将0.5 mL超纯水与4 mL ABTS+工作液混匀,30 ℃水浴加热6 min,在波长734 nm处测其吸光度A0;将0.5 mL不同质量浓度原花青素溶液与4 mL无水乙醇混匀,30 ℃水浴加热6 min,在波长734 nm处测其吸光度A1。以VC溶液作为阳性对照,按照下列公式计算清除率: ③羟基自由基清除率测定:参考杨芬[13]等的方法略作改动,采用水杨酸法测定原花青素对羟基自由基(·OH)的清除作用。吸取不同质量浓度样品1 mL,分别加入2 mL 1.8 mmol/L FeSO4和1.5 mL水杨酸乙醇溶液,然后加入0.1 mL 0.03% H2O2,置于37 ℃中水浴加热0.5 h后3 000 r/min离心分离10 min,于510 nm处测吸光度记为A1,VC作为阳性对照,测得吸光度记为A0,再取不同质量浓度样品1 mL,分别加入2 mL 1.8 mmol/L FeSO4和1.5 mL水杨酸乙醇溶液,然后加入0.1 mL H2O,于510 nm处测得吸光度记为A2羟基自由基(·OH)。清除率计算公式如下: 高速逆流色谱技术分离经大孔树脂纯化后的荷叶原花青素HSCCC色谱图如图1所示。其中溶剂系统为正己烷∶乙酸乙酯∶水=1∶80∶80。 图1 高速逆流色谱技术分离经大孔树脂纯化后的荷叶原花青素HSCCC色谱图 根据HPLC图可知,共检测出四种原花青素物质,其中包括儿茶素、表儿茶素、表儿茶素没食子酸和原花青素B2。四种原花青素标准品图如图2所示。由图2可知,从左至右依次为儿茶素、表儿茶素、表儿茶素没食子酸酯、原花青素B2。原花青素样品的HPLC图如图3所示。经HSCCC分离后的组分G1的HPLC图如图4所示。由图4可知,组分G1中含有表儿茶素没食子酸酯和原花青素B2。经HSCCC分离后的组分G2的HPLC图如图5所示。由图5可知,G2为表儿茶素。经过HSCCC分离后的组分G3的HPLC图如图6所示。由图6可知,G3为儿茶素。 图2 四种原花青素标准品图 图3 原花青素样品的HPLC图 图4 经HSCCC分离后的组分G1的HPLC图 图5 经HSCCC分离后的组分G2的HPLC图 图6 经过HSCCC分离后的组分G3的HPLC图 溶剂系统的选择对分离效果至关重要,实验设计不同的溶剂体系对于荷叶原花青素分离效果的影响。以上下相溶剂系统的分层时间以及物质在两相中的分配系数作为衡量标准,得到溶剂体系正己烷∶乙酸乙酯∶水=1∶80∶80,按比例将溶剂配置好,再将配置好的溶剂放入分液漏斗中,摇匀上下相,记录分层时间。以上相作为固定相,下相作为流动相,以40 mL/min泵入上相,再以2 mL/min泵入下相,水浴温度设为25 ℃,转速为900 r/min,检测波长设为280 nm,收集峰组分,电脑记录谱图。固定相保留率为62%。其中保留率计算公式为: 式中,V总为柱总体积;V流为固定相被流动相排出的体积。 分配系数K的测定。使用分液漏斗配置好溶剂系统,充分摇匀,静置平衡,记录溶剂系统分层时间T。取适量荷叶原花青素冻干样用下相溶解,取3 mL下相加入相同体积上相充分混合,分离上下相用于高效液相色谱检测,分配系数K计算公式为: 式中,A1为荷叶原花青素目标组分在上相中的峰面积;A2为荷叶原花青素目标组分在下相中的峰面积。 HSCCC溶剂体系表如表3所示。从表3中可以看出,溶剂体系2和溶剂体系3溶剂系统分层时间过长,而溶剂体系4则分配系数过大且溶剂系统分层时间过长,据此选择溶剂体系1作为高速逆流色谱分离的溶剂体系。 表3 HSCCC溶剂体系表 (1)DPPH自由基清除实验。荷叶原花青素经过高速逆流色谱分离出的三种组分对DPPH自由基的清除率如图7所示。HSCCC分离出的三种组分对DPPH自由基的清除率,随着三种物质质量浓度增加,对DPPH自由基的清除率也随之增加。在样品质量浓度为0.03 mg/L时,DPPH自由基的清除率为G2>G1>G3>VC,当VC质量浓度在0.15~0.27 mg/L范围内,随着质量浓度增加,VC对DPPH的清除率显著提升。当三种组分样品质量浓度达到0.27 mg/L时,随着质量浓度的增加,样品对DPPH自由基的清除率变化趋于稳定。当VC质量浓度达到0.39 mg/L时,对DPPH自由基的清除率为88.21%。由图7可知三种组分与VC的自由基半数清除数有显著差异, 且G2的DPPH自由基清除率最高。 图7 荷叶原花青素经过高速逆流色谱分离出的三种组分对DPPH自由基的清除率 (2)ABTS+自由基清除实验。荷叶原花青素经过高速逆流色谱分离出的三种组分对ABTS+自由基的清除率的变化如图8所示。由图8可知,随着样品质量浓度的增加,ABTS+自由基的清除率也逐步增加。从半数自由基清除数上看,G3的自由基清除效果最好。自由基清除率大小为G3>G2>G1>VC,在质量浓度为0.1~0.2 mg/mL时,G1与VC的自由基清除率差别较小。在质量浓度为0~0.5 mg/mL时,G3的自由基清除率随质量浓度的增加有显著提升。当质量浓度大于0.5 mg/mL时,自由基清除率趋于稳定。G3的IC50值显著小于其他组分,具有良好的ABTS+自由基清除能力。 (3)羟基自由基清除实验。荷叶原花青素经过高速逆流色谱分离出的三种组分对羟基自由基的清除率大小的变化如图9所示。由图9可知,随着样品质量浓度的增加,羟基自由基的清除率也在逐步增加,从半数清除自由基上看,G3的自由基清除效果最好,清除率大小为G3>G2>G1>VC,总体而言,分离出的原花青素各个组分的羟基自由基清除率都要优于VC。 图8 荷叶原花青素经过高速逆流色谱分离出的三种组分对ABTS+自由基的清除率的变化 图9 荷叶原花青素经过高速逆流色谱分离出的三种组分对羟基自由基的清除率大小的变化 实验采用了高速逆流色谱分离技术,对荷叶原花青素进行分离,通过实验确定采用溶剂系统为正己烷∶乙酸乙酯∶水=1∶80∶80,收集分离出的三种组分经HPLC鉴定表明G1为表儿茶素没食子酸酯和原花青素B2,G2为表儿茶素,G3为儿茶素。将HSCCC分离出的三种组分进行抗氧化活性研究,实验结果表明DPPH自由基清除效能G2>G1>G3>VC,ABTS+自由基清除效能G3>G2>G1>VC,羟基自由基清除率大小为G3>G2>G1>VC。研究通过高速色谱法有效地将荷叶原花青素中的目标组分分离出来,并进行相应抗氧化活性研究,为荷叶资源应用开发提供了一定的参考。较其他研究而言,实验采用的高速逆流色谱有着快捷高效等特点,后期还需对组分进行结构鉴定及分离纯化工艺优化,以便为荷叶资源的开发利用提供更多的参考。
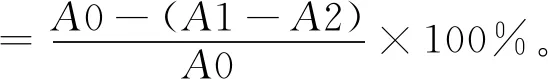

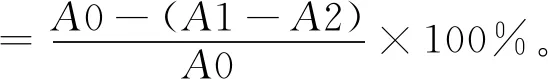
2 结果与分析
2.1 HSCCC分离荷叶原花青素
2.2 荷叶原花青素色谱分析
2.3 HSCCC分离纯化原花青素条件的建立
2.4 荷叶原花青素抗氧化活性研究
3 结论
