多囊卵巢综合征患者血清AMH,LH和FSH水平检测及临床应用研究 *
2019-10-16李嘉丽晏耀明吴玉红
杜 静,李嘉丽,晏耀明,唐 晖,吴玉红,杨 超
(1.北京大学深圳医院检验科,深圳 518036;2.深圳市人民医院外科,广东深圳 518020)
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是生育年龄妇女中常见的一种内分泌代谢紊乱所致的慢性疾病,发生率占育龄妇女的5%~10%[1],严重危害女性身心健康,目前发病机制仍不明确。体内分泌高水平的雄激素是引起PCOS发生发展的重要原因,家族遗传和环境因素也和PCOS发病相关。近年来,抗缪勒管激素(AMH)以其独特的敏感性和特异性被认为是一种诊断多囊卵巢综合征的重要指标。本文对461例PCOS患者血清AMH水平进行研究,探讨AMH和LH/FSH检测在PCOS诊断中的临床价值。
1 材料与方法
1.1 研究对象 选取2016年3月~2018年4月于北京大学深圳医院检测性激素的女性1 274例,其中PCOS患者461例,年龄12~40岁,平均年龄27岁,诊断标准符合鹿特丹标准;子宫良性病变患者353例,年龄18~40岁,平均年龄33岁;卵巢良性病变患者138例,年龄21~40岁,平均年龄31岁;生殖系统感染及炎性疾病患者137例,年龄20~40岁,平均年龄31岁;健康女性185例作为正常对照,年龄20~40岁,平均年龄33岁。研究对象的基本情况,见表1。
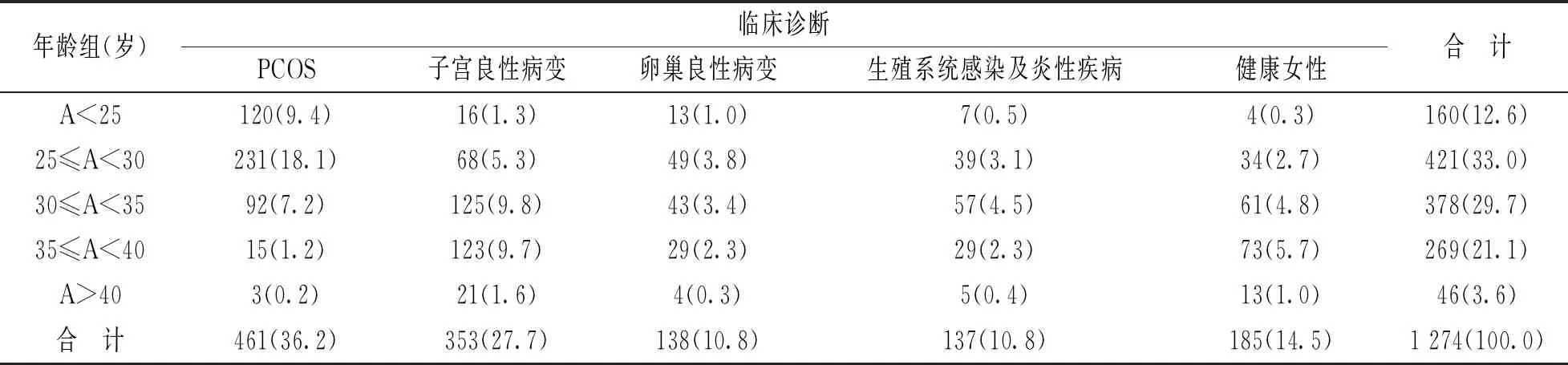
表1 研究对象的基本情况[n=1 274,n(%)]
1.2 仪器与试剂 用深圳亚辉龙公司iFlash 3000化学发光仪和配套AMH试剂检测血清AMH水平,用贝克曼公司DXI800仪器及配套试剂检测血清LH和FSH浓度。
1.3 方法 所有患者和对照均检测血清AMH,LH和FSH。月经周期第2~5天空腹静脉血3 ml,离心分离血清立刻进行检测。操作与结果判断均按照试剂盒说明书进行。
2 结果
2.1 常见妇科疾病患者血清AMH水平比较 将患者按疾病和年龄分组,各疾病组(PCOS,子宫良性病变、卵巢良性病变、生殖系统感染及炎性疾病)和健康女性组之间的血清AMH水平差异均具有统计学意义(P<0.05),各年龄段之间的血清AMH水平差异也均具有统计学意义(P<0.05),见表2。其中PCOS,生殖系统感染及炎性疾病患者的血清AMH水平随着年龄的增加而降低,而25岁以后的子宫良性病变患者、卵巢良性病变患者和健康女性者的血清AMH水平也随着年龄的增加而降低,差异均有统计学意义(P<0.05)。

表2 按年龄和疾病分组血清AMH(ng/ml)水平
进一步比较相同年龄组常见妇科疾病患者与健康女性血清AMH水平,见表3。PCOS明显高于健康对照组,差异具有统计学意义(P<0.05)。子宫良性病变、卵巢良性病变、生殖系统感染及炎性疾病患者的血清AMH水平与同年龄组的健康对照相比,差异无统计学意义(P<0.05)。

表3 AMH水平两两比较显著性检验(P)
2.2 AMH与FSH,LH,LH/FSH比较及相关性分析 见表4。PCOS组血清中的AMH,LH,LH/FSH水平显著高于健康女性对照组,FSH水平明显小于对照组,差异均有统计学意义。

表4 PCOS组和健康女性对照组血清AMH 与FSH,LH,LH/FSH比较
对血清AMH和FSH,LH,LH/FSH水平进行Pearson相关性分析,结果显示两组血清AMH与LH/FSH存在中度相关(r≤0.3为低度相关,0.3 表5AMH和FSH,LH,LH/FSH相关性分析 项 目PCOS组(n=461)rP 健康女性组(n=185)rPFSHLHLH/FSH-0.1720.2740.3040.0000.0000.000 -0.1390.2160.4640.0590.0030.000 2.3 AMH和LH/FSH诊断PCOS的ROC曲线分析 见表6和图1。 图1 AMH和LH/FSH诊断PCOS的ROC曲线 表6AMH和LH/FSH诊断PCOS的ROC曲线下面积 项 目截断值特异度(%)灵敏度(%)曲线下面积AMH(ng/ml)LH/FSH6.8950.96079.680.282.875.50.8860.832 采用SPSS16.0软件进行ROC曲线分析,在AMH=6.895 ng/ml时,诊断能力最高。在LH/FSH=0.960时,诊断能力最高。AMH与LH/FSH诊断PCOS的ROC曲线下面积的差异有统计学意义(P<0.05)。 AMH是转化生长因子β(TGF-β)超家族成员,由睾丸未成熟的 Sertoli细胞及卵巢窦前卵泡和小窦卵泡的颗粒细胞所分泌的一种糖蛋白。大量的研究表明血清AMH水平与窦状卵泡数目和卵母细胞数目相关,AMH是预测卵巢储备的良好指标,是卵巢年龄的生物标志[2]。AMH 是最早随着女性年龄增长而发生改变的激素,从幼儿期到青春期AMH水平是上升的,青春期到25岁之前AMH进入平台期,25岁以后,随着年龄的逐渐增长,女性的卵巢容量逐年降低1.1%,而AMH浓度也逐步减少,每年的降幅达5.6%,卵巢中大卵泡数量逐渐增加[3]。在绝经期前5年就几乎为零,低AMH水平可以预测绝经期时间[4]。本研究也证实血清AMH水平随着年龄增加而下降,这种下降情况在PCOS患者、常见妇科疾病患者和健康女性者中均存在,显示了血清AMH水平与年龄密切相关。 PCOS是以无排卵和高雄激素为特征女性常见的内分泌疾病,好发于青少年和育龄妇女,其发病多因性,临床表现多态性。PCOS的一个明显特征是其卵巢中的小窦性卵泡数是正常卵巢组织的2~3倍,其循环AMH浓度也比正常妇女高2~3倍[5]。AMH在PCOS的发生发展中起着重要作用,AMH水平升高会抑制芳香化酶的表达减少阻碍了雄激素向雌激素产生,引发PCOS特征性的高雄激素血症。高雄激素血症可促进始基卵泡的发生和生长,以及生长卵泡内膜细胞及颗粒细胞的增殖,从而产生更多的AMH,形成AMH和雄激素之间的恶性循环。大量发育不成熟的窦前卵泡和小的窦前卵泡在卵巢组织内堆积,形成特有的多囊卵巢的形态[6]。本研究中的PCOS患者中血清AMH水平也比健康女性高2~4倍,提示了AMH是诊断PCOS的一个重要血清标志物。 虽然AMH对PCOS的诊断效能在不同研究中有所差异,但都肯定了AMH对PCOS诊断具有重要价值。PCOS鹿特丹诊断标准的核心是卵巢多囊样改变,但超声下窦卵泡数目易受操作者主观因素的影响而导致诊断出现偏倚,而AMH与窦状卵泡数目和卵母细胞数目密切相关,不易受操作者主观因素的影响,也不因月经周期变化而变动,相对客观和稳定。此外,AMH升高能反映PCOS的严重性,可作为评价PCOS治疗效果的指标,指导该病的治疗。同时AMH对选择促排卵药物有一定的指导意义[7]。目前针对AMH 的抗体或者拮抗剂正在研发中,AMH在PCOS的诊断治疗中有着广泛的应用前景。 LH和FSH是由垂体前叶在下丘脑分泌的促性腺激素释放激素(GnRH)刺激下所分泌的一种糖蛋白。在临床上,基础LH和FSH的水平是常用来反映卵巢功能储备的一个间接指标,LH/FSH比值作为卵巢反应性的预测因子,有较好的特异度,但敏感度不高[9]。PCOS患者体内的LH相对升高,维持在正常女性月经周期的中卵泡期上下水平,而FSH相对稍降低或正常,相当于早卵泡期水平,导致LH/FSH比值增高。本文对AMH,生殖激素LH和FSH进行相关性分析,显示AMH和LH/FSH比值呈现中等水平的正相关,和单咏梅等[10]人的研究结果一致,提示LH/FSH可以和AMH共同应用于临床评估。 ROC曲线通常用来直观地确定诊断试验的最佳分界值,可比较不同方法的诊断价值。本文通过绘制ROC曲线,发现LH/FSH在截断值为0.960时,敏感度为75.5%,特异度为80.2%,曲线下面积为0.832,对PCOS诊断效能最大。而AMH在截断值为6.895 ng/ml时,敏感度为82.8%,特异度为79.6%,最大曲线下面积为0.886。我们的结果提示LH/FSH对PCOS具有较好的诊断价值,但AMH诊断PCOS的效能比LH/FSH更好,两者联合应用可提高诊断的敏感度。 综上所述,血清AMH水平随年龄增长而下降,血清AMH水平升高是多囊卵巢综合征患者生殖内分泌代谢紊乱的重要特征,采用ROC曲线分析得到AMH的cutoff值为6.895时,对多囊卵巢综合征诊断具有较大临床价值。AMH和LH/FSH可共同作为诊断PCOS的实验室指标,有助于PCOS的早期诊断,为后续的治疗奠定良好的基础。


3 讨论
