Ryanodine受体蛋白的分子结构和理化性质分析
2019-10-16朱家佳龙鼎新
杨 越, 朱家佳, 唐 乖, 龙鼎新
(南华大学 公共卫生学院, 衡阳 421001)
钙离子(Calcium,Ca2+)是广泛存在于细胞内的第二信使,其参与调节机体内细胞增殖、分化、细胞自噬与细胞凋亡等各种生理过程[1]。目前,已知最大的钙离子释放通道蛋白Ryanodine受体(Ryanodine receptor, RyR)是以植物生物碱Ryanodine命名的[2]。RyR是从肌浆网/内质网的细胞内贮存中释放钙的一种离子通道[3-4]。该通道位于肌肉、神经元和许多其他类型细胞的内质网上。已知的RyR有3种亚型(RyR1、RyR2、RyR3),RyR1主要在骨骼肌中表达,RyR2在心肌中高水平表达,而RyR3在不同组织中普遍表达,但在脑和膈膜中相对丰富[5]。并且RyR调节的细胞内钙离子浓度变化是一系列生物过程的基础[6]。异常RyR介导的Ca2+释放已经与恶性高热[7]、心力衰竭[8]和神经变性疾病[9]等几种疾病密切相关[10]。
细胞含有多种与RyR相互作用的蛋白质分子,并可以对其活性产生调节作用。因此,RyR 在许多信号通路中均有重要作用,虽然目前已展开对于此类大分子晶体的研究,但对于其详细的结构信息分析目前还没有研究者对其进行整合。因此本文拟基于生物信息学方法,首次对人RyR蛋白结构及理化性质等进行分析整理,为RyR的机制研究及生物学实验等提供重要的参考依据,帮助研究人员找到调查基因以及蛋白质的线索。
1 材料与方法
在美国国立生物技术信息中心(NCBI)数据库中搜索并下载人RyR序列;使用ProtParam程序[11](http://web.expasy.org/protparam)预测RyR 3种亚型蛋白的理化性质;利用Protscale程序[11](http://web.expasy.org/protscale)进行疏水性分析;使用ExPASy-GOR IV(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_gor4.html)进行二级结构预测;使用SignalP4.1Server[12](http://www.cbs.dtu.dk/services/SignalP/)在线分析信号肽切割;使用ProtComp 9.0在线(http://linux1.softberry.com/berry.phtml?topic=protcomppl&group=programs&subgroup=proloc)进行亚细胞定位预测;使用TMHMM Serverv.2.0(http://www.cbs.dtu. dk/services/TMHMM/)进行蛋白跨膜结构预测;使用NetPhos 2.0 Server[13](http://www.cbs.dtu.dk/services/NetPhos/)预测磷酸化位点;利用PredictProtein(https://www.predictprotein.org/)分析蛋白信息;使用BLAST(https://blast.ncbi.nlm.nih. gov/Blast.cgi)进行同源搜索,并利用ClustalX[14]软件进行多序列比对分析,随后使用MEGA5[15]软件构建系统进化树;使用STRING数据库(https://string-db.org/cgi/input.pl)分析蛋白质-蛋白质相互作用。
2 结果与分析
2.1 人RyR蛋白序列的查找
根据文献报道,已有3种人RyR亚型被确认,其NCBI序列号分别为: AAA60294、NP_001026、CAA04798。按序列号搜索NCBI数据库获得它们的氨基酸序列,并将其分别命名为RyR1、RyR2和RyR3。
2.2 RyR理化性质分析
使用ProtParam分析RyR 3种亚型理化性质、分子式、分子量和等电点等,结果详见表1。
随后利用Protscale对RyR蛋白进行疏水性和亲水性分析,如表2及图1所示。结果进一步表明,3种RyR蛋白均为亲水性蛋白。
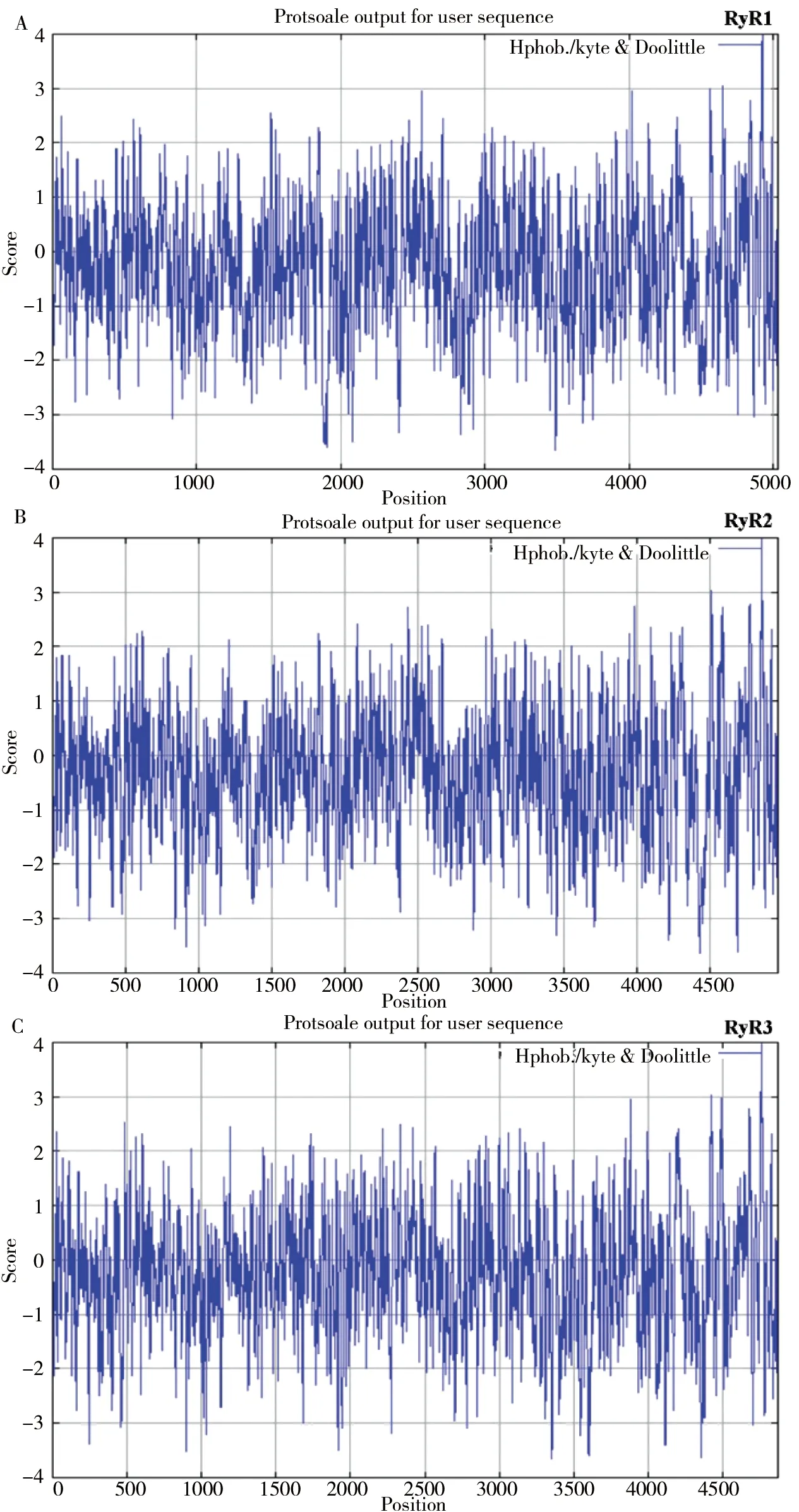
图1 RyR蛋白疏水性/亲水性预测
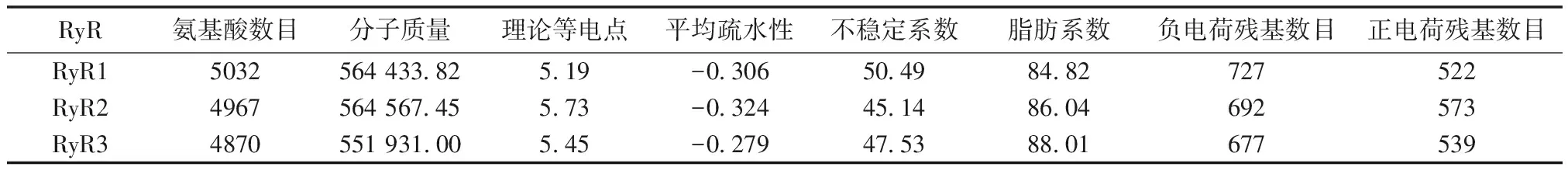
表1 RyR蛋白理化性质

表2 RyR蛋白亲水性与疏水性氨基酸残基位置
2.3 蛋白质二级结构分析
主要多肽链的空间原子的排列决定蛋白质的二级结构。使用GOR IV二级结构预测模块计算RyR二级结构,并绘制结构模型(表3及图2)。 结果显示RyR蛋白含有大量α-螺旋及无规则卷曲,约占85%,推测其为RyR主要的二级结构原件。
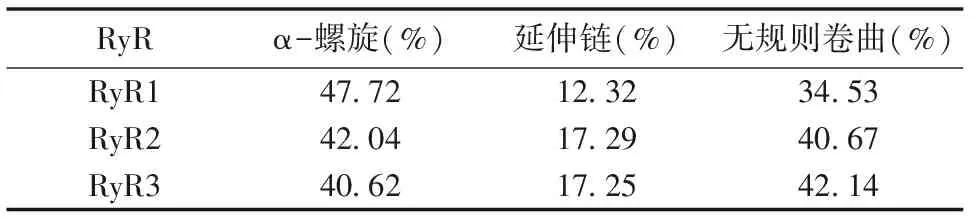
表3 RyR蛋白二级结构特征
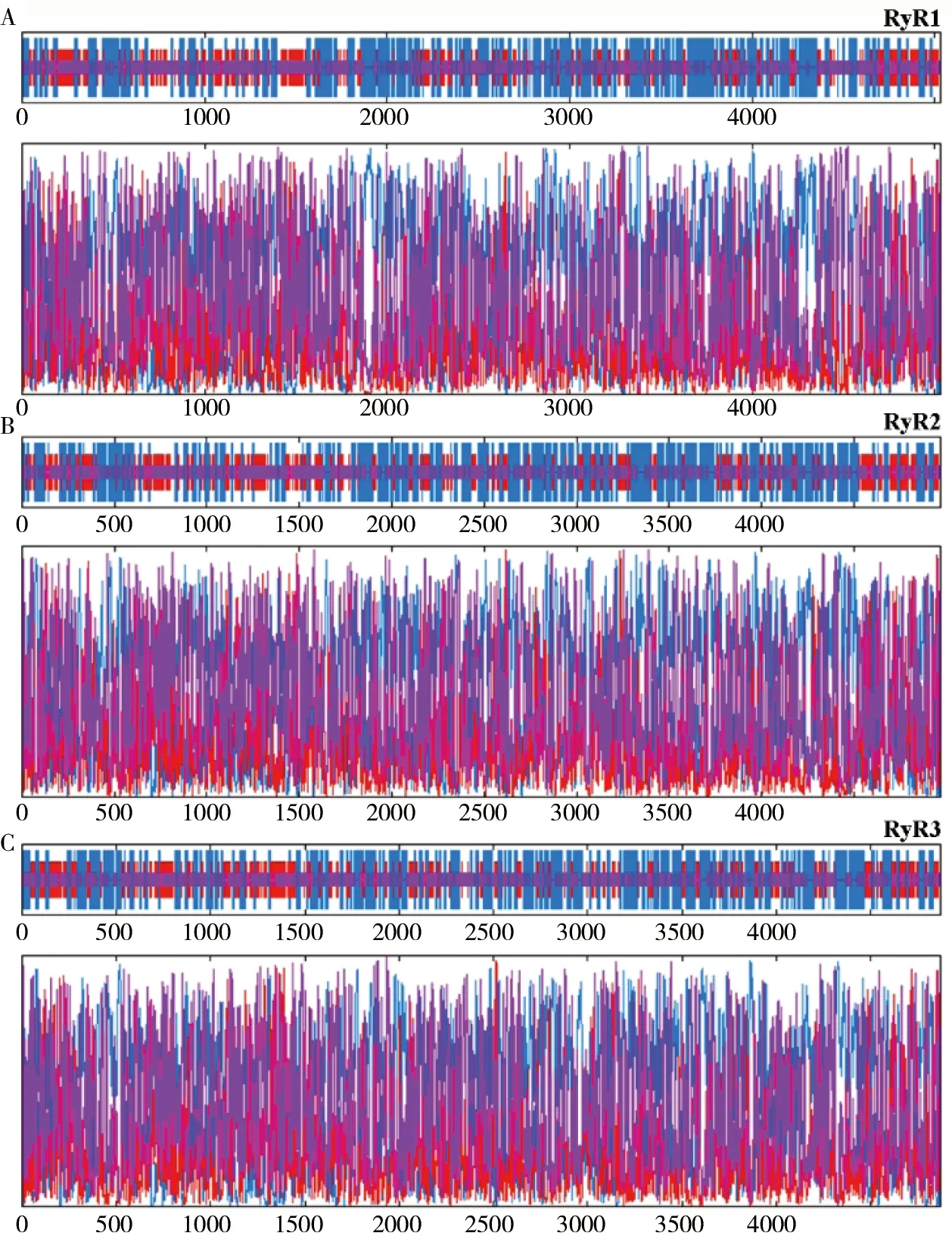
图中A、B、C的上部为示意图;下部为高峰数字。蓝色:α-螺旋;红色:延伸链;紫色:不规则的卷曲结构
图2RyR蛋白二级结构分析
Figure 2 Secondary structure analysis of RyR proteins
2.4 信号肽切割位点预测
使用SignalP-4.1来预测RyR蛋白信号肽及切割位点。结果显示,RyR蛋白没有信号肽位点,属于非分泌性蛋白(表4)。
2.5 亚细胞定位预测
使用ProtComp 9.0软件在线预测RyR蛋白亚细胞定位,提示其可能定位于内质网上(表5)。
2.6 蛋白跨膜结构预测
使用TMHMM在线软件进行RyR蛋白跨膜结构分析,结果如图3所示,RyR蛋白均为跨膜蛋白。
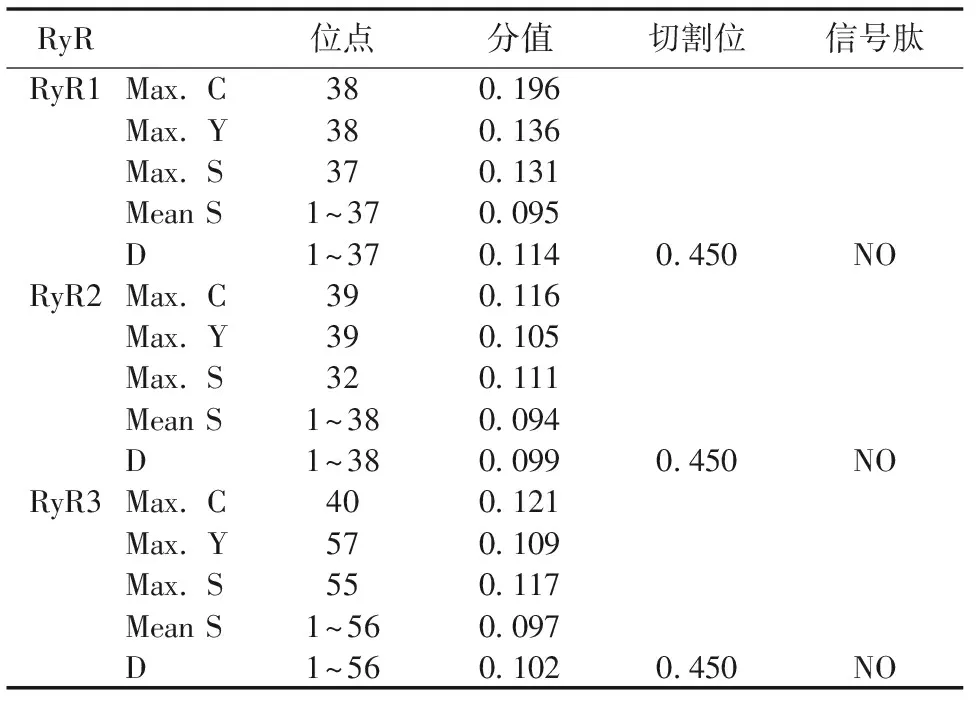
表4 RyR蛋白质信号肽切割位点预测
注:Max. C表示原始切割位点评分最大值;Max. Y表示合并的切割位点评分最大值;Max. S表示信号肽评分最大值;Mean S表示可能的信号肽的平均S值;D表示平均值S和Y分数最大值的加权平均值,用于区分是否为信号肽的分数
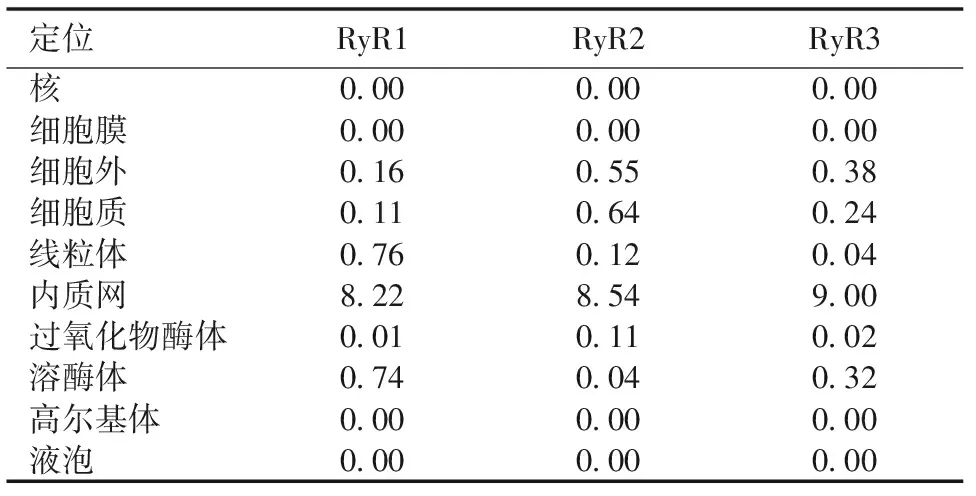
表5 RyR蛋白亚细胞定位预测
2.7 磷酸化位点分析
使用NetPhos 2.0 Server Online预测RyR蛋白磷酸化位点,结果见表6。结果为可能的蛋白激酶磷酸化位点分布。
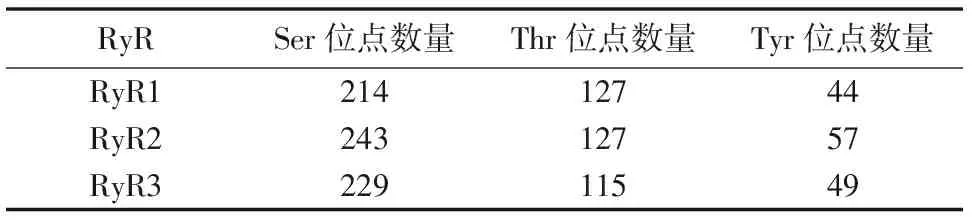
表6 RyR蛋白磷酸化位点
2.8 RyR蛋白信息预测
PredictProtein是欧洲分子生物学实验室提供的蛋白质序列和结构的在线预测网站,可从中获得蛋白质二级结构、二硫键、跨膜螺旋等信息。RyR蛋白结合位点,跨膜结构域和二硫键在线预测结果见图4、图5和图6。预测结果显示RyR蛋白均具有多蛋白结合位点,跨膜结构域与TMHMM预测结果一致,均没有二硫键。RyR蛋白分子功能本体论结果表明:该蛋白具有结合能力,底物特异性跨膜转运蛋白活性,离子通道活性,离子跨膜转运蛋白活性等(表7)。RyR蛋白生物学过程本体结果表明:参与离子运输、单生物体过程及阳离子转运等(表8)。
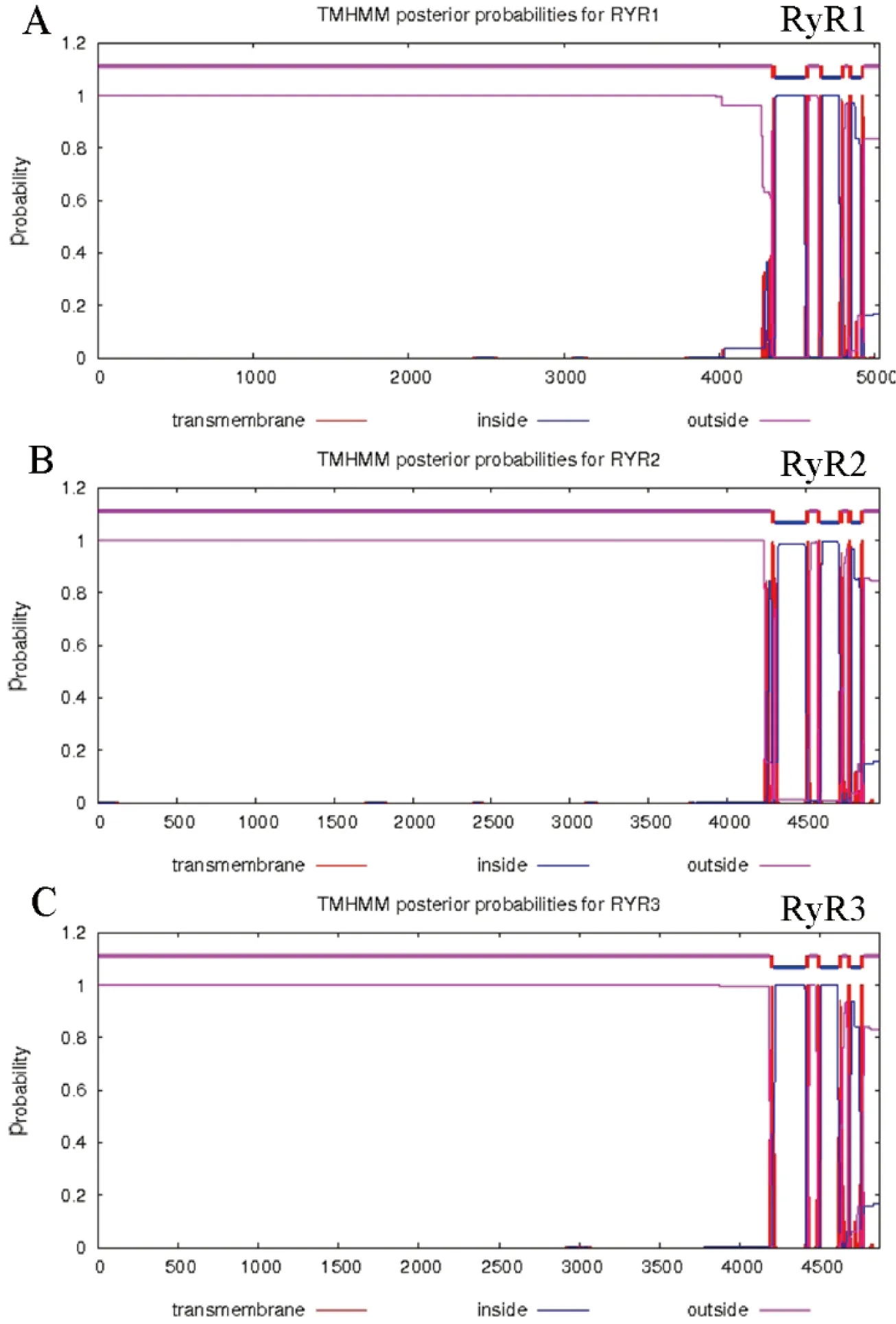
图3 RyR蛋白跨膜结构预测

图4 RyR蛋白的结合位点预测
2.9 多序列对比和系统进化树构建
利用NCBI 中的BLAST对人RyR蛋白3种亚型序列进行BLASTp 搜索,选择同一性较高的序列,获得与RyR1、RyR2、RyR3同源的31个氨基酸序列,对这些序列与RyR各亚型序列进行多序列对比,RyR 3种亚型与已知不同种属RyR序列分别有95.90%、95.57%和96.79%的序列相似性。随后利用MEGA5进行系统进化树构建,并对其进行聚类分析。系统进化树聚类分析结果(图7)显示,在RyR的3种亚型中,RyR2与RyR3最先聚为一类,随后与RyR1聚为一类。对于不同种属的同源序列之间,RyR的3种亚型均与家兔属亲缘性最近。

图5 RyR蛋白的跨膜结构域预测

图6 RyR蛋白质的二硫键预测
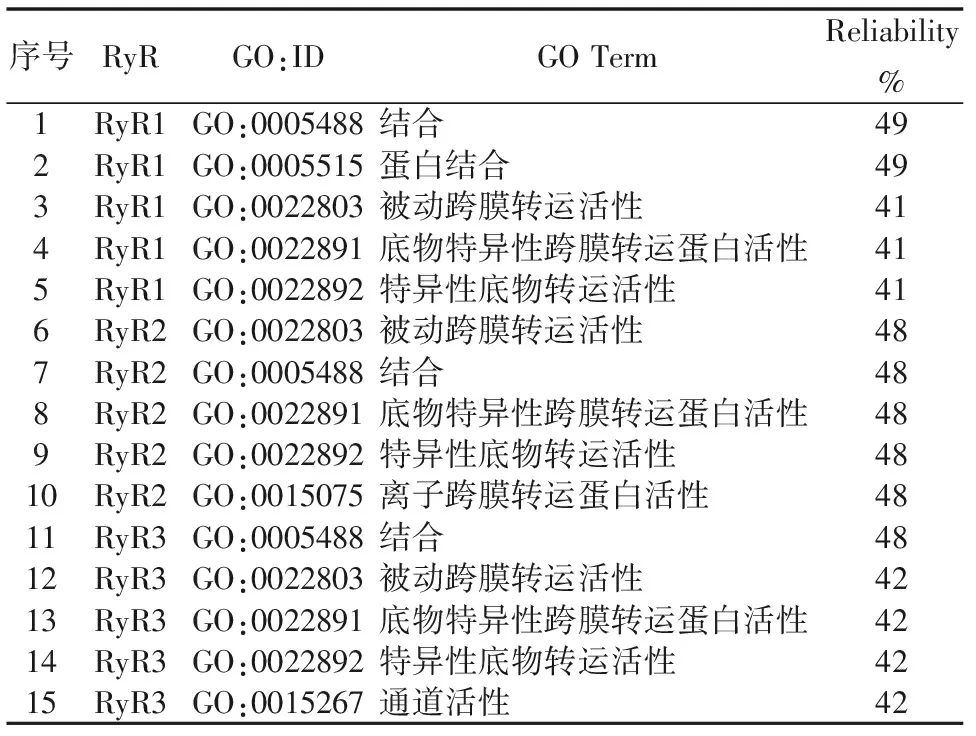
序号RyRGO:IDGO TermReliability%1RyR1GO:0005488结合492RyR1GO:0005515蛋白结合493RyR1GO:0022803被动跨膜转运活性414RyR1GO:0022891底物特异性跨膜转运蛋白活性415RyR1GO:0022892特异性底物转运活性416RyR2GO:0022803被动跨膜转运活性487RyR2GO:0005488结合488RyR2GO:0022891底物特异性跨膜转运蛋白活性489RyR2GO:0022892特异性底物转运活性4810RyR2GO:0015075离子跨膜转运蛋白活性4811RyR3GO:0005488结合4812RyR3GO:0022803被动跨膜转运活性4213RyR3GO:0022891底物特异性跨膜转运蛋白活性4214RyR3GO:0022892特异性底物转运活性4215RyR3GO:0015267通道活性42
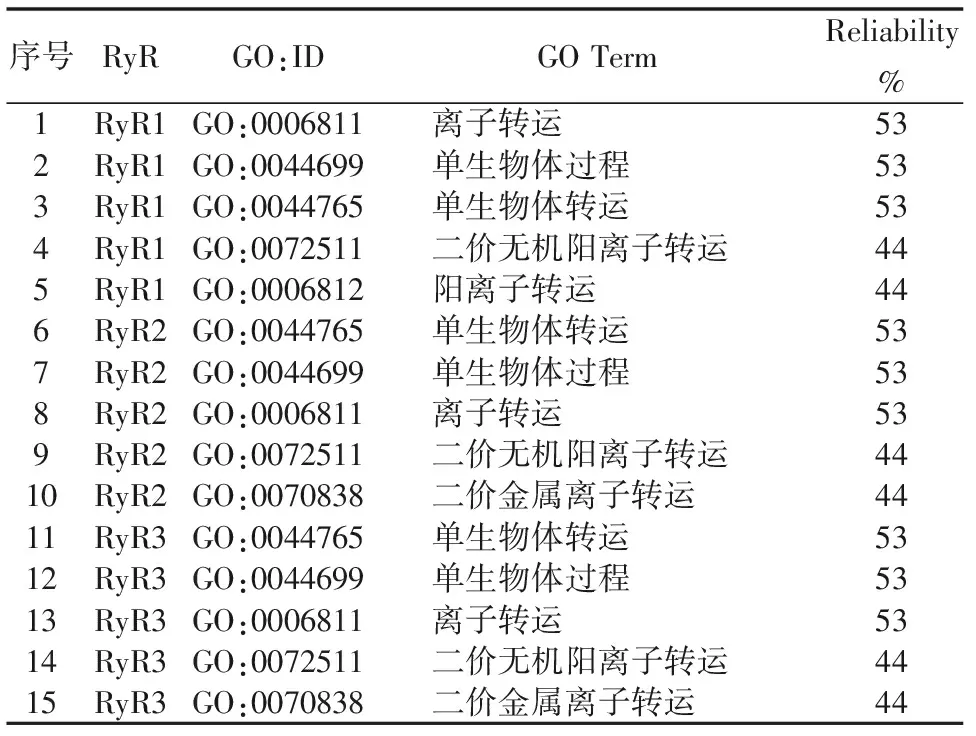
表8 RyR生化过程本体论
2.10 蛋白质-蛋白质相互作用分析
使用STRING数据库在线分析RyR的蛋白质互作网络,结果显示RyR蛋白均与FKBP1B、CALM、TRDN等蛋白具有相互作用(图8)。
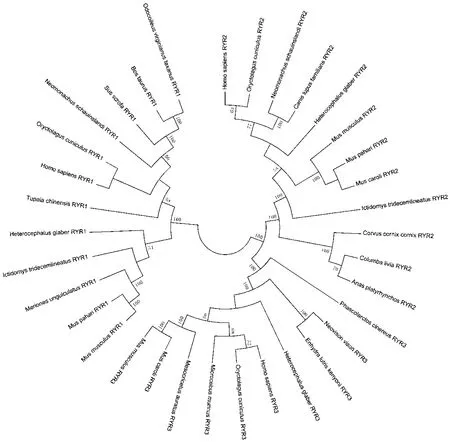
图7 RyR蛋白与其他物种同源序列的遗传关系
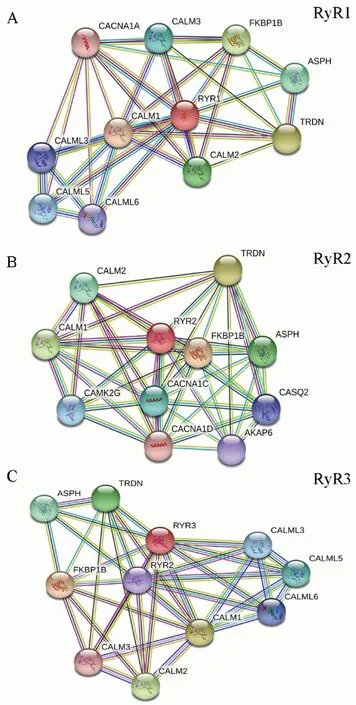
网络节点表示蛋白质,蛋白间的连线表示预测的功能关联。红线:基因融合;绿线:基因相近;蓝线:基因共同产生;紫线:实验证明;黄线:文本挖掘证据;浅蓝线:辅助数据库证据;黑线:基因共同表达
图8RyR蛋白互作网络
Figure 8 The protein-protein interaction network of RyR proteins
3 讨论
Ca2+在生命活动中起着至关重要的作用, 是影响或决定许多细胞反应的独立第二信使[16]。而胞内Ca2+来源于质膜上电压和受体门控通道以及胞内钙释放通道IP3R 和RyR介导的钙释放[17-18]。RyR是一种主要的钙诱导钙释放(Calcium induced calcium release, CICR)通道,位于神经元和大多数细胞类型的内质网膜上[19]。RyR控制细胞内储存的如内质网的Ca2+外流进入细胞质的过程[20]。研究发现,RyR在整个神经系统中都大量存在,并通过CICR控制神经元中的多种进程,包括囊泡释放、膜去极化和凋亡等。RyR含有一个大的胞质结构域,它与蛋白质、小分子和信号分子相互作用,调节由该通道介导的CICR[21]。在神经元中,RyR和L型Ca2+通道之间存在紧密的功能耦合。神经元钙信号在记忆过程中发挥关键作用,RyR介导的钙释放参与了空间记忆过程的获取和整合[22-23]。特别是在大脑中,RyR参与各种功能,如神经元活力、突触可塑性和更高的认知功能,如学习和记忆等[24]。
由于RyR在机体中参与多种调控机制,并且目前对大分子晶体的研究愈发丰富,本文首次对RyR的3种亚型的跨膜结构、理化性质和二级结构等进行分析。结果显示RyR 3种亚型定位于内质网,均具有跨膜结构,预测其整体为亲水性蛋白。有研究报道,RyR蛋白C-末端具有疏水性结构域,并且是跨膜蛋白疏水结构域[25-26],其跨膜结构域形成离子通道。本文结果中,显示在RyR蛋白的C-末端为离子跨膜结构域并具有较高的疏水性氨基酸残基,且后续蛋白信息预测RyR蛋白具有离子通道活性、参与离子转运等,与前人结果一致。RyR所具有的亮氨酸周期性重复出现形成氨基酸拉链,其形成的α-螺旋与下一个α-螺旋相互作用,在RyR同源四聚体中起重要作用。二级结构预测结果显示3种RyR蛋白均含有大量α-螺旋及无规则卷曲,推测α-螺旋及无规则卷曲是RyR的主要二级结构原件。磷酸化以及去磷酸化是重要的细胞内的传导途径,研究表明RyR过度磷酸化可以增加其对钙离子敏感性,引起钙离子紊乱,与心力衰竭以及心律失常等的发生有着密切关系[27]。因此对磷酸化位点的分析至关重要。磷酸化位点分析发现,RyR 3种亚型都具有Ser、Thr 和Tyr 这3 种磷酸化位点,其中Ser位点较多,因此推测丝氨酸最有可能参与其蛋白磷酸化。近几年也多有文章报道丝氨酸可能为RyR磷酸化的潜在靶点,但不是唯一靶点[28-29]。对RyR不同物种的序列进行同源分析,结果显示不同物种间的序列相似性很高,表明其在进化过程中相对保守,说明其具有重要的功能作用从未得以在进化过程中保留。RyR 3种亚型的聚类分析显示,RyR2与RyR3最先聚为一类,亲缘性较高,随后与RyR1聚为一类。蛋白质不是孤立存在于生物体中的,它们之间的相互作用往往发挥着重要的生物学功能,蛋白互作网络分析有助于从系统的角度研究蛋白之间的相互作用,结果显示RyR蛋白3种亚型均与FKBP1B、CALM、TRDN等蛋白具有相互作用,FKBP1B可与RyR形成复合体从而稳定RyR通道,对其功能进行调节[30-31]。钙离子对RyR活性有重要的影响,CALM可与RyR在胞质装配区形成复合体,对RyR的活性进行双向调节[32-33]。TRDN是心肌和骨骼肌钙释放复合体的一个重要组分,是RyR触发骨骼-心肌收缩的关键步骤[34]。
本文从RyR蛋白序列出发,通过生物信息学分析,为进一步研究RyR调控机制提供了理论基础。然而目前生物信息学分析仍存在着一定的局限性,因此采用多软件多平台的综合分析,能够尽可能降低其预测的局限性,提高预测的准确性。此外,还需根据预测的结果,对蛋白重要功能区域的表达进行一系列后续实验验证,从而判定预测结果的准确性。
