接种根内球囊霉提高氮素向甘薯块根转移和再分配的机理
2019-10-16张树海
张树海,李 欢,刘 庆,向 丹
(青岛农业大学资源与环境学院,山东青岛 266109)
甘薯是继水稻、小麦和玉米之后第四大粮食作物,在我国农业生产中占有重要地位[1],氮素是甘薯必需的矿质营养元素之一,是影响其生长和产量形成的首要因素。为了节省劳动力并获得高产,施肥方式多为“一炮轰”,造成肥料利用率很低,效益下降,并对环境造成污染[2]。如何保持或改善耕地的土壤质量,实现农业生产的稳定、可持续发展是目前亟待解决的重要问题[3]。土壤微生物在养分持续供给及土壤保持中起着举足轻重的作用并受到广泛关注[4]。
在众多的土壤微生物中,丛枝菌根(arbuscular mycorrhiza,AM)是分布最为广泛的菌根类型,地球上80%~90%的被子植物都能形成丛枝菌根[5]。AM真菌能促进植物生长发育,增强寄主植物对养分特别是氮、磷的吸收与利用[6]。研究发现甘薯具有很强的菌根依赖性[7-8]。氮作为甘薯生长的限制性因素[9],可通过接种丛枝菌根提高环境中氮素营养的吸收和转运[10]。AM真菌可以通过根外菌丝吸收环境中的NO3-、NH4+和氨基酸,吸收的氮转运给植株,进而增强甘薯对氮素的吸收[11]。不同生育阶段的甘薯吸收氮的强度和数量不同,甘薯在生长前、中期吸收氮素较多,在块根膨大的后期仍需要一定量的氮素吸收来维持地上部源器官的建成[12]。接种AM真菌能够调控甘薯T/R值,持续供给植物氮、磷养分[13],可缓解因后期氮素供应不足而引起的库源失衡问题[14]。前人研究了菌根促进寄主对土壤中氮素的吸收和同化过程,而对氮素在植物体转移和再分配研究较少。
利用同位素示踪技术研究甘薯对氮素的吸收与分配已有大量报道,大多采用底施15N的方法研究植株对15N吸收和各器官分配的情况[15-16],是一种长期效应的反映[17]。由于底施15N的方法不能区分宿主植物体内氮的增加是由AM真菌的直接吸收作用还是由AM真菌侵染引起宿主植物生长状况改变的间接作用所导致[18]。本研究在甘薯特定生长时期进行15N的木质部定量注射方法,研究甘薯对氮素的同化和转移分配,它能够反映氮素运转的瞬时变化。本试验通过甘薯不同生育时期木质部注射(15NH4)2SO4,定量分析接种AM真菌对甘薯氮素转移和再分配的动态影响,研究AM真菌对甘薯的侵染率及叶片氮代谢酶活性的影响,探索甘薯氮素吸收后在植株体内的利用和再分配规律,为充分利用AM真菌资源提高甘薯产量和品质提供理论依据。
1 材料与方法
1.1 试验设计
试验于2018年5月10日至8月10日在青岛农业大学日光温室进行,温度保持22~32℃。供试土壤取自0—20 cm耕层土壤,其基础养分含量为:有机质14.8 g/kg、碱解氮30.9 mg/kg、速效磷21.5 mg/kg、速效钾47.2 mg/kg。供试甘薯(Ipomoea batatasL.)品种为北方区主栽品种龙薯9号(cv.Longshu-9),选取长势相同的甘薯幼苗定植于营养钵中,每盆定植一株。供试菌种为一种根内球囊霉Glomus intraradicesBEG141,由北京市农林科学院提供。试验采用250 mm × 320 mm塑料盆作为培养容器,每盆装入8 kg过2 mm筛的灭菌土。试验设接种丛枝菌根真菌(+AM)和不接种丛枝菌根真菌(-AM)两个处理,接种菌根真菌的处理加100 g菌剂与土壤混合,不接种的处理加100 g灭菌的菌剂再加入10 mL菌种滤液以保持微生物区系一致。
参照Yanbo等[19]方法,于移栽后30、60和90 d从甘薯茎蔓顶部往下数第5片完全展开叶的叶柄与茎蔓交叉处进行15N定量注射。注射方法为:每处理选取长势均匀的4株甘薯,用微量注射器在茎蔓木质部注射20 µL浓度为3.32 mg/L的99%(15NH4)2SO4(上海化工研究院提供)溶液,每天注射一次,连续注射3次,15N总注射体积60 µL,总注射量为15N 200 µg/株,注射完成后三天,将每处理标记的4株甘薯收获,收获后分为茎、叶、纤维根和块根4部分进行指标测定。各处理施用等量的尿素、磷酸二氢钾和硫酸钾做底肥,每个处理4次重复,完全随机排列。
1.2 测定项目与方法
1.2.1 生物量干重 将植株分为叶、茎蔓、纤维根和块根四部分,105℃杀青30 min后75℃烘干至恒重。
1.2.2 根系侵染率 称取0.5 g鲜根,按照Smith等[20]的方法透明、酸化,用曲利苯蓝(Trypan blue)染色,乳酸甘油脱色,然后选取30条根段,制片,镜检。
1.2.3 样品15N丰度 样品磨碎过筛后在中国农业大学资源与环境学院稳定性同位素实验室用质谱仪(Delta Plus;Thermo Electron Corp.,San Jose,CA)测定。
1.2.4 硝酸还原酶、谷氨酰胺合成酶、谷氨酸合成酶和谷氨酸脱氢酶活性 取第5片完全展开叶,参照Lin等[21]和Zhang等[22]的方法测定。
1.3 计算公式
Ndff(%)=(样品15N丰度% -15N自然丰度)/(硫酸铵15N丰度% -15N自然丰度)× 100;
15N 吸收量(µg)= 干重(g)× N 含量(%)× Ndff(%)× 106;
15N分配率=器官15N吸收量/植株总15N吸收量;
注射15N利用率=植株总15N吸收量/植株15N总注射量。
1.4 数据分析
用 SPSS(18.0)(SPSS Institute,Inc.,Cary,NC,USA)进行数据统计分析,通过t检验比较同一生育期处理间的效应差异,F检验比较不同生育期间的处理效应差异,LSD法比较平均数间的差异显著性。
2 结果与分析
2.1 接种AM真菌对甘薯侵染率、生物量和氮素吸收的影响
由表1可以看出,未接种菌根真菌(-AM)的处理菌根侵染率约为2%,可忽略不计。接种菌根真菌的处理显著增加了甘薯的侵染率及泡囊丰度、根内菌丝丰度等菌根指标(P<0.05)。随着移栽天数的增加,丛枝丰度和菌丝丰度增幅变小,而泡囊丰度增幅加大,侵染率显著增加,最高达到67%。表明随着植株生物量的增大,甘薯对菌根依赖性增强。双因素分析表明,时间因素对根系侵染存在显著的正交互效应(丛枝丰度除外)。
与对照相比,移栽后30 d,AM处理的甘薯生物量和氮素累积量与对照差异不显著(P<0.05),移栽60天和90天时,甘薯地上和地下部生物量和氮素积累量都显著高于对照(P<0.05)。双因素分析表明,时间与菌根存在正交互效应,时间因素对甘薯生物量干重及氮素累积增加的影响大于接种菌根效应(P<0.05)。说明随着侵染强度的增加,菌根的正效应逐渐增大(表2)。
2.2 接种AM真菌对甘薯各器官15N积累量和分配率的影响
甘薯发根结薯期(移栽后30天)15N积累量表现为茎蔓>叶片>块根>纤维根,其中15N 在茎蔓和叶片中的积累量明显高于块根和纤维根(P<0.05)。与CK处理相比,接种AM真菌能提高甘薯各器官中15N积累量,尤其是茎和叶的15N积累量增幅明显。表明接种AM真菌能显著提高甘薯地上部器官15N的积累,促进源器官的建成(图1)。
移栽后60天(薯蔓并长期),叶片中15N积累量较前一时期显著增加,地上部15N积累量明显高于地下部。接种AM真菌的甘薯,其叶片和茎蔓中15N积累量显著高于未接种处理(P<0.05),同时块根中15N积累量也显著高于未接种处理(P<0.05)。表明接种AM真菌有利于氮素在甘薯营养生长和储藏器官生长并存时期向茎、叶运输,同时也开始向块根运输。

表1 接种AM真菌后各时期甘薯的侵染率、泡囊丰度、丛枝丰度和菌丝丰度(%)Table1 Root colonization rate, vesicle frequency, arbuscular frequency and hyphae density of sweet potato plants at different growing stages after arbuscular mycorrhiza inoculation

表2 接种AM真菌处理后不同时期甘薯的生物量、氮素含量及氮素积累量Table2 Biomass, nitrogen content and nitrogen accumulation of sweet potato at different growing stages after arbuscular mycorrhiza inoculation
薯块膨大期(移栽后90天),甘薯纤维根和块根中15N积累量较30天和60天均显著增加。与CK相比,接种AM真菌地上部15N积累量显著降低而块根15N积累量显著增加(P<0.05)。表明接种AM真菌有利于氮素由地上部向块根的转移,促进地下部干物质积累。
三个生长期在接种AM真菌条件下甘薯各器官15N 分配率存在差异,均表现为茎蔓>叶>块根>纤维根(图2)。发根结薯期(30 d)和薯蔓并长期(60 d),接种菌根处理甘薯茎蔓和叶片的15N分配率均高于对照处理,差异达显著性水平(P<0.05)。通过木质部注射的15N多分配于地上部,约占总分配率的90%,表明接种AM真菌有利于提高地上部15N分配率。薯块膨大期(90 d),接种AM真菌后块根和纤维根中15N分配率较前两个时期显著上升,而叶片中15N分配率逐渐降低,表明氮素开始主要向块根转移。

图1 不同取样期接种AM真菌后甘薯各器官中15N的积累量Fig.1 15N accumulations in sweet potato organs in different days affected by AM inoculation
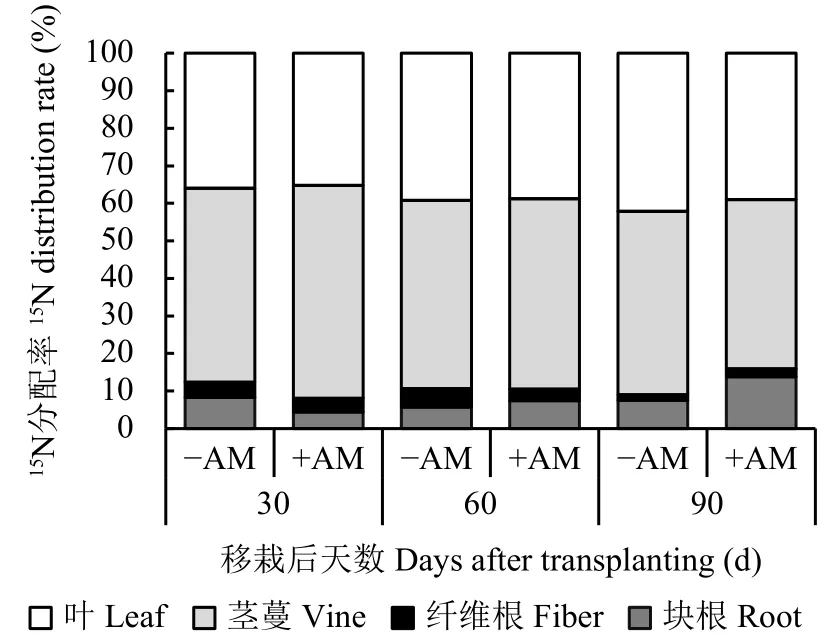
图2 接种AM真菌后不同取样时期甘薯各器官中15N的分配率Fig.2 15N allocation rate in sweet potato organs in different days affected by AM fungi inoculation
2.3 接种AM真菌对甘薯氮代谢酶活性的影响
移栽后30 d,接种菌根真菌显著提高了甘薯叶片谷氨酸脱氢酶(GDH)和谷氨酰胺合成酶(GS)活性(P<0.05),硝酸还原酶(NR)和谷氨酸合成酶(GOGAT)活性没有显著变化。移栽后60 d,接种菌根显著提高了GDH、GS和GOGAT酶活性,叶片中15N积累量较前一时期显著增加。移栽后90天,与不接种处理相比,接种菌根显著提高了4种氮代谢酶活性(P<0.05),GDH、GS和GOGAT酶活性增幅分别为16.8%、28.7%和34.3%,其中GDH和GS酶活性较前两个时期显著增加,NR和GOGAT酶活性较其他时期无显著性变化。双因素分析表明,不同生育期与接种菌根真菌的交互作用对甘薯叶片中GDH和GS酶活性有显著效应(P<0.05,表3)。
接种菌根真菌提高了甘薯氮代谢酶活性,改变了氮在甘薯体内的转移和分配。接种AM真菌的甘薯,其叶片和茎蔓中15N积累量显著高于未接种处理,同时块根中15N积累量也显著高于未接种处理(P< 0.05)。表明接种AM真菌有利于氮素在甘薯营养生长和储藏生长并存时期向茎、叶运输,同时也开始向块根运输。移栽后90 d,甘薯纤维根和块根中15N积累量较30 d和60 d均显著增加。与未接种AM真菌相比,接种AM真菌处理地上部15N积累量显著降低而块根15N积累量显著增加(P<0.05)。表明接种AM真菌有利于氮素由地上部向块根的转移,促进地下部干物质积累。
3 讨论
甘薯产量的形成取决于库源关系的调控,促进碳、氮同化物向甘薯块根转运是甘薯获得高产的关键[23]。本研究表明,接种AM真菌对甘薯不同生育期氮素转移和分配的影响存在差异。AM真菌在发根结薯期(前期)能显著提高15N向叶片转移速率(P<0.05),叶片15N积累量比CK处理分别提高了44%和17%。薯蔓并长期(中期)除能显著提高15N向叶片转移速率外,同时也开始比对照显著提高15N向块根转移速率(P<0.05)。而薯块膨大期(后期),接种AM真菌显著降低15N向叶片中转移量,向块根的转移量显著提高(P<0.05)。甘薯发根结薯期和薯蔓并长期是库源关系建立初期,地上部需不断增加源规模以满足生长后期块根膨大所需,此时代谢中心是甘薯的地上部[24]。接种AM真菌能够维持较高的净光合速率并提高氮代谢酶活性,增加叶片中氮代谢同化力[25],较高的氮代谢速率导致注射的15N优先分配到地上部叶片中,这与李忠武等[26]的研究结果类似。薯块膨大期,地上部光合产物开始向块根转移,此时块根成为新的代谢中心[27]。薯块膨大期接种的菌根促进了氮素向地下部“库”转移,增加块根中15N积累量及分配率。这与汪顺义等[17]的研究结果类似。因此,接种AM真菌可提高块根对15N的征调能力,加速地上部积累氮素向地下部转运,进而增加储藏(产量)器官中的干物质积累。

表3 接种AM真菌后甘薯叶片不同生长时期NR、GDH、GS、GOGAT酶活性Table3 Activity of NR, GDH, GS and GOGAT in sweet potato leaves at different growing stages affected by AM inoculation
氮代谢是甘薯体内最为重要的代谢之一,氮素在甘薯内的积累与分配受到氮代谢中关键酶的调控。无机氮在植物体内的同化方式主要是通过GS—GOGAT途径,其中硝酸还原酶和谷氨酰胺合成酶是两个重要的限速酶[28-29]。AM真菌与植物形成共生体在一定程度上影响了植物的代谢系统,接种AM真菌通常会改变植物地上部NR和GS的活性[30]。Azcon和Tobar[31]研究发现接种集球囊霉(Glomus fasciculatum)可显著提高洋葱地上部的NR和GS活性。本研究发现,在甘薯不同的生育期接种AM真菌均能提高NR、GDH、GS和GOGA活性。表明通过接种AM真菌,能够促进甘薯植株内无机氮向有机氮的转化,增加植株内氨基酸和蛋白类物质的积累。另外,根内球囊霉(G. intraradices)的根外菌丝中含有谷氨酰胺合成酶和谷氨酸合成酶,Jin[32]等利用气相色谱法/质谱法、高性能液相色谱法发现AM真菌在根外菌丝体内能够合成硝酸还原酶、谷氨酰胺合成酶和谷氨酸合成酶。因此,菌根真菌通过直接作用和间接作用促进了氮素在甘薯体内的代谢[33]。
4 结论
接种AM真菌可以改善甘薯的营养状况,提高甘薯叶片中氮代谢酶活性,从而促进甘薯植株内无机氮向有机氮的转化,同时也提高了块根对15N的征调能力,加速地上部积累氮素向地下部转运,进而增加产量器官中的干物质积累。
