六味安消散对MFC 胃癌荷瘤小鼠的抑瘤作用
2019-10-16李洪清
李洪清, 齐 欣
(1.内蒙古民族大学附属医院消化科,内蒙古 通辽028007;2.中国人民解放军总医院海南医院消化科,海南 三亚572013)
胃癌以高发病率、高病死率、高隐匿性为主要特征,是常见的恶性肿瘤,发病率仅次于肺癌[1],患者确诊时大多为中晚期,已经失去了最佳手术的机会;化疗药物由于严重的毒副作用,很多患者不能耐受,并且免疫抑制、肿瘤耐药等因素也是限制疗效的主要原因[2],故越来越多的研究者将目光转移到传统医学领域,以期找到低毒副作用、高疗效的药物。六味安消散由碱花、大黄、山柰、诃子、藏木香、寒水石6 味药材组成,具有解痉、化积消食之功效,临床上主要用于胃痉挛、胎衣滞留、大便秘结、胃腹胀满、食积不化等症状的治疗[3],方中大黄、山柰、藏木香、寒水石具有抗肿瘤作用,而碱花、诃子具有调节免疫功能,但其抗肿瘤及免疫调节作用尚无报道。
MFC 细胞来源于小鼠前胃鳞癌移植瘤组织,易于培养,生长能力旺盛,接种至小鼠体内后更容易形成肿瘤,是建立相关模型最常用的细胞株之一[4]。因此,本实验以MFC 胃癌荷瘤小鼠为模型,探讨六味安消散抑瘤作用及免疫调节作用,为其在胃癌治疗方面的开发应用奠定基础。
1 材料
1.1 动物与细胞株 BalB/C 小鼠,清洁级,体质量(20±2) g,购于北京维通利华实验动物技术有限公司,许可证号SYXK(京)2017-0033。小鼠胃癌MFC 细胞株由上海拜格生物公司提供。
1.2 试药 六味安消散购于内蒙古民族大学附属医院蒙药制剂室,内药制字M13060034。噻唑蓝(MTT) 检测试剂盒购于美国Sigma 公司;碱性磷酸酶抗碱性磷酸酶免疫复合物(APAAP) 购于上海钰博生物科技有限公司;CD4、CD25 单克隆抗体购于美国BD 公司;肿瘤坏死因子-α(TNF-α)、白细胞介素-2(IL-2) 检测试剂盒购于上海纪宁生物科技有限公司。
1.3 仪器 分析天平(型号BSM-120,上海卓精电子科技有限公司);细胞培养箱(型号HPX-9052MBE,上海博迅医疗生物仪器股份有限公司);紫外可见分光光度计(型号UV-2102PCS,美国尤尼柯公司),全自动酶标仪(型号ELx800,美国宝特公司)。
2 方法
2.1 分组及给药 取对数生长期MFC 细胞,调整密度为2×106/mL,在小鼠右侧腋下接种0.2 mL,1 周后可见米粒大小肿瘤,提示建模成功。取建模成功的小鼠60 只,随机分为模型组、5-氟尿嘧啶组(0.02 g/kg) 及六味安消散高、中、低剂量组(8、4、2 g/kg),每组12 只,灌胃给药,1 次/d。给药期间,每天称定小鼠体质量,并观察小鼠毛发、食欲、精神等一般状态。
2.2 瘤重、抑瘤率及脾脏、胸腺指数测定 给药14 d 后,颈椎脱臼处死小鼠,小心剖取肿瘤、脾脏、胸腺,磷酸盐缓冲液冲洗残留血迹,滤纸吸干,精密称定质量,计算抑瘤率及脾脏、胸腺指数。抑瘤率= [ (模型组瘤重-给药组瘤重) /模型组瘤重] ×100%,脾脏指数=脾脏重/体质量,胸腺指数=胸腺重/体质量。
2.3 CD4+、CD4+CD25+T 细胞比例测定 取各组小鼠脾脏,去除脂肪和结缔组织,剪碎,置于含10%小牛血清的RPMI-1640 培养液中,过200 目细胞筛。低温条件下加红细胞裂解液离心,Hank’s漂洗3 次后,重悬于含10%小牛血清的RPMI-1640 培养液中,APAAP 法测定细胞比例。
2.4 炎性因子水平测定 给药14 d 后,小鼠摘眼球取血,酶联免疫吸附(ELISA) 法检测外周血TNF-α、IL-2 水平。
2.5 统计学分析 通过SPSS17.0 软件进行处理,数据以表示,2 组间比较采用LDS-t 检验,多组间比较采用单因素方差分析。以P<0.05 表示差异具有统计学意义。
3 结果
表1 六味安消散对小鼠体质量的影响n=12)

表1 六味安消散对小鼠体质量的影响n=12)
注:与模型组比较,*P<0.05,**P<0.01
组别 (g剂·k量g-/1) 给药前体质量/g给药后模型组 — 21.75±1.32 20.90±2.04 5-氟尿嘧啶组 0.02 22.13±1.45 17.61±3.23**六味安消散高剂量组 8 22.05±1.18 26.33±3.20**六味安消散中剂量组 4 21.81±0.97 24.29±2.62**六味安消散低剂量组 2 22.26±1.24 23.68±2.71*
3.1 六味安消散对小鼠体质量的影响 表1 显示,给药前各组小鼠体质量差异无统计学意义(P>0.05);给药后,与模型组比较,5-氟尿嘧啶组小鼠体质量显著下降,而六味安消散组显著增加(P<0.05,P<0.01)。此外,模型组、5-氟尿嘧啶组小鼠毛发暗淡,食欲不佳,精神萎靡;六味安消散组小鼠毛发光泽,食欲佳,精神良好。
3.2 六味安消散对瘤重的影响 表2 显示,与模型组比较,六味安消散组小鼠瘤重显著下降(P<0.01),并呈明显的剂量依赖关系。
表2 六味安消散对小鼠瘤重的影响,n=12)

表2 六味安消散对小鼠瘤重的影响,n=12)
注:与模型组比较,**P<0.01
组别 剂量/(g·kg-1) 瘤重/g 抑瘤率/%模型组 — 0.74±0.11 —5-氟尿嘧啶组 0.02 0.33±0.05** 55.4六味安消散高剂量组 8 0.49±0.06** 33.8六味安消散中剂量组 4 0.55±0.07** 25.6六味安消散低剂量组 2 0.58±0.06** 21.6
3.3 六味安消散对小鼠免疫器官的影响 表3 显示,与模型组比较,5-氟尿嘧啶组脾脏、胸腺指数均有不同程度的下降(P<0.01),而六味安消散组2 种指数显著增加(P<0.05,P<0.01)。
表3 六味安消散对小鼠免疫器官的影响n=12)
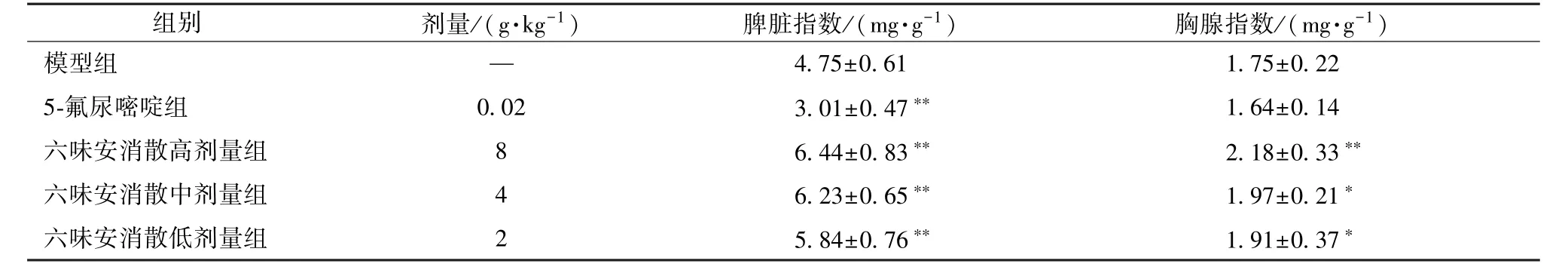
表3 六味安消散对小鼠免疫器官的影响n=12)
注:与模型组比较,*P<0.05,**P<0.01
组别 剂量/(g·kg-1) 脾脏指数/(mg·g-1) 胸腺指数/(mg·g-1)模型组 — 4.75±0.61 1.75±0.22 5-氟尿嘧啶组 0.02 3.01±0.47** 1.64±0.14六味安消散高剂量组 8 6.44±0.83** 2.18±0.33**六味安消散中剂量组 4 6.23±0.65** 1.97±0.21*六味安消散低剂量组 2 5.84±0.76** 1.91±0.37*
3.4 六味安消散对CD4+、CD4+CD25+T 细胞表达的影响 表4 显示,与模型组比较,5-氟尿嘧啶组CD4+T 细胞比例显著降低(P<0.01),CD4+CD25+T 细胞比例有所升高,但差异无统计学意义(P>0.05);六味安消散组前者比例显著增加,后者比例显著下降(P<0.05,P<0.01)。
表4 六味安消散对CD4+、CD4+CD25+T 细胞表达的影响n=12)

表4 六味安消散对CD4+、CD4+CD25+T 细胞表达的影响n=12)
注:与模型组比较,*P<0.05,**P<0.01
组别 剂量/(g·kg-1) CD4+T 细胞/% CD4+CD25+T 细胞/%模型组 — 41.08±4.39 1.87±0.25 5-氟尿嘧啶组 0.02 35.51±4.24** 1.96±0.28六味安消散高剂量组 8 49.65±6.53** 0.95±0.17**六味安消散中剂量组 4 47.52±5.22** 1.24±0.12**六味安消散低剂量组 2 46.30±5.41* 1.61±0.20*
3.5 六味安消散对TNF-α、IL-2 水平的影响 表5 显示,与模型组比较,5-氟尿嘧啶组TNF-α、IL-2 水平显著下降(P<0.01),而六味安消散组两者水平显著升高(P<0.05,P<0.01)。
4 讨论
本实验采用移植性肿瘤模型,它可保持机体完整性,不影响外界环境和机体的正常联系,是评价药物抑瘤作用及调节免疫功能的经典模型[5]。给予MFC 胃癌荷瘤小鼠六味安消散后发现,小鼠一般状态好于模型组,体质量明显增加,瘤重下降,提示该药物具有较好的抗肿瘤作用。恶性肿瘤患者往往会出现免疫抑制情况,免疫抑制与预后、临床分期等关系密切,故提高机体免疫功能有利于增加抗肿瘤效果。脾脏和胸腺对机体的免疫能力有标示作用,是机体细胞、体液免疫的主要器官,其脏器指数能在一定水平上评价机体免疫功能的高低[6],本实验发现六味安消散组小鼠脾脏、胸腺指数明显增加,初步判断六味安消散具有提高免疫功能的作用。
表5 六味安消散对TNF-α、IL-2 水平的影响(n=12)

表5 六味安消散对TNF-α、IL-2 水平的影响(n=12)
注:与模型组比较,**P<0.01
组别 剂量/(g·kg-1) TNF-α/(mg·g-1) IL-2/(mg·g-1)模型组 — 62.61±8.22 97.78±13.51 5-氟尿嘧啶组 0.02 47.46±6.94** 66.61±9.67**六味安消散高剂量组 8 123.80±15.86** 137.25±16.03**六味安消散中剂量组 4 108.19±12.52** 128.44±14.50**六味安消散低剂量组 2 92.52±10.14** 119.65±11.54**
调节性T 细胞包括CD4+T 细胞、CD4+CD25+T 细胞、CD8+T 细胞、NK 细胞等多种类型,是保持机体免疫功能的重要因素[7]。其中,CD4+T 细胞在机体免疫中起到正向调节的作用,可根据分化效应细胞的不同分为Treg 细胞、Th1 细胞、Th2 细胞亚群,既往的研究发现,山慈菇多糖可通过提高S180 荷瘤小鼠免疫功能,发挥抗肿瘤作用[8];卢晓婷等[9]报道, 胃癌、 肝癌、 食管癌等恶性肿瘤患者CD4+CD25+T细胞明显多于健康者,它对机体免疫起负向调节作用,而红景天提取物能通过降低肿瘤组织中其比例来增强机体的抗肿瘤免疫应答效果,起到抑制小鼠Lewis 肺癌生长的作用[10]。本实验发现,给予MFC 胃癌荷瘤小鼠六味安消散后CD4+T 细胞比例明显增加,CD4+CD25+T细胞比例明显下降,进一步表明它具有增强免疫功能的作用。
TNF-α、IL-2 是由T 淋巴细胞分泌的、具有免疫调节作用的细胞因子,可反映肿瘤的生长状况,也能体现肿瘤相关的免疫调节活动水平[11]。其中,TNF-α 是目前已知最强的具有抗肿瘤作用的细胞因子,在体内外环境中表现出明显的抗肿瘤作用;IL-2 是细胞免疫因子网络的重要成员,具有增强杀伤细胞功能、促进淋巴细胞有丝分裂、辅助抗体生成等生物学作用[12]。刘亚丽等[13]报道,银杏酚可提升Heps 荷瘤小鼠血清中TNF-α、IL-2 水平,进而改善免疫功能抑制,最终通过提高免疫功能来发挥抗肿瘤作用;本实验同样证实,给予MFC 胃癌荷瘤小鼠六味安消散后2 者水平明显增加,表明其抗肿瘤作用与增加小鼠外周血2 者水平有关。
综上所述,六味安消散可通过提高MFC 胃癌荷瘤小鼠免疫功能来发挥抗肿瘤作用,但具体机制还有待深入研究。
