艾叶挥发油对A549 细胞的抑制作用
2019-10-16丁圆平刘靖怡李艳丽吴明哲赵志鸿
丁圆平, 刘靖怡, 田 洋, 李艳丽, 吴明哲, 赵志鸿
[1.郑州大学药物研究院,河南 郑州450001;2.中国矿业大学(北京) 化学与环境工程学院,北京100083;3.郑州大学第一附属医院,河南 郑州450052;4.河南省(郑州大学) 医药科学研究院,河南郑州450052]
肺癌是目前发病率、死亡率增长最快的恶性肿瘤[1],大多数情况下由于癌细胞高侵袭性,手术无法达到预期效果,而化疗通常会产生严重的副作用,并且近年来新型靶向药物价格昂贵,大大限制了临床推广。前期报道[2-4],中成药毒副反应少,对中晚期肺癌患者具有提高机体免疫力、改善临床症状等作用,正成为当前研究热点。
艾叶为菊科植物艾Artemisia argyi Lévl.et Vant.的干燥叶,具有抗炎、抗菌、抗病毒、镇咳平喘等多种药理作用[5-8],广泛应用于临床,其主要有效成分为艾叶挥发油,前期证实它具有抗HBV、抗肝癌活性[9-10],但尚无其抗肺癌作用的报道。因此,本实验研究艾叶挥发油体内外抗肺癌A549 细胞活性,并初步探讨其作用机制,为相关抗肿瘤新药研发提供依据。
1 材料
1.1 试药 艾叶产自河南驻马店,经河南中医药大学董诚明教授鉴定为正品,其挥发油为实验室自提。RPMI 1640(北京索莱宝科技有限公司);胎牛血清、MTT(美国Sigma 公司);AnnexinV-FITC细胞凋亡检测试剂盒、细胞周期检测试剂盒(江苏凯基生物技术股份有限公司);5-氟尿嘧啶注射液(上海旭东海普药业有限公司)。
1.2 仪器 IL-161CT CO2培养箱[施都凯仪器设备(上海) 有限公司];168-1000XC 酶标仪(美国Bio-Rad 公司); XL-MCL 流式细胞仪 (美国Beckman Coulter 公司)。
1.3 动物 SPF 级雌性BALB/c-nu 裸鼠,周龄5~6周,体质量18~20 g,由北京维通利华实验动物技术有限公司提供, 合格证号SCXK (京)2016-0006,在温度20 ~25 ℃、相对湿度40%~60%的无菌笼中饲养,定期喂食。
2 方法
2.1 挥发油提取 称取艾叶500 g,粉碎后置于10 000 mL 圆底烧瓶中,加入5 000 mL 蒸馏水浸泡过夜,水蒸气蒸馏法提取6 h,收集挥发油,无水硫酸钠除水后密封贮存于-20 ℃下,测得挥发油产率为0.39%。
2.2 细胞培养 A549 细胞贴壁生长,RPMI 1640、胎牛血清以9 ∶1 比例配制成完全培养基,置于37 ℃、5%CO2细胞培养箱中培养,取对数生长期细胞进行实验。
2.3 供试品溶液制备 1 mL 挥发油质量为944 mg。体外药效实验中,取挥发油16 μL,加入24 μL DMSO 混合均匀,培养基逐步稀释,即得(DMSO 最高含有量为0.1%);体内药效实验中,取挥发油1 mL,加入20 μL 吐温-80,混合均匀,生理盐水逐步稀释,即得。
2.4 挥发油对A549 细胞增殖影响 胰酶消化处于对数生长期的A549 细胞,离心,调节细胞密度至5×104~6×104/mL,按每孔100 μL 接种于96 孔板中,37 ℃、5%CO2培养箱中培养24 h,吸去原培 养 基, 加 入 188.8、 283.2、 377.6、 472.0、566.4、660.8 μg/mL 挥发油, 阳性对照组加入10 μg/mL 5-氟尿嘧啶,阴性对照组加入100 μL 空白培养基,每个质量浓度4 个复孔。于24、48、72 h 各加入20 μL MTT 溶液,置于培养箱中孵育4 h,吸去原培养基,加入150 μL DMSO,微量振荡器上振荡10 min 后上机检测,计算细胞增殖抑制率,增殖抑制率= (1-给药孔吸光度/空白孔吸光度) ×100%[11], 重 复3 次, SPSS 软 件 计 算IC50值。
2.5 细胞凋亡率检测 采用Annerxin V-FITC/PI双染法。胰酶消化处于对数生长期的A549 细胞,离心,调节细胞密度至1×105/mL,按每孔2 mL 接种于6 孔板中,37 ℃、5% CO2培养箱中培养24 h,吸去原培养基,加入188.8、236.0、283.2、330.4、377.6、424.8 μg/mL 挥发油培养48 h,不含EDTA 的胰酶消化收集细胞,PBS 缓冲液洗涤2次,加入Annerxin V-FITC、PI 各5 μL,流式细胞仪检测细胞凋亡,重复3 次。
2.6 细胞周期检测 采用PI 单染法。胰酶消化处于对数生长期的A549 细胞,离心,调节细胞密度至1×105/mL, 按每孔2 mL 接种于6 孔板中,37 ℃、5% CO2培养箱中培养24 h,吸去原培养基,加入188.8、236.0、283.2、330.4 μg/mL 挥发油培养48 h,胰酶消化收集细胞,PBS 缓冲液洗涤1 次,70%冷乙醇固定,4 ℃下过夜,PBS 缓冲液洗去固定液,加入PI/RNase A 后室温下避光30 min,流式细胞仪检测细胞周期,重复3 次。
2.7 艾叶挥发油对A549 荷瘤裸鼠肿瘤生长及体质量的影响 裸鼠右背部皮下注射1×107个A549细胞(0.2 mL/只),建立肺癌模型,当肿瘤体积增加到约100 mm3时随机分为5 组,每组5 只,实验组(3 组) 分别腹腔注射230、115、57.5 mg/kg挥发油,阳性组给予5-氟尿嘧啶(10 mg/kg),对照组给予等量生理盐水,连续15 d,每2 d 测量1次肿瘤体积和体质量。第15 天,裸鼠称定质量,测量肿瘤体积后处死,称定瘤重,计算肿瘤生长抑制率,公式为体积=1/2×a×b2(a、b 分别表示肿瘤长径、短径)、抑制率= [ (阴性对照组平均瘤重-实验组平均瘤重) /阴性对照组平均瘤重] ×100%[12]。
2.8 病理组织切片 每组随机取2 只裸鼠,剖离组织器官,生理盐水清洗表面,吸水纸吸干水分,4%甲醛固定,HE 染色法制备病理组织切片,显微镜下观察、拍照。
3 结果
3.1 挥发油对A549 细胞增殖影响 图1 显示,挥发油对A549 细胞增殖具有明显的抑制作用,并呈浓度依赖性。当其质量浓度为660.8 μg/mL 时,48、72 h 细胞生长抑制率均在80%以上,24、48、72 h的IC50值分别为513.54、495.60、484.27 μg/mL。

图1 挥发油对A549 细胞抑制率的影响Fig.1 Effect of volatile oils on the inhibition rate of A549 cells
3.2 挥发油对A549 细胞凋亡的影响 图2~3 显示,挥发油作用A549 细胞48 h 后随着其质量浓度增加,细胞凋亡率也逐渐升高。188.8 ~330.4 μg/mL 时,细胞早期凋亡率无明显变化; 继续增加至377.6 μg/mL时,早期凋亡率骤增;424.8 μg/mL时凋亡率最高,为67.1%。
3.3 挥发油对A549 细胞周期的影响 图4 ~5 显示,挥发油作用于A549 细胞48 h 后,G0/G1 期细胞比例降低,G2/M 期无明显变化,S 期细胞比例增加。随着其质量浓度增加,S 期细胞比例逐渐增加,具有浓度依赖性。
3.4 挥发油对肿瘤生长的影响 表1、图6 ~8 显示,230、115、57.5 mg/kg 挥发油的抑瘤率分别为55.54%、33.85%、19.20%,低于5-氟尿嘧啶组的71.10%,但连续给药5 d 后,5-氟尿嘧啶组裸鼠出现食欲不振、体质量明显下降的现象;挥发油组无明显变化,并较阴性对照组能明显抑制肿瘤生长。

图3 A549 细胞凋亡曲线Fig.3 Apoptosis curves for A549 cells
表1 各组肿瘤质量、抑瘤率的比较Tab.1 Comparison of tumor weights and tumor inhibition rates among various groups
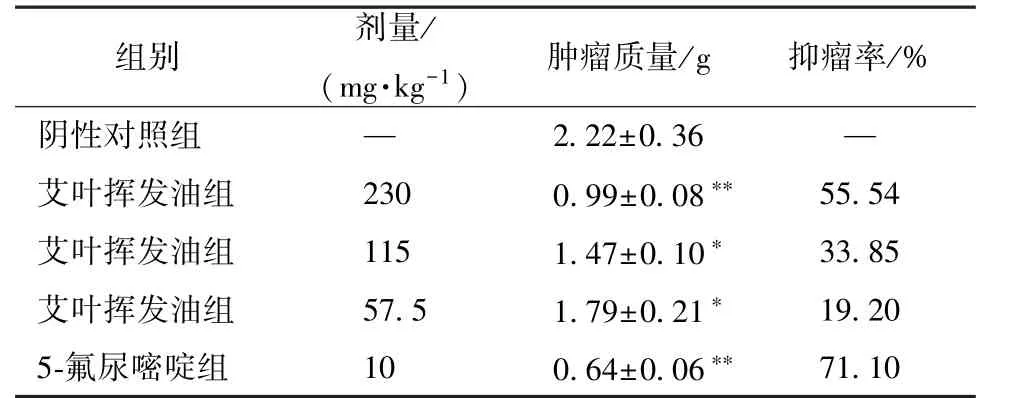
表1 各组肿瘤质量、抑瘤率的比较Tab.1 Comparison of tumor weights and tumor inhibition rates among various groups
注:与阴性对照组比较,*P<0.05,**P<0.01
组别 (m剂g·量kg/-1) 肿瘤质量/g 抑瘤率/%阴性对照组 — 2.22±0.36 —艾叶挥发油组 230 0.99±0.08** 55.54艾叶挥发油组 115 1.47±0.10* 33.85艾叶挥发油组 57.5 1.79±0.21* 19.20 5-氟尿嘧啶组 10 0.64±0.06** 71.10
图4 各组A549 细胞48 h 周期分布(Ⅰ)Fig.4 Cycle distributions of A549 cells at 48 h in various groups(Ⅰ)
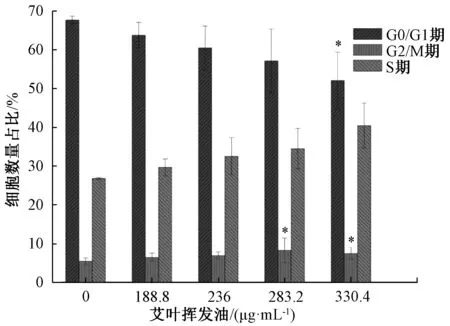
图5 各组A549 细胞48 h 周期分布(Ⅱ)Fig.5 Cycle distributions of A549 cells at 48 h in various groups(Ⅱ)

图6 各组裸鼠肿瘤体积Fig.6 Tumor volumes of nude mice in various groups
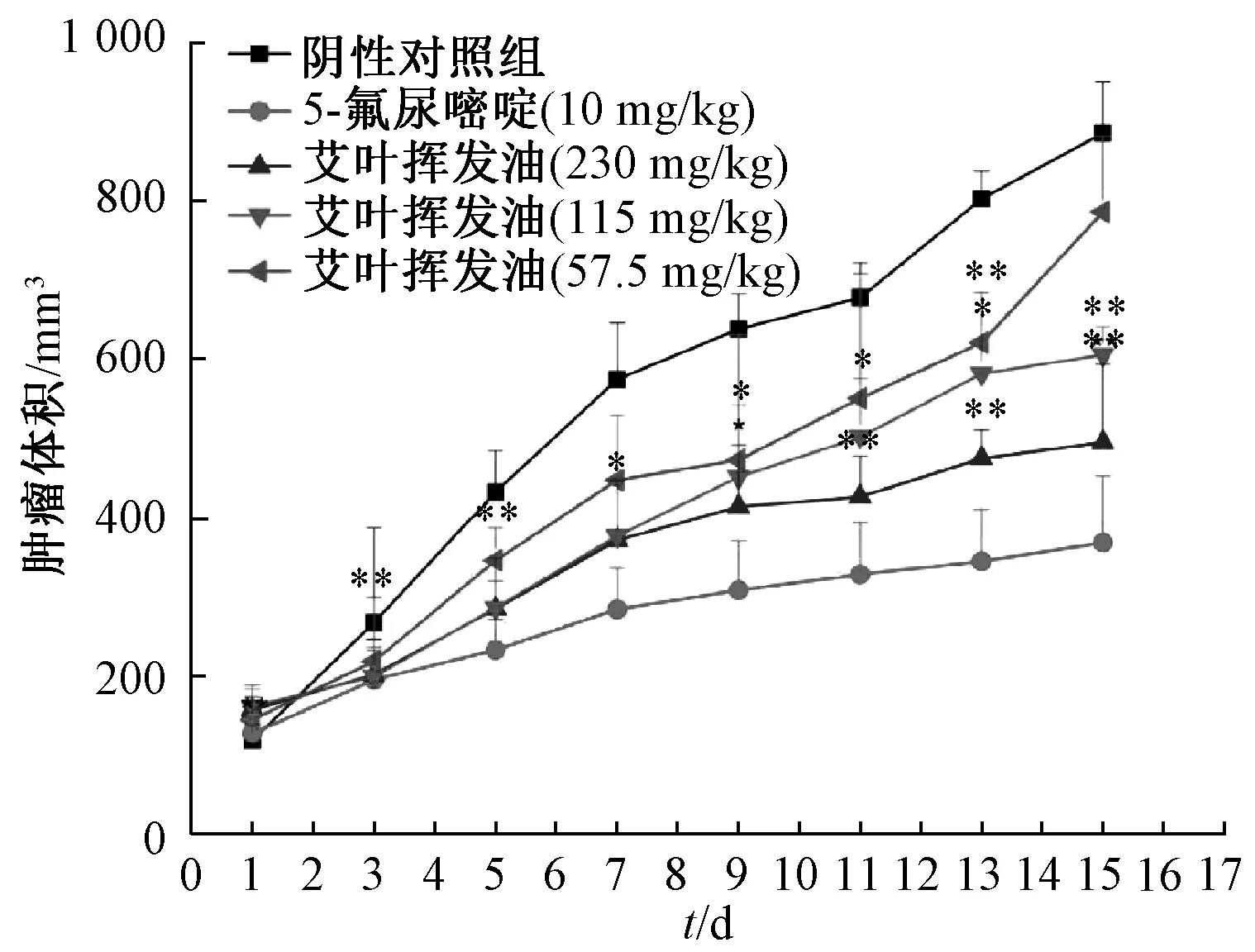
图7 裸鼠肿瘤体积变化曲线Fig.7 Variation curves for tumor volumes of nude mice
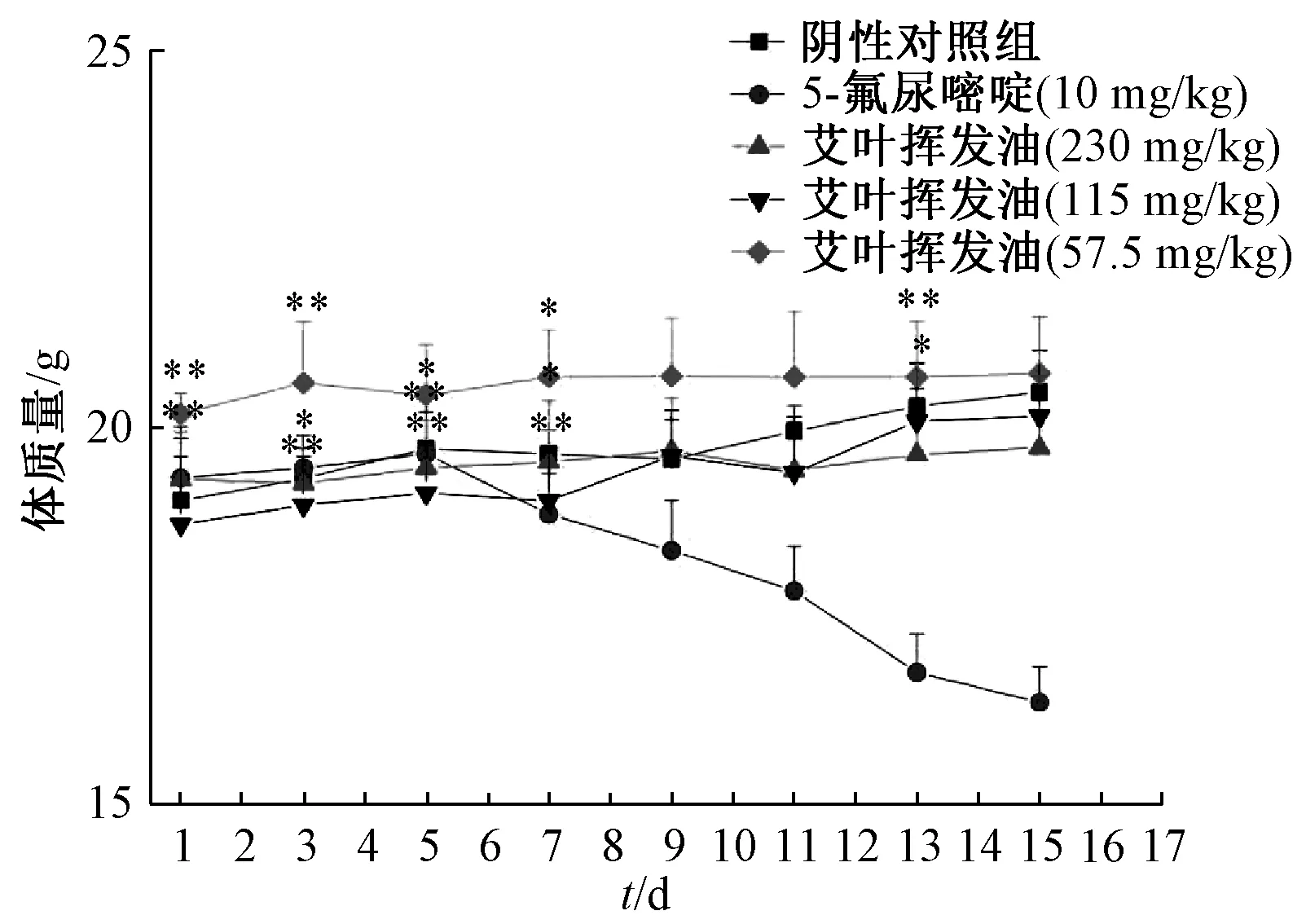
图8 裸鼠体质量变化曲线Fig.8 Variation curves for body weights of nude mice
3.5 病理组织分析 图9 显示,阴性组裸鼠肿瘤细胞排列紊乱紧密,片块状弥散分布,细胞胞浆丰富,细胞核增大,深染,具有明显的异型性;5-氟尿嘧啶组裸鼠肿瘤组织出现明显局灶性坏死,肿瘤细胞核分裂相减少,核固缩、碎裂、溶解,出现大片坏死;艾叶挥发油低剂量组裸鼠肿瘤细胞细胞排列紧密,部分出现萎缩,细胞界限模糊,未呈现典型凋亡状态;艾叶挥发油高剂量组裸鼠肿瘤细胞体积减小,细胞间隙增大,核浆比例缩小,细胞胞核染色变浅,核分裂相减少,出现大量凋亡小体,呈现凋亡状态。与阴性对照组比较,5-氟尿嘧啶组裸鼠肺泡壁明显增生变厚,而艾叶挥发油组无明显变化,但出现肺大泡,表明肺部组织发生了病理变化;5-氟尿嘧啶组、艾叶挥发油高剂量组裸鼠肝组织切片中均出现细微裂缝,表明也有部分病变;各组裸鼠心、脾、肾组织HE 病理组织切片显示,各组织内细胞结构紧凑,界限清晰,均未见明显病理学病变和转移瘤灶。

图9 各组裸鼠组织病理学切片Fig.9 Histopathological sections of nude mice in various groups
4 讨论
肺癌具有恶化程度高、治疗效果差、早期症状体征不典型等特点,化疗是最常用的方法,但其自身毒副作用和耐药性又妨碍临床疗效[13-14],临床常见的类型是非小细胞肺癌,其中肺腺癌所占比例最大。A549 细胞属于人肺腺癌细胞系,细胞学水平实验中常被作为标准模式细胞[15]。
艾叶挥发油为小分子物质,能被机体快速吸收,成分复杂,具有多种药理作用,故应用广泛,如呼吸系统、抗菌、抗炎、抗肿瘤等[16-18]。本实验首次发现,艾叶挥发油能明显抑制体外培养人肺癌A549 细胞生长,并呈剂量-时间依赖关系;可通过抑制DNA 合成来使细胞阻滞于S 期,可能是诱导A549 细胞凋亡的机制之一;对裸鼠皮下接种的A549 细胞生长具有抑制作用,其机制可能为诱导A549 细胞凋亡。
在本实验所测浓度范围内,艾叶挥发油抗肿瘤活性虽不如5-氟尿嘧啶,但其对正常细胞毒性较低,而且与阴性对照组相比能明显抑制人肺癌A549 细胞生长速度。故综合考虑,该成分体现出了安全有效、低毒的优势,具有广阔的开发前景,为肺癌治疗提供了新选择。
